磷石膏制备纳米氧化钙基二氧化碳吸附剂工艺的优化*
周静,邹洪涛,邢焰,李锋
(黔南民族师范学院化学与化工系,贵州都匀558000)
磷石膏制备纳米氧化钙基二氧化碳吸附剂工艺的优化*
周静,邹洪涛,邢焰,李锋
(黔南民族师范学院化学与化工系,贵州都匀558000)
以磷石膏作为钙源,优化了磷石膏制备氧化钙基二氧化碳吸附剂的工艺参数(反应时间、反应温度、二氧化碳通量、搅拌速度和杂质含量),并考察了纳米氧化钙基二氧化碳吸附剂粒径对吸附性能的影响。得到的最佳工艺条件为:反应时间为50 min,温度为30℃,二氧化碳通量为251 mL/min,搅拌速率越慢越好,杂质含量越少越好。纳米氧化钙基二氧化碳吸附剂的粒径越小,其吸附量就越大,吸附速率也越快,其稳定性也就越高。
磷石膏;纳米氧化钙;吸附剂;优化
近年来工业经济的发展所带来的全球性的环境问题已经引起全世界人民的关注,尤其是全球变暖问题[1]。全球变暖主要是由于人为温室气体(如CO2)的排放造成的。因此,控制和降低CO2的排放成为了经济可持续发展和维护良好生态环境的重要举措。目前,传统的脱CO2技术主要有化学吸附、物理吸附两种,随着近年来CO2吸附技术和理论的不断发展,固体吸附剂脱碳技术、氧化钙基吸附剂应用越来越广[2-4]。尤其是纳米CaO基CO2吸附剂,由于具有分解温度低、吸附速率快和吸附容量大等优点,其应用领域非常广泛。
随着磷肥和高效磷酸工业的迅速发展,磷石膏废渣的排放量日益增加。磷石膏是湿法磷酸生产过程中排放的固体工业废料,主要成分是二水硫酸钙,质量分数大约为92%。将磷石膏中的CaSO4转化成CaCO3,再由CaCO3制备CaO基CO2吸附剂,这是一条获得廉价的CaO基CO2吸附剂的途径[5]。因此,本文以磷石膏作为钙源,优化了由磷石膏制备纳米氧化钙基CO2吸附剂工艺。
1 材料与方法
1.1试剂和原料
磷石膏;普通CO2气体(纯度为99%);盐酸、氨水、铬酸钡、硫酸钠、氧化铁,均为分析纯。
1.2磷石膏制备纳米CaO方法
取70 g磷石膏,按照磷石膏和水的质量比为1∶8加入磷石膏70 g、水560 g,混匀后形成磷石膏浆料。然后加入73 mL氨水,加入氨的物质的量为磷石膏中硫酸根物质的量的2.5倍。初始温度为30℃,持续搅拌的过程中通入二氧化碳气体,同时用pH计测定浆液的pH,即可得碳酸钙料浆,然后过滤得固体,干燥之后即为纳米CaCO3。将磷石膏制备的纳米CaCO3在850℃煅烧即可得到纳米CaO基吸附剂。
1.3样品的表征
1.3.1热重分析氧化钙的含量
热重分析是在过程控制温度下,测量物质的质量与温度关系的一种技术。在该工作中,采用PerkinElmer TGA7型热重仪测定氧化钙含量,加热范围为50~700℃,升温速率为5℃/min,在20 mL/min氮气流中进行。
1.3.2粒度分布
样品的粒度由LS-230 Coulter激光粒度测定仪测定,其测量范围为0.04~2 000 μm。
1.3.3孔径的分布
N2吸附脱附分析采用ASAP 2020型物理化学吸附仪,样品首先在80℃下脱气12 h,之后进行N2吸附,催化剂比表面积计算基于BJH方程。
1.4吸附剂吸附性能的评价
吸附容量也采用PerkinElmer TGA7型热重仪进行,在N2气氛中,吸附剂以15℃/min的加热速率升温至分解温度750℃,保持10 min,保证CaCO3能够完全分解,然后以40℃/min的降温速率降温至吸附温度。当温度为设定的吸附温度600℃或650℃时,气氛切换为含有20%(体积分数)CO2的气氛,吸附剂在此条件下保持10 min。吸附容量=吸附CO2质量/吸附剂的质量。
2 结果与讨论
2.1反应时间、反应温度的优化
图1为反应时间对CaO粒径的影响。从图1可以看出,当反应时间为50 min时,CaO样品的粒径较小,粒径主要分布于40~500 nm的范围内,数均粒径为104 nm。当时间延长到160 min时,CaO的粒径范围明显增加,达到了0.1~2 μm,而且数均粒径相比50 min时也增加了111 nm,达到了215 nm。因此,反应时间的延长不仅增宽了CaO样品的粒径范围,而且增加了数均粒径,数均粒径增加了一倍之多。这可能是因为CaO小粒径颗粒具有较高的表面自由能,较高的自由能更趋向于向低自由能转变。他们很容易聚集在一起从而生成粒径更大的样品。由分子自由运动的基本原理可知,温度越高,分子运动越剧烈,分子间的碰撞也就越大,形成大颗粒的机会也就越多[6]。因此,温度越高,形成大粒径就会越容易。反之,则相反。因此,优化得到的最佳反应时间为50 min。
反应温度对CaO样品的颗粒有着非常重要的影响。一方面,温度对磷石膏中碳酸钙的溶解性有影响,温度越高,溶解性越高[7];另一方面,温度还直接影响反应的扩散速率和反应速率,温度越高,反应速率越高,扩散速率越强[8]。因此,首先考察了不同温度对CaO含量的影响,结果见图2。从图2可知,随着温度的升高,CaO的含量在逐步的增加。在温度为40℃时,3个不同的CO2通量,其CaO含量均达到了最大值。温度过低,反应速率过低,导致其含量偏低;而温度过高,氨气的挥发较为严重。为了获得最佳温度,进一步考察了不同的温度对粒径的影响。
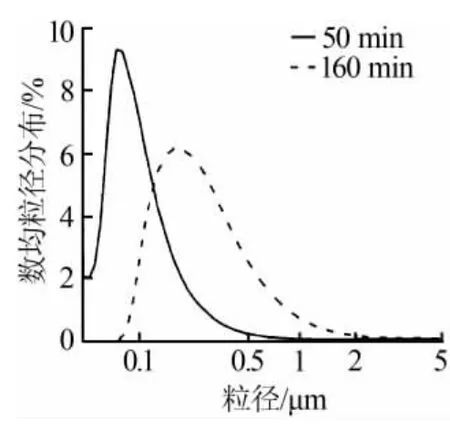
图1 反应时间对CaO粒径的影响
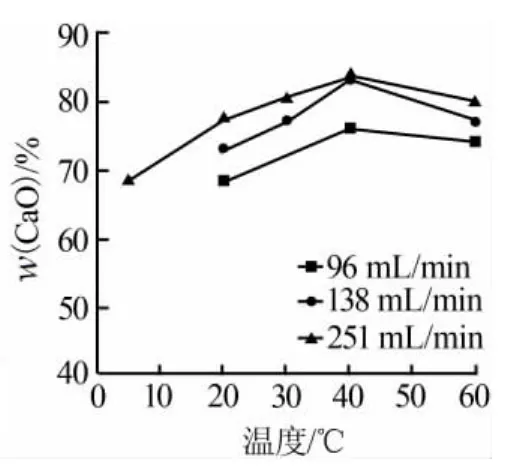
图2 反应温度对CaO含量的影响
图3为CO2通量为251、138mL/min下,不同温度下制得的CaO粒径分布图。从图3a可知,在CO2通量为251 mL/min时,30℃时制备得到的CaO的粒径很明显比其他两个温度的小,并且分布峰窄。30℃时CaO样品的数均粒径为86 nm,比20℃时的284 nm和40℃时的260nm都要小很多。当温度为50、60℃时,制备的CaO样品结块严重,因此不做粒径比较。
由图3b可知,在流量为138 mL/min时,30℃时和40℃时的CaO粒径分布峰几乎重叠,只是温度为30℃时的峰略微高一点。其中温度为30、40℃时,CaO样品的数均粒径分别为109、104 nm,比20℃的156 nm低30%左右。从图3可以看出,温度为30℃时制备得到的CaO粒径最小,粒径分布最窄,30℃为较优的制备温度。反应温度低,生成的CaO速率慢,导致溶液里积累大量的碳酸根,从而导致局部浓度过大,生成大颗粒;而温度过高,则会导致反应速率加快,粒径生长速率过快,并且高温也会导致颗粒势能增加,容易碰撞聚并生长[9]。
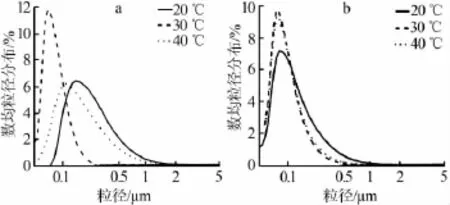
图3 反应温度对CaO粒径的影响
2.2CO2流量的优化
为了得到最优的CO2流量,考察了不同温度(20、40℃)条件下,CO2的不同通量对CaO粒径的影响。由图4a可知,在温度为20℃的情况下,随着CO2通量的增加,CaO颗粒粒径的范围在增加,当CO2的流量为96 mL/min时,其颗粒粒径的分布范围非常窄,基本上都处于纳米范围之内。从图4b可以看出,在温度为40℃条件下,当CO2的通量为60 mL/min时,CaO的粒径分布最窄,且平均粒径最小,比在CO2通量为120 mL/min时的115 nm小11 nm,不到CO2通量为240 mL/min时的1/2,是CO2通量为360 mL/min时的1/3。温度低,反应速率慢,如果通入CO2的量大,则会造成碳酸根离子的富集,导致局部浓度过高,对形成小粒径颗粒不利;而温度为40℃时,反应速率加快,但是高温不利于成核反应,而只有通过增加溶液中的过饱和度增加成核速率,降低CaO粒径,CO2通量大于251 mL/min时,同样存在局部反应过快,晶核集聚生长,不利于小尺寸颗粒形成。选择CO2通量为251 mL/min为最佳值。

图4 CO2流量对CaO粒径的影响
2.3搅拌速率的优化及杂质对CaO粒径的影响
图5为温度为20℃、CO2流量为138 mL/min条件下,不同的搅拌速度对生成CaO粒径的影响。从图5可以看出,搅拌速度越低,越有利于纳米CaO吸附剂的生成。其中慢搅拌速度下样品平均粒径为113 nm,快搅拌速度下样品平均粒径为140 nm。这可能是因为,搅拌速率越低,其反应的速率也就越低,晶核与晶核之间的碰撞也就越少,这样晶核之间形成大颗粒的概率就会降低[10]。
由于磷石膏和市售的分析纯的CaCO3在组成成分上有着很大的不同,其中一些杂质对于CaO粒径的影响还是非常大的,如磷酸,F-及其他金属离子,这些离子有的参与反应,有的抑制反应的进行。通过对磷石膏冲洗和未冲洗来考察其杂质含量的不同对CaO粒径的影响,结果见图6。从图6可看出,磷石膏冲洗后制备的CaO的粒径分布主峰稍微窄一些,数均粒径为73 nm,比未冲洗磷石膏制备的CaO小13 nm。
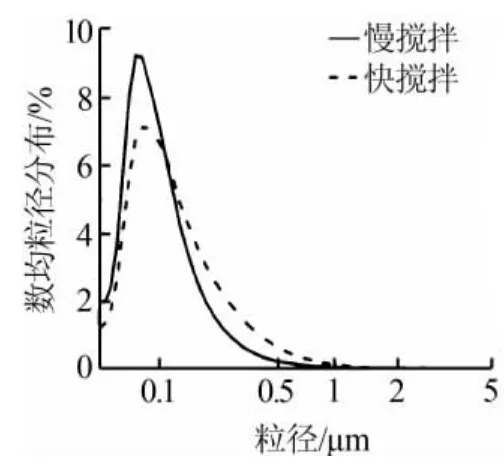
图5 不同搅拌速率对CaO粒径的影响
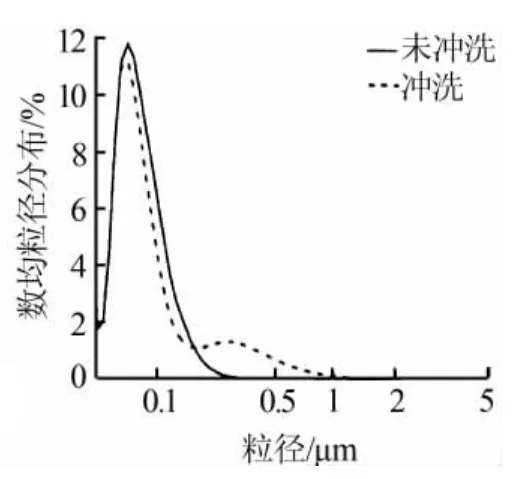
图6 可溶杂质对CaO粒径的影响
2.4纳米氧化钙基CO2吸附剂粒径对吸附性能的影响
2.4.1纳米氧化钙基CO2吸附剂粒径对吸附活性的影响
一般而言,吸附剂的活性主要包括吸附剂的吸附容量和吸附速率。而粒径的大小对吸附剂的活性有着非常直接的影响[11]。图7反应出了制备的氧化钙基吸附剂在温度为600℃和20%CO2环境下的吸附曲线和吸附速率曲线。从图7可以看出,粒径越小,CaO基CO2吸附剂的吸附容量越高。当氧化钙基的粒径为73 nm时,其吸附容量最大值为0.34 g/g,并且和粒径为86nm时的吸附容量最大值非常相近。
从一般的吸附特性可知,吸附剂的吸附曲线可分为快速反应段和随后的扩散控制段。不同的氧化钙基CO2吸附剂粒径对吸附速率的影响见图8。从图8可以看出,粒径不同,两个阶段吸附转化率所占的比重并不一样。粒径越小,其快速反应阶段所占的比例就越大,反之则相反。当粒径为260 nm时,快速反应阶段所占的比例仅为47%,而当粒径为73 nm时,快速反应阶段的比例已经高达74%。而且只要粒径大于100 nm时,氧化钙基CO2快速反应阶段所占的比例都低于50%。
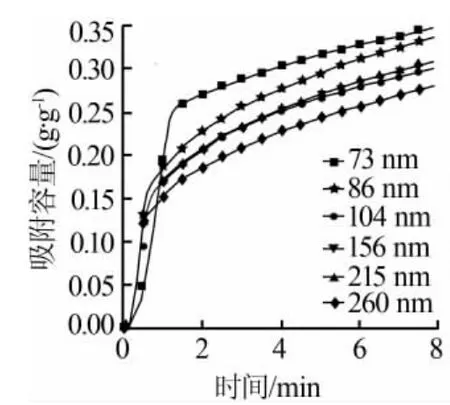
图7 不同的氧化钙基CO2吸附剂粒径对吸附容量的影响
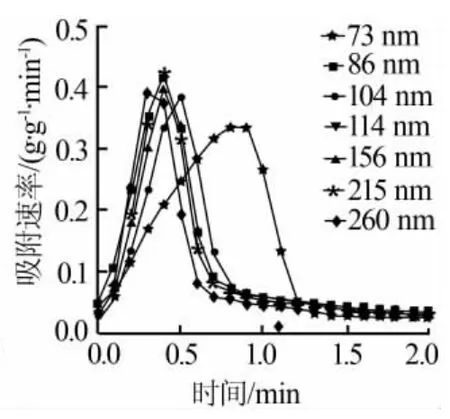
图8 不同的氧化钙基CO2吸附剂粒径对吸附速率的影响
然而从图8也可以明显看出,粒径为73 nm的氧化钙基吸附剂的吸附曲线的斜率明显小于其他各个吸附剂的。当CaO的粒径大于86 nm时,CaO基吸附剂的吸附速率大致随着CaO粒径的降低而降低,并且快速反应段均在0.75 min内完成,其中粒径为86、215 nm的CaO基吸附剂的吸附速率较快。粒径为73 nm的CaO基吸附剂的吸附速率值最低,但是快速反应段的时间较长,约1.3 min。这也是造成快速反应段所占比例较高的原因。此外,从图8还可以看出,粒径越小CaO吸附CO2的反应面积越大,在CaO表面发生的快速反应段的时间越长。因此在形成相同厚度CaO层的条件下,颗粒越小,在快速反应段生成的CaO的量越多,吸附剂的转化率越高。这样也导致,吸附剂在扩散控制段的反应速率越低,快速反应段和扩散控制段的界限越明显。因此,吸附剂的粒径越小,越有利于吸附剂吸附容量的增加。
2.4.2纳米氧化钙基CO2吸附剂粒径对稳定性的影响
图9比较了不同粒径CaO基CO2吸附剂的循环稳定性。其中碳酸化条件为600℃,20%CO2环境下吸附10 min;其再生条件为750℃、N2气氛下再生10 min。从图9可以明显看出,经过10次循环后,吸附剂的吸附容量大致随着粒径的减小而增加。尤其是粒径为73、86 nm的CaO基吸附剂的循环吸附容量要远远高于其他吸附剂,当经过10个循环以后,其吸附衰减率仅为50%,吸附容量仍然可达0.2 g/g。相比粒径为73 nm的吸附剂,粒径为86 nm吸附剂的衰减率仅仅低了3%。固体颗粒为纳米颗粒时,势能将会急剧增加,从而导致粒径为73 nm的吸附剂中的CaO更容易团聚和烧结,更容易与SiO2等杂质发生反应生成硅酸钙等物质消耗CaO的量。因此,吸附剂CaO粒径影响吸附剂的吸附速率、吸附容量和稳定性。
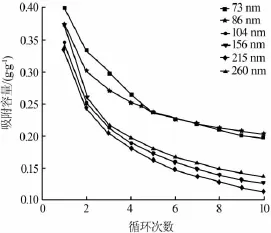
图9 纳米氧化钙基CO2吸附剂的循环吸附容量
3 结论
以磷石膏作为钙源制备出了纳米氧化钙基CO2吸附剂,通过对制备工艺中影响粒径的反应时间、反应温度、CO2流量、搅拌速度和杂质进行优化分析,并对粒径的大小对吸附剂性能的影响进行了考察。其主要结论如下:1)优化得到的最佳反应时间为50 min。当温度为30℃时制备得到的CaO粒径最小、粒径分布最窄,为较优的制备温度。CaO粒径受温度和CO2通量的双重影响,CO2通量为251 mL/min时最佳。搅拌速度越低,越有利于纳米CaO吸附剂的生成,因此,最佳搅拌速率为慢搅拌速率。杂质含量越少,其粒径也就越小。2)考察了纳米氧化钙粒径对CO2吸附剂性能的影响。纳米氧化钙基CO2吸附剂的粒径越小,吸附量就越大,吸附速率也越快。而且粒径越小,其稳定性也就越高。
[1]Wang S P,Yan S L,Ma X B,et al.Recent advances in capture of carbon dioxide using alkali-metal-based oxides[J].Energy&Environmental Science,2011,4(10):3805-3819.
[2]Stewart C,Hessami M A.A study of methods of carbon dioxide capture and sequestration-the sustainability of a photosynthetic bioreactorapproach[J].EnergyConversionandManagement,2005,46(3): 403-420.
[3]MacDowell N,Florin N,Buchard A,et al.An overview of CO2capture technologies[J].Energy&Environmental Science,2010,3(11): 1645-1669.
[4]景艳伟,乃学瑛,党力,等.碳酸钙晶须的除杂工艺研究[J].无机盐工业,2015,47(7):35-37.
[5]颜鑫,王佩良,舒均杰.纳米碳酸钙关键技术[M].北京:化学工业出版社,2007.
[6]唐琪,吴素芳.CaO含量对纳米CaO/Al2O3吸附剂性能的影响[J].高校化学工程学报,2012,26(1):31-36.
[7]丁光月,李岳,樊彩梅,等.杂质对磷石膏与碳酸铵反应及产物碳酸钙结晶的影响[J].太原理工大学学报,2011,42(6):593-597.
[8]鲁厚芳,梁斌,周成,等.水溶性P2O5对石膏碳酸铵转化过程影响的研究[J].高校化学工程学报,2004,18(3):385-388.
[9]Wu S F,Zhu Y Q.Behavior of CaTiO3/nano-CaO as a CO2reactive adsorbent[J].Industrial&Engineering Chemistry Research,2010,49(6):2701-2706.
[10]Alvarez D,Abanades J C.Determination of the critical product layer thickness in the reaction of CaO with CO2[J].Industry&Engineering Chemistry Research,2005,44(15):5608-5615.
[11]Valverde J M.A model on the CaO multicyclic conversion in the Ca-looping process[J].Chemical Engineering Journal,2013,228: 1195-1206.
联系方式:qnsytaoer@163.com
Optimization of preparation of nano CaO based sorbents from phosphogypsum
Zhou Jing,Zou Hongtao,Xing Yan,Li Feng
(Department of Chemistry and Chemical Engineering,Qiannan Normal College for Nationalities,Duyun 558000,China)
The preparation process parameters of nano CaO based CO2sorbents(reaction time,reaction temperature,CO2flux,stirring speed,and impurity content)were optimized.The influence of particle size of nano CaO based CO2sorbents on the adsorption performance was investigated.The optimized preparation process parameters were as follows:reaction time was 50 min,reaction temperature was 30℃,CO2flux was 251 mL/min,and the slower stirring rate and the less impurity content,the better.The smaller of particle size of nano CaO based CO2sorbents was,the greater the adsorption capacity,the faster adsorption rate,and the higher stability was too.
phosphogypsum;nano CaO;sorbents;Optimization
TQ127.12
A
1006-4990(2016)10-0073-04
贵州省科学技术厅项目(黔科合LH字[2015]7707)。
2016-04-30
周静(1974—),女,教授,本科,研究方向为磷化工和绿色化学,已发表论文16篇。

