时空因素对火山优势树种根际真菌群落多样性的影响1)
张建峰 周奇 田磊 马丽娜 田春杰
(吉林农业大学,长春,1301182) (中国科学院东北地理与农业生态研究所)
时空因素对火山优势树种根际真菌群落多样性的影响1)
张建峰 周奇 田磊 马丽娜 田春杰
(吉林农业大学,长春,1301182) (中国科学院东北地理与农业生态研究所)
以五大连池地区喷发年代相差较大的老黑山(0.02万年前)、东焦得布山(80万年前)和南格拉球山(200万年前)3座火山南北坡为代表,采用PCR-DGGE联用技术研究了火山优势树种根际真菌多样性。结果表明:(1)采用UPGMA法对根际真菌群落结构相似性的分析表明,3座火山根际真菌群落结构相似性随着火山喷发后时间的延长先不变后升高;但南坡和北坡根际真菌群落结构相似性不同。(2)运用BIODAP软件对根际真菌群落多样性的分析表明,3座火山南北坡的均匀度无明显变化,均为0.99;3座火山南坡丰富度和多样性指数均随火山喷发后时间的延长先降低后增加;北坡丰富度和多样性指数均随火山喷发后时间的延长先持平后增加。(3)采用SPSS分析软件对土壤理化性质和根际真菌多样性的相关性分析表明,3座火山南北坡丰富度和多样性指数与土壤有机质之间相关显著(p<0.05)。
五大连池;时空因素;根际真菌;变性梯度凝胶电泳
Laoheishan, Dongjiao Mountain and the south and north slopes of South Gamla Ball Shan, which have large differences in age, were selected as representatives of Wudalianchi volcanic rock to study the diversity of rhizosphere fungi, using PCR-DGGE combination technology. Using UPGAMA method in structural similarity analysis of rhizosphere fungi community, the structural similarity of rhizosphere fungi community for the three volcanoes displayed a trend of being constant before increasing with the time extension of the volcano eruption, indicating that time was one of the factors affecting rhizosphere fungal community. The structural similarity of rhizosphere fungi community for the south slope was different compared to the north slope, showing that the slope direction was also one of the factors affecting rhizosphere fungal community. Using BIODAP software to analyze the diversity of rhizosphere fungi, the evenness of both the three volcanoes’ south slope and north slopes was the same index of 0.99. The changing trends for the abundance and diversity index of rhizosphere fungi of the three-volcano south slopes was the same, which seemed to be increasing after first decreasing with volcanic eruption. The variation trend for the abundance and diversity index of rhizosphere fungi of the three volcanoes’ south slopes was also the same, which is constant before increasing with the time extension of the volcano eruption, indicating that time can change the diversity of rhizosphere fungi. Using SPSS software to do the correlation analysis for the soil physical-chemical properties and the diversity of rhizosphere fungi, the abundance and diversity index of rhizosphere fungi of the three-volcano north and south slopes were significantly associated with the soil organic matter (p<0.05). The abundance and diversity index of rhizosphere fungi of the three-volcano north and south slopes were positively related to the total soil nitrogen, available nitrogen, pH, available phosphorus, and available potassium, but the correlation was not significant.
土壤真菌是指以土壤为活动场所完成全部或部分生活史的真菌,主要包括腐生或共生在土壤或母质中的真菌区系[1-3]。1886年,Adametz从土壤中首次分离得到11株真菌[1]。根际真菌是土壤真菌主要组成部分之一,其以藻状菌和半知菌中的丝孢菌成员为主。根际真菌多样性受到采样方法、植物种类、季节、土壤类型和土壤理化性质等多种因素的影响[4-5]。Nemergut et al.[6]对高山和北极地区土壤微生物结构随季节的变化趋势的研究表明,土壤微生物种群多样性受到季节因素的影响显著。慕东艳等[7-8]研究表明,黑龙江省药用植物根际真菌多样性丰富,其中青霉属(Penicillium)、曲霉属(Aspergillus)、木霉属(Trichoderma)和镰孢菌属(Fusarium)是其优势种群;药用植物的种类和采样地点对根际真菌种群结构也有影响。王超等[9]研究表明,根际真菌在低肥中数量最多,中肥土壤中最少。有研究[10-12]表明,随着同种植物生长时期的增加根际真菌数量不断增加,在成熟期达到最多,但是根际真菌种类无明显区别。本研究以五大连池火山群中喷发年代差异较大的老黑山(0.02万年前)、东焦得布山(80万年前)及南格拉球山(200万年前)为研究对象,采用变性梯度凝胶电泳(DGGE)法,探讨了优势树种根际真菌群落多样性与时空的关系。
1 材料与方法
1.1 样品预处理
2014年8月,以老黑山、东焦得布山和南格拉球山为样地。根据海拔、坡度、植被等设置3~5个样方(1 m×1 m),进行植物物种组成和盖度调查。同时,采集优势树种根部土壤,采样深度为0~20 cm。将土样混合,采用四分法取样1.0 kg。将土壤放入密封塑料袋,附上标签,记录采样时间、采样地点、生境、样品编号等。将土壤样品带回实验室,过18目筛(1 mm孔径)后分3部分:一部份4 ℃保存;一部分-20 ℃保存;一部分于阴凉处风干保存备用。将风干土样内的石块、根茎及其他杂质挑除,以排除生物有机体对土壤养分质量分数的干扰。风干后将同一个样地不同样方采集的土壤混合均匀,称取0.5 g,作为该样地的土壤样品[13-14]。具体采样信息见表1。
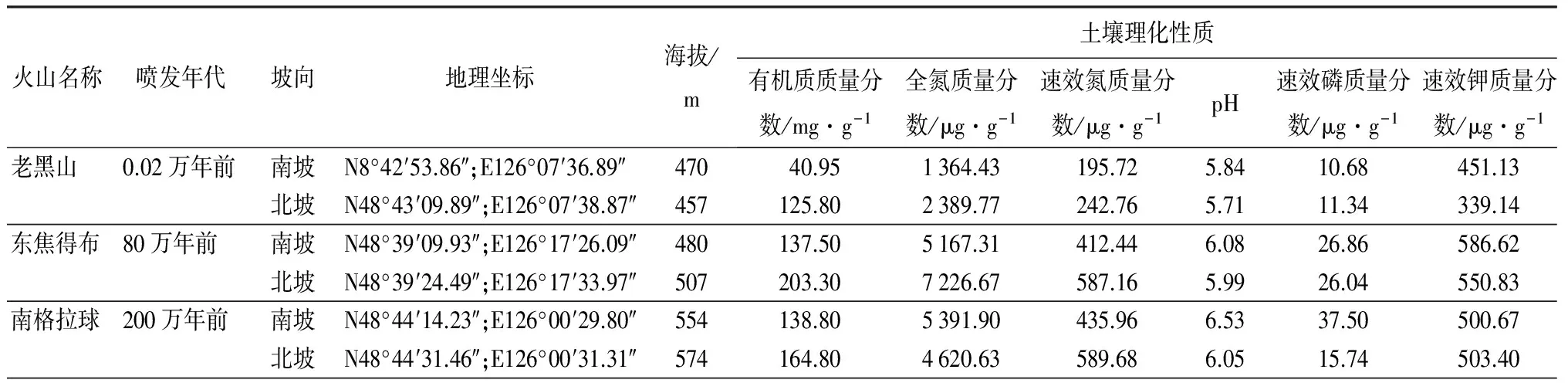
表1 五大连池3座火山南北坡采样信息
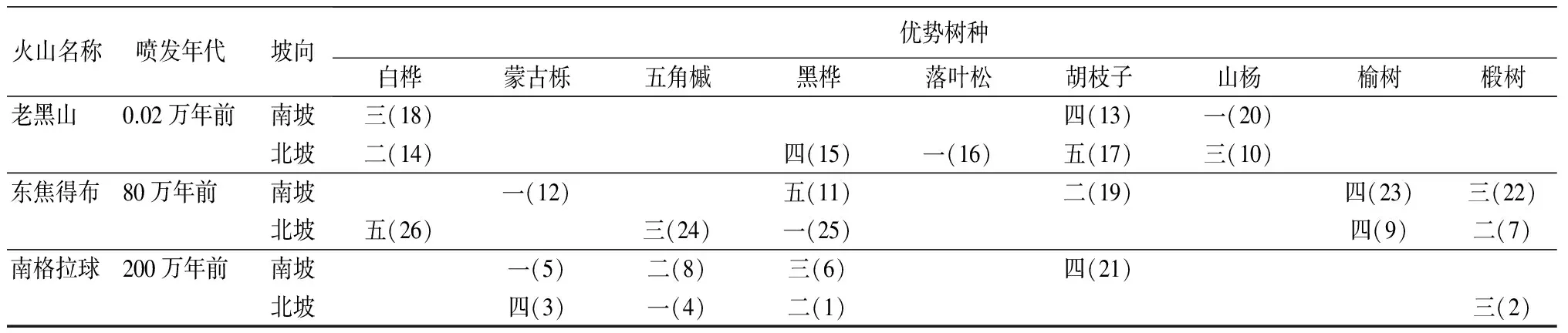
火山名称喷发年代坡向优势树种白桦蒙古栎五角槭黑桦落叶松胡枝子山杨榆树椴树老黑山0.02万年前南坡三(18)四(13)一(20)北坡二(14)四(15)一(16)五(17)三(10)东焦得布80万年前南坡一(12)五(11)二(19)四(23)三(22)北坡五(26)三(24)一(25)四(9)二(7)南格拉球200万年前南坡一(5)二(8)三(6)四(21)北坡四(3)一(4)二(1)三(2)
注:优势树种内的汉字数字表示优势树种排序;括号内的阿拉伯数字表示采样序号。
1.2 研究方法
1.2.1 根际真菌DNA的提取
按TIANGEN公司的植物基因组DNA提取试剂盒(离心柱形)的操作步骤进行根际真菌DNA的提取。然后使用Thermo公司生产的仪器NanoDROP2000c进行根际微生物DNA质量浓度和纯度的测定[15-18]。
1.2.2 根际真菌18 S rDNA的PCR扩增
18 S rDNA基因的扩增[3,10,19]:将纯化后的基因组DNA作为PCR的模板,采用对大多数真菌的18 S rDNA基因具有的简并性的引物NS1/NS4和特异性的引物GC-fungal/NS1进行两轮PCR扩增。第1轮PCR的引物为,NS1(5′-GTAGTCATATGGTTGTCTC-3′)和NS4(5′-CTTCCGTCAATTCCTTTAAG-3′),扩增产物片段长约1 400 bp;PCR扩增体系(20 uL)为,Premix 10 μL,引物F和R各2 μL,DNA模板2 μL,ddH2O 4 μL;PCR扩增程序为,94 ℃预变性4 min,35个循环的94 ℃变性30 s,52 ℃退火55 s,72 ℃延伸50 s,最后72 ℃保持10 min。第2轮PCR的引物为,GC-fungal (5′-CGCCCGCCGCGCCCCGCG-CCCGGCCCGCCGCCCCCGCCCCATTCCCCGTTACC-
CGTTG-3′)和NS1(5′-GTAGTCATATGGTTGTCTC-3′),扩增产物片段长约500 bp;PCR扩增体系(20 μL)为,Premix 10 μL,引物F和R各2 uL,DNA模板1 μL,ddH2O 5 μL;PCR扩增程序为,94 ℃预变性4 min,35个循环的94 ℃变性30 s,52 ℃退火55 s,72 ℃延伸50 s,最后72 ℃保持10 min。
1.2.3 PCR反应产物的变性梯度凝胶电泳
试剂与仪器:试剂有丙烯酰胺、双丙烯酰胺、尿素、去离子甲酰胺等购自Sigma公司,PremixTaq混合液购自TAKARA生物公司。仪器主要有JY-CZ-B垂直电泳仪(北京君意东方电泳设备有限公司),Genosens 1860凝胶成像系统(上海勤祥科学仪器有限公司)。
DGGE试验操作[20-22]:对上述以GC-fungal/NS1为引物扩增出的真菌目的条带,进行DGGE电泳检测。电泳条件为,1×TAE电泳缓冲液,变性梯度为20%~40%,90 V电压,12 h;电泳后获得的凝胶,经替代性核酸染料染色浸泡1 h后,于凝胶成像系统进行观察。
1.3 数据处理
用Quantity One分析软件对凝胶图像进行图谱和UPGAMA分析;用BIODAP软件进行根际真菌物种多样性分析,包括丰富度,均匀度和相似度;运用SPSS软件进行相关性分析。
2 结果与分析
2.1 根际微生物DNA质量浓度和纯度
使用仪器NanoDROP2000c对提取的根际微生物DNA进行质量浓度和纯度测定。部分样品的DNA质量浓度和纯度测定结果如表2所示。大量研究结果表明,样品DNA的A260/A280比值为1.80~2.00,表明提取的样品DNA适合18 S rDNA分析且纯度较好,能够直接用于PCR-DGGE等分析[23]。结果(表2)显示,5个样品的DNA质量浓度为54.4~233.4 mg·L-1,能够满足试验需要;5个样品DNA的A260/A280比值为1.84~1.91,能够直接进行PCR-DGGE分析。结合表1、表2可知,不同山体和不同方向的优势树种根际真菌DNA的质量浓度和纯度不同。
2.2 根际真菌的PCR扩增
由表2可知,优势树种根际真菌DNA的质量浓度和纯度符合试验要求,可以作为样品进行PCR扩增。对根际真菌18 S rDNA进行两轮PCR扩增:第1轮引物为NS1/NS4,第2轮引物为GC-fung/NS1。对第1轮和第2轮扩增产物进行琼脂糖凝胶电泳,结果如图1所示。由图1a可知,第1轮PCR扩增产物中进行琼脂糖凝胶电泳的部分样品均能扩增出单一的目的条带,目的片段长度约1 500 bp,说明各个样品的PCR扩增具有很好的特异性,扩增产物可以作为第2轮PCR的样品。由图1b所示,第2轮PCR产物中进行琼脂糖凝胶电泳的部分除样品1外都能扩增出单一的目的条带,目的片段长度约500 bp,说明样品的PCR扩增具有很好的特异性,扩增产物可以直接用做DGGE样品。样品1除目的条带(约500 bp)外,在1 500 bp左右还有一条条带,可能原因是第2轮PCR时模板质量浓度过高,导致模板剩余过多,在第2轮PCR的扩增产物做琼脂糖凝胶电泳时显现出来。但DGGE样品的片段大小为500 bp及以下,样品1长约1 500 bp的片段在DGGE图片中不能显示,对最后结果无影响,因此,样品1的PCR扩增具有很好的特异性,扩增产物可以直接用做DGGE样品。
表2 五大连池火山优势树种根际真菌部分样品DNA质量浓度和纯度
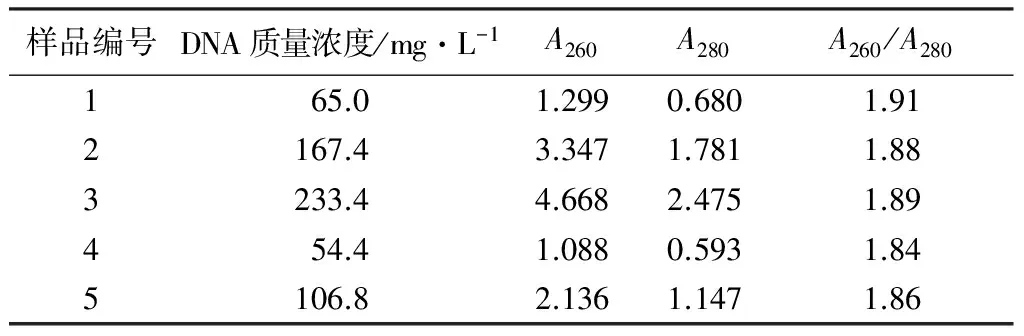
样品编号DNA质量浓度/mg·L-1A260A280A260/A280165.01.2990.6801.912167.43.3471.7811.883233.44.6682.4751.89454.41.0880.5931.845106.82.1361.1471.86
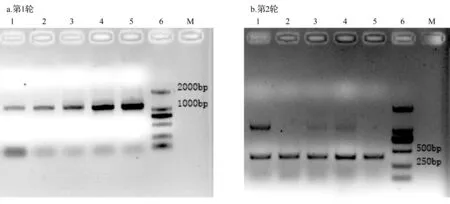
图1 五大连池火山优势树种根际真菌18 S rDNA PCR扩增结果
2.3 南北坡根际真菌DGGE图谱
由表1可知,老黑山、东焦得布山和南格拉球山南北坡的优势树种。对3座火山南北坡优势树种的根际真菌进行DNA提取和PCR扩增,最后通过DGGE试验得到根际真菌的18 S rDNA图谱(图2)。
条带的数量代表根际真菌群落的多样性,条带的亮度反映了根际真菌群落的丰度[24]。从图2可以看出,a、d、e、f、g、I、j、k和m为样品的广谱性条带,其中a、d、e、g、j和m条带的亮度与其他相比较暗,说明这5个根际真菌种群的数量较少;f、i和k条带较亮,说明这3个条带的根际真菌种群数量较多。条带b为样品3和样品26的特异性条带,但样品3的根际真菌种群的数量比样品26多。条带c为样品10、14、15和样品26的特异性条带,其中样品10的根际真菌种群的数量较其他样品多。条带l为样品4和样品1的特异性条带且根际真菌种群的数量较多。条带n为样品5、11、12和13的特异性条带,其中样品5的根际真菌种群的数量最多。样品6和样品20共有一条特异性条带o,同时它们的根际真菌种群的数量较多。条带p为样品1、3、4和样品20的特异性条带,样品3与其他3个样品相比具有较多的根际真菌种群的数量。由表1和图2可知,山体和坡向是影响根际真菌多样性的重要因素。可见,3座火山南北坡根际真菌具有丰富的种群多样性,同时说明相同根际真菌种群在不同的样品中的数量不同。
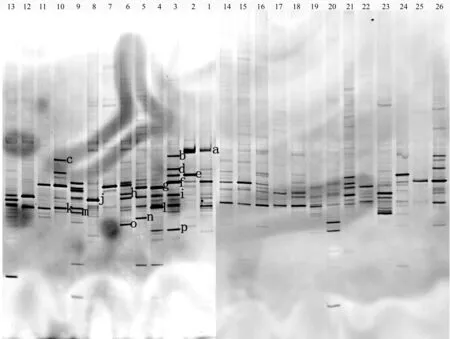
图2 五大连池3座火山南北坡优势树种根际真菌18 S rDNA的DGGE图谱
2.4 火山南北坡根际真菌群落相似性
通过Quantity One软件对DGGE图谱采用非加权组平均法(UPGAMA)进行聚类分析。结果如图3所示,结合表1分析可知,3座火山南北坡优势树种根际真菌相似度受到山体和坡向的影响。老黑山、东焦得布山和南格拉球山根际真菌群落结构相似性均随着火山喷发后时间的延长先不变后升高。3座火山中南格拉球山根际真菌群落结构相似度最高,相似值为0.33;老黑山和东焦得布山根际真菌群落结构的相似度相同,相似值为0.31。说明,在土壤发育晚期,根际真菌种群结构处于一种相对平衡状态,而在土壤发育早期和中期根际真菌群落结构处于活跃状态,根际真菌群落结构有一定变动。大量研究结果表明,采用UPGAMA法进行聚类分析时相似值高于0.6的2个群体之间具有较好的相似性[21,23]。说明时间是影响根际真菌群落结构的主要因素之一。老黑山南坡根际真菌群落结构相似度低于北坡,说明南坡根际真菌种群较多,可能原因是南坡温度较高,土壤发育较快,植物生长繁殖速度快,导致根际真菌种群结构较北坡复杂。东焦得布山南坡根际真菌种群结构相似度高于北坡,可能原因是南坡温度较高,土壤发育较快,根际真菌种群结构变化幅度较小,从而使南坡根际真菌种群之间结构相似度较高。南格拉球山南北坡根际真菌种群结构相似度相同,说明根际真菌种群结构处于一种相对稳定的状态。由以上结果可知,坡向也是根际真菌种群结构的影响因素之一。
2.5 火山南北坡根际真菌多样性
电泳图谱中条带的多少和亮度可反映样品根际真菌的遗传多样性[25-26]。由表3可知,3座火山南坡丰富度和多样性指数变化趋势一致,随着火山喷发后时间的延长丰富度和多样性指数先降低后增加。3座火山北坡丰富度和多样性指数变化趋势也相同,均随火山喷发后时间的延长先不变后增加。由表3可知,3座火山北坡和南坡的均匀度变化趋势相同,都随着火山喷发后时间的延长保持不变。说明,时间是影响根际真菌多样性的因素之一。老黑山和南格拉球山丰富度和多样性指数随坡向的变化趋势相同,都为南坡高于北坡。东焦得布山南北坡丰富度和多样性指数差异不显著,原因可能是南坡温度较高,微生物和植物生长繁殖速度较快,土壤中营养成分被大量消耗,根际真菌可利用的营养成分减少,导致根际真菌多样性降低。说明,坡向是影响根际真菌多样性的因素之一。

图3 五大连池火山优势树种根际真菌DGGE图谱UPGAMA聚类分析
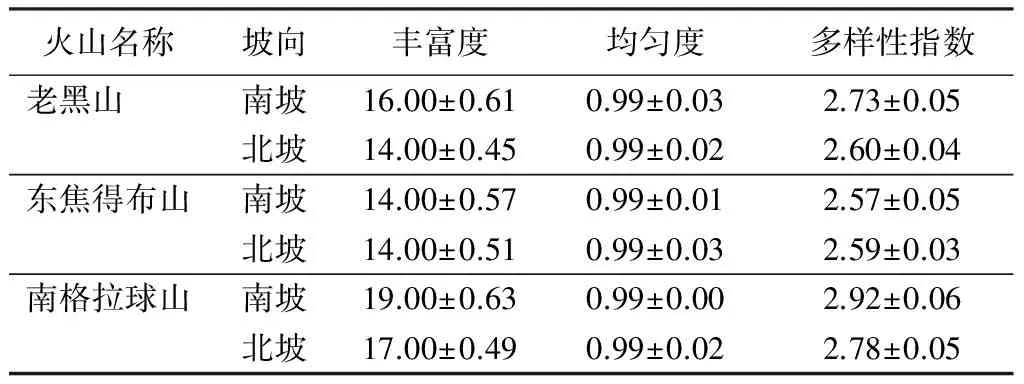
火山名称坡向丰富度均匀度多样性指数老黑山南坡16.00±0.610.99±0.032.73±0.05北坡14.00±0.450.99±0.022.60±0.04东焦得布山南坡14.00±0.570.99±0.012.57±0.05北坡14.00±0.510.99±0.032.59±0.03南格拉球山南坡19.00±0.630.99±0.002.92±0.06北坡17.00±0.490.99±0.022.78±0.05
注:表中数据为平均值±标准差。
2.6 火山土壤理化性质和根际真菌多样性的相关性
为揭示土壤理化性质与根际真菌多样性之间的关系,对各土壤理化指标与根际真菌丰富度和多样性指数进行相关性分析。结果如表4所示,老黑山、东焦得布山和南格拉球山南坡根际真菌丰富度和多样性指数分别与土壤有机质显著相关(p<0.05),丰富度和多样性指数分别与土壤全氮、土壤速效氮、pH、土壤速效磷和土壤速效钾正相关但相关性不显著。3座火山北坡丰富度和多样性指数分别与土壤有机质显著相关(p<0.05),丰富度和多样性指数与其他土壤理化指标正相关但相关不显著。
表4 五大连池火山优势树种根际真菌多样性与土壤理化性质之间的相关性
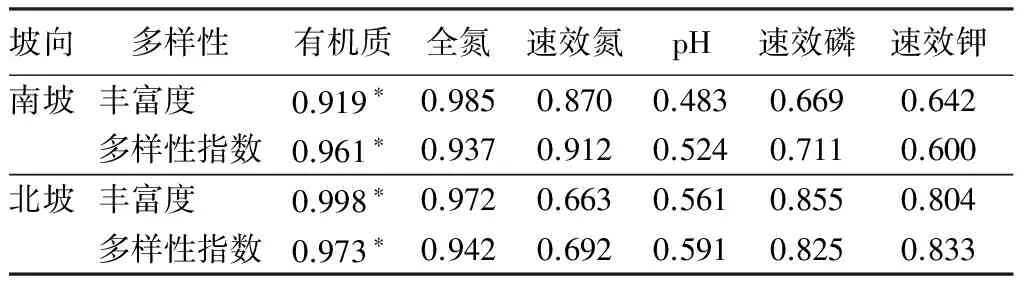
坡向多样性有机质全氮速效氮pH速效磷速效钾南坡丰富度0.919*0.9850.8700.4830.6690.642多样性指数0.961*0.9370.9120.5240.7110.600北坡丰富度0.998*0.9720.6630.5610.8550.804多样性指数0.973*0.9420.6920.5910.8250.833
注:*为在0.05水平显著相关。
大量研究表明,pH是影响根际真菌生长的一个重要因子[27],绝大多数真菌适宜生存在微酸性或中性环境中[28]。同时,Rousk et al.[29]研究发现与细菌相比,真菌对pH的敏感性较弱,真菌的多样性与pH之间的相关性较小,验证了本试验中得到的关于根际真菌多样性与pH之间相关性的结论。
3 结论与讨论
土壤真菌具有高度分解和合成多种复杂有机物质的能力,是生态系统中的重要组成部分。土壤真菌多样性和结构组成是衡量生态系统健康稳定的重要指标之一[30]。植物不同生长时期的根系分泌物是影响根际真菌群落多样性的重要因素之一[31-36]。Feng et al.[37]研究发现土壤真菌的丰富度和多样性指数与水分的相关性为正相关,与pH的相关性为负相关。有研究[38-39]表明,土壤真菌多样性受土壤pH和土壤有机质的影响。Hodge[40]的研究结果表明,AM真菌一方面能够改良土壤,另一方面能够促进宿主植物对营养元素的吸收和利用[37]。大量研究结果表明,速效磷和速效氮在土壤中的含量过高时,能够降低AM真菌的侵染率,减少根内丛枝数量和土壤中孢子的数量[41]。林缘河滩沙棘灌丛的沙棘根际微生物总数和根际真菌数量高于阳坡干旱草地[42]。白爱芹等[43]研究结果表明,西坡土壤微生物AWCD值和多样性指数高于南坡。赵彤等[44]研究结果表明,在森林植被区,阳坡SMBC和SMBN的含量高于北坡;在草原植被区规律则相反,表现为阳坡SMBC和SMBN的含量低于北坡。本试验采用PCR-DGGE技术测定分析了老黑山、东焦得布山和南格拉球山南北坡根际真菌多样性。采用仪器NanoDROP2000c测定根际微生物DNA质量浓度和纯度,结果表明,根际微生物DNA质量浓度在50 mg/L以上,纯度为1.8~2.0,说明DNA的纯度满足试验需求。由DGGE图谱可知,3座火山南北坡不同的优势树种的根际真菌既具有广谱性条带又具有特异性条带。通过Quantity One软件对DGGE图谱采用UPGAMA法进行聚类分析。结果表明,老黑山、东焦得布山和南格拉球山3座火山根际真菌相似性变化趋势为随着火山喷发后时间的延长先不变后升高,说明时间是影响根际真菌群落结构的主要因素之一。3座火山南坡根际真菌相似性与北坡不同,说明坡向能够影响根际真菌群落结构。3座火山南北坡的均匀度无明显变化,均为0.99。3座火山南坡丰富度和多样性指数的变化趋势相同,均随火山喷发后时间的延长先降低后增加;3座火山北坡丰富度和多样性指数的变化趋势也一致,均随火山喷发后时间的延长先不变后增加。说明,时间能够影响根际真菌群落多样性。与张爱梅、白爱芹和赵彤等[42-44]研究结果相比,本试验南北坡丰富度和多样性指数无明显的变化规律,原因可能是南北坡丰富度和多样性指数受到时间因素的影响比坡向因素显著。说明,坡向能够影响根际真菌群落多样性。采用SPSS分析软件对土壤理化和根际真菌多样性进行相关性分析,3座火山南北坡丰富度和多样性指数与土壤有机质之间的相关性为显著相关(p<0.05),南北坡丰富度和多样性指数与土壤全氮、速效氮、pH、速效磷和速效钾的相关性为正相关,但相关性不显著。本试验南北坡丰富度和多样性指数与pH的相关性与Feng et al.[37]研究结果不同,可能是受到母质的影响。
综上所述,喷发年代和坡向是影响火山优势树种根际真菌群落多样性的重要因素。同时,火山优势树种根际真菌多样性也受到土壤理化性质的影响。本试验结果为研究时空对根际真菌群落多样性的影响提供了理论基础和数据支持。
[1] 刘雪英.落叶松菌根根际真菌的初步研究[D].哈尔滨:东北林业大学,2010.
[2] 张伟,许俊杰,张天宇.土壤真菌研究进展[J].菌物研究,2005,3(2):56-58.
[3] 胡雲飞.茶树根域真菌的季节多样性及病原拮抗和降解活性真菌初步研究[D].南京:南京农业大学,2013.
[4] 赵辉.烤烟生长期间不同土壤类型对根际和非根际土壤生物活性的影响研究[D].郑州:河南农业大学,2010.
[5] 王春.锥栗根际土壤真菌多样性分析研究[D].福州:福建农林大学,2005.
[6] NEMERGUT D R, COSTELLO E K, MEYER A F, et al. Structure and function of alpine and arctic soil microbial communities[J]. Research in Microbiology,2005,156(7):775-784.
[7] 慕东艳.黑龙江省药用植物根际土壤真菌多样性的研究[D].大连:辽宁师范大学,2012.
[8] 慕东艳,吕国忠,孙晓东,等.黑龙江省药用植物根际土壤真菌多样性[J].生态学报,2013,33(1):229-237.
[9] 王超,吴凡,刘训理,等.不同肥力条件下烟草根际微生物的初步研究[J].中国烟草科学,2005,26(2):12-14.
[10] 占瑞琪.短花针茅根际真菌的分离及其对小麦的促生作用[D].呼和浩特:内蒙古农业大学,2014.
[11] 于慧瑛,吕国忠,孙晓东.不同生长年限人参根际土壤真菌种类及数量的初步研究[J].人参研究,2006(4):9-11.
[12] 于慧瑛,吕国忠,孙晓东,等.病健人参根际土壤真菌种类及数量的研究[J].安徽农业科学,2007,35(26):8279,8291.
[13] 鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,1999.
[14] 张韫.土壤·水·植物理化分析教程[M].北京:中国林业出版社,2011.
[15] BÜRGMANN H, PESARO M, WIDMER F, et al. A strategy for optimizing quality and quantity of DNA extracted from soil[J]. Journal of Microbiological Methods,2001,45(1):7-20.
[16] 窦莹颖,林展民,朱英德,等.浙贝母根际土壤总DNA提取和纯化方法的比较[J].微生物学通报,2008,35(11):1840-1844.
[17] 于水强,王文娟,Li B L.环境DNA技术在地下生态学中的应用[J].生态学报,2015,35(15):4968-4976.
[18] 张瑞福,曹慧,崔中利,等.土壤微生物总DNA的提取和纯化[J].微生物学报,2003,43(2):276-282.
[19] 祖元刚,高崇洋,王文杰,等.喜树替代紫茎泽兰过程中根际微生物群落特征[J].中国科学C辑:生命科学,2006,36(5):459-467.
[20] 姚晓华,闵航,袁海平.啶虫脒污染下土壤微生物多样性[J].生态学报,2006,26(9):3074-3080.
[21] 陈法霖,张凯,郑华,等.PCR-DGGE技术解析针叶和阔叶凋落物混合分解对土壤微生物群落结构的影响[J].应用与环境生物学报,2011,17(2):145-150.
[22] 刘骁蒨,涂仕华,孙锡发,等.秸秆还田与施肥对稻田土壤微生物生物量及固氮菌群落结构的影响[J].生态学报,2013,33(17):5210-5218.
[23] 朱丹,张磊,韦泽秀,等.菌肥对青稞根际土壤理化性质以及微生物群落的影响[J].土壤学报,2014,51(3):627-637.
[24] 刘绍雄,王明月,王娟,等.基于PCR-DGGE技术的剑湖湿地湖滨带土壤微生物群落结构多样性分析[J].农业环境科学学报,2013,32(7):1405-1412.
[25] 张矛宇,李强,张杰,等.中国新疆火焰山土壤环境及细菌群落结构[J].应用与环境生物学报,2015,21(1):155-163.
[26] 唐杰,徐青锐,王立明,等.若尔盖高原湿地不同退化阶段的土壤细菌群落多样性[J].微生物学通报,2011,38(5):677-686.
[27] WANG G M, STRIBLEY D P, TINKER P B, et al. Effects of pH on arbuscular mycorrhiza. I. Field observations on the long-term liming experiments at Rothamsted and Woburn[J]. The New Phytologist,1993,124(3):465-472.
[28] 张美庆,王幼珊,邢礼军.AM真菌在我国东、南沿海各土壤气候带的分布[J].菌物系统,1999,18(2):145-148.
[29] ROUSK J, BÅÅTH E, BROOKES P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. The ISME Journal,2010,4(10):1340-1351.
[30] 王芳,图力古尔.土壤真菌多样性研究进展[J].菌物研究,2014,12(3):178-186.
[31] 赵艳,张晓波.影响植物根际微生物区系之因素研究进展[J].中国农学通报,2007,23(8):425-430.
[32] MARSCHNER P, YANG C H, LIEBEREI R, et al. Soil and plant specific effects on bacterial community composition in the rhizosphere[J]. Soil Biology and Biochemistry,2001,33(11):1437-1445.
[33] PICARD C, Cello F D, VENTURA M, et al. Frequency and biodiversity of 2,4-diacetylphloroglucinol-producing bacteria isolated from the maize rhizosphere at different stages of plant growth[J]. Applied & Environmental Microbiology,2000,66(3):948-955.
[34] 韩玉竹,曾兵,赵建军,等.象草根际微生物研究[J].土壤通报,2010,41(6):1349-1354.
[35] BROECKLING C D, BROZ A K, BERGELSON J, et al. Root exudates regulate soil fungal community composition and diversity[J]. Applied & Environmental Microbiology,2008,74(3):738-744.
[36] 张晓波.草地早熟禾根际促生菌(PGPR)特性及根际微生物区系研究[D].北京:北京林业大学,2008.
[37] FENG S G, ZHANG H X, WANG Y F, et al. Analysis of fungal community structure in the soil of zoige alpine wetland[J]. Acta Ecologica Sinica,2009,29(5):260-266.
[38] DENNIS P G, RUSHTON S P, NEWSHAM K K, et al. Soil fungal community composition does not alter along a latitudinal gradient through the maritime and sub-Antarctic[J]. Fungal Ecology,2012,5(4):403-408.
[39] 巨天珍,陈源,常成虎,等.天水小陇山红豆杉(Taxuschinensis(Pilg.) Rehd)林土壤真菌多样性及其与生态因子的相关性[J].环境科学研究,2008,21(1):128-132.
[40] HODGE A. Plant nitrogen capture from organic matter as affected by spatial dispersion, interspecific competition and mycorrhizal colonization[J]. New Phytologist,2003,157(2):303-314.
[41] 李晓林,冯固.丛枝菌根生态生理[M].北京:华文出版社,2001.
[42] 张爱梅,孙坤,达文燕.马衔山两种不同生境沙棘根际微生物研究[J].西北师范大学学报(自然科学版),2008,44(1):69-73.
[43] 白爱芹,傅伯杰,曲来叶,等.重度火烧迹地微地形对土壤微生物特性的影响:以坡度和坡向为例[J].生态学报,2013,33(17):5201-5209.
[44] 赵彤,蒋跃利,闫浩,等.黄土丘陵区不同坡向对土壤微生物生物量和可溶性有机碳的影响[J].环境科学,2013,34(8):3223-3230.
Effects of Temporal and Spatial Factors on the Community Diversity of Rhizosphere Fungi//
Zhang Jianfeng, Zhou Qi(Jilin Agricultural University, Changchun 130118, P. R. China); Tian Lei, Ma Lina, Tian Chunjie
(Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences)//Journal of Northeast Forestry University,2016,44(9):86-92.
Wudalianchi; Temporal and spatial factors; Rhizosphere fungi; Denaturing gradient gel electrophoresis (DGGE)
1)长春市科技计划项目(2013173);吉林省教育厅项目(2016176);吉林省自然科学基金项目(20140101017JC)。
张建峰,男,1973年5月生,吉林农业大学生命科学学院,副教授。E-mail:88657158@qq.com。
田春杰,中国科学院东北地理与农业生态研究所,研究员。E-mail:tiancj@iga.ac.cn。
2016年1月27日。
S154.3;Q938.1
责任编辑:程 红。

