鱼藤酮对舞毒蛾的毒杀作用1)
问荣荣 马玲 董婉莹 王步勇
(东北林业大学,哈尔滨,150040)
鱼藤酮对舞毒蛾的毒杀作用1)
问荣荣 马玲 董婉莹 王步勇
(东北林业大学,哈尔滨,150040)
以舞毒蛾(Lymantriadispar)3龄幼虫为对象,采用点滴触杀法测定了植物源农药鱼藤酮对舞毒蛾3龄幼虫的杀虫活性、过氧化氢酶(CAT)活性及幼虫生长的影响。结果显示:鱼藤酮对舞毒蛾3龄幼虫具有低毒高效的毒杀作用,12、24、36、48 h致死中浓度LC50分别为14.10、10.44、9.75、9.51 mg·L-1。CAT酶活性呈现先上升后下降的波动,但均显著高于对照(p<0.05),表现出一定的抗逆性。对舞毒蛾3龄幼虫进行点滴触杀处理后,试虫的鲜质量增长率显著低于对照(p<0.05),表明鱼藤酮抑制舞毒蛾幼虫的生长。
鱼藤酮;舞毒蛾;过氧化氢酶
We used the tag method to determine the toxicity of rotenone to the 3 rd-instarLymantriadisparlarvae by bioactivity, the CAT activity and the fresh weight changes of larval. The rotenone had effective toxic effect on the 3 rd-instarL.disparlarvae, and 12, 24, 36 and 48 h LC50of rotenone for the 3 rd-instar larvae were 14.10, 10.44, 9.75 and 9.51 mg/L, respectively. The CAT activity of rotenone treatment group was increased first and then decreased, and obviously higher than that of normal control group (p<0.05) with resistance. Compared with ddH2O and DMSO treatments, the fresh weight of 3 rd-instar gypsy moth larvae treated by rotenone were lower. The rotenone had efficient toxicity for gypsy moth.
舞毒蛾(Lymantriadispar)是一种世界性的、周期性发生的危害严重的森林食叶害虫,分布广、食性杂,国外报道可取食300多种植物,国内报道可危害杨、柳、苹果、樟子松、落叶松等500多种植物[1],给农林业生产带来了巨大的经济损失,化学防治仍是目前有效控制舞毒蛾危害的主要防治措施。常用的化学药剂主要有高效氯氰菊酯、溴氰菊酯、氧化乐果、吡虫啉、灭幼脲III号等。其中,菊酯类药剂常被加工成毒笔、毒纸、毒绳等,利用舞毒蛾幼虫沿树干迁移取食和化蛹的习性将其毒杀[2-3]。但化学农药的长期大量使用导致了严重的“3R”问题,即抗药性、再增猖撅、残留。为减少化学农药对环境的污染,植物源农药的开发研究和利用成为农药化工领域研究的热点。鱼藤酮作为一种植物源农药具有作用方式多样,杀虫活性广谱,对人类及动物低毒,对农业生态环境和农产品安全等特点,被广泛应用于果树、蔬菜、粮食作物、茶叶、花卉害虫的防治[4]。本研究以林业重要害虫舞毒蛾为对象,研究了植物源农药鱼藤酮对舞毒蛾的杀虫活性、过氧化氢酶活性及幼虫生长发育的影响,为鱼藤酮应用于鳞翅目害虫的防治提供理论依据。
1 材料与方法
1.1 供试昆虫
舞毒蛾卵块采于东北林业大学凉水自然保护区,幼虫培养温度为(25±1)℃,光照条件为14 h光照、10 h黑暗,相对湿度为75%,取健康、大小一致的舞毒蛾3龄幼虫为试虫。
1.2 生物测定和致毒处理
采用点滴法测定植物源农药鱼藤酮对舞毒蛾3龄幼虫的毒力。以二甲基亚砜(DMSO)溶液配制鱼藤酮(纯度98%)母液,用DMSO溶液将鱼藤酮母液稀释成7~9个浓度,用微量点滴仪将稀释液滴于试虫的前胸背板,每头试虫点滴3 μL药液,对照组点滴DMSO溶液。每处理30头虫,重复3次。处理后的试虫置于恒温培养箱中培养,喂食小叶杨(Populussimonii)嫩叶片,观察其中毒死亡情况。
采用点滴触杀法进行致毒处理。用DMSO溶液将鱼藤酮母液分别配制成为5、10、20 mg·L-1的药液,对照组分别点滴蒸馏水和DMSO溶液,分别于12、24、36、48、60、72 h随机挑取活泼的试虫,液氮冷冻后于-80 ℃保存,用于过氧化氢酶(CAT)酶活性的检测,每个处理30头试虫,重复3次。
1.3 CAT酶活性测定
酶液制备:随机挑取5头处理过的舞毒蛾幼虫加入3 mL预冷的0.05 mol·L-1PBS提取液[含0.04%苯基硫脲(PTU)、1%聚乙烯吡咯烷酮(PVP)、10 mmol·L-1乙二胺四乙酸(EDTA)pH=7.0]于玻璃匀浆器内冰浴充分匀浆,于4 ℃、12 000 r·min-1离心15 min,上清液即原酶液。
酶源蛋白质质量分数的测定:参照Bradford[5]的考马斯亮蓝G-250法测定蛋白含量。取0.5 mL稀释的适当倍数的酶蛋白溶液加入到试管中,以提取液作为调零管,再加入2.5 mL考马斯亮蓝G-250,充分混匀,室温放置3 min后,于595 nm下测定吸光值OD595,重复3次,根据标准曲线求出蛋白质含量。
酶活性测定:用紫外分光光度法测定CAT活性[6]:取0.5~0.6 mL 30% H2O2,加水至50 mL,从中取出0.4 mL,加入2.6 mL 0.05 mol·L-1PBS(pH=7.0),测定240 nm的OD值。如果OD值为0.50~0.55,即可作为过氧化氢酶的底物溶液,取3 mL配制的底物溶液,在25 ℃条件下加入粗酶液0.02 mL,立即用紫外分光光度计在240 nm下每隔30 s读数1次,连续记录3 min。
酶比活力计算:以A240减少0.1的酶量为1个酶活性单位(U)。
CAT活性=(ΔA240×VT)/(0.1×V1×T×W)。
式中:VT为粗酶提取液总体积(mL);V1为测定用粗酶液体积;W为样品酶液蛋白质量浓度;T为加过氧化氢到最后1次读数的时间。
1.4 鱼藤酮对舞毒蛾幼虫生长发育影响
取饥饿12 h并称过鲜质量的大小一致的3龄2天舞毒蛾幼虫作为试虫,用微量点滴仪将5、10 mg·L-1鱼藤酮药液点滴于试虫的前胸背板处,对照组分别点滴蒸馏水和DMSO溶液,每头幼虫点滴3 μL。每处理30头虫,重复3次。处理后的试虫置于恒温培养箱中饲养,喂食小叶杨嫩叶片,连续3天称量试虫鲜质量。
1.5 数据处理
采用POLO软件计算致死中浓度LC50和95%置信区间,通过SPSS16.0统计软件,采用Duncan’s新复极差法比较各处理间的差异显著性(p<0.05)。
2 结果与分析
2.1 鱼藤酮对舞毒蛾幼虫的毒力
由表1可见,鱼藤酮对舞毒蛾3龄幼虫12、24、36、48 h致死中浓度LC50分别为14.10、10.44、9.75、9.51 mg·L-1,且鱼藤酮毒力随着作用时间的增加而增大。
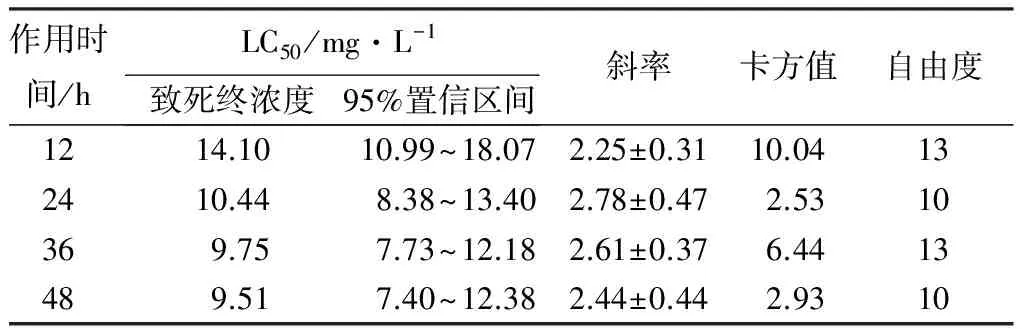
表1 鱼藤酮对舞毒蛾幼虫毒力测定
注:斜率数据为平均值±标准误。
2.2 鱼藤酮对舞毒蛾幼虫CAT活性的影响
以牛血清蛋白为标准物配制的蛋白标准溶液,采用考马斯亮蓝G-250法测定得到蛋白标准直线方程为y=190.1x-4.972 1(R2=0.993 8),用于酶液蛋白质含量的测定。由表2可见,与蒸馏水相比,DMSO溶液均未引CAT活性的显著变化。用5 mg·L-1的鱼藤酮处理3龄舞毒蛾幼虫,其CAT活性,在处理48 h时最大,为蒸馏水组的2.92倍,在处理12 h达最低,为蒸馏水处理组的1.34倍。用10 mg·L-1的鱼藤酮处理3龄舞毒蛾幼虫,CAT活性在处理36 h时最大,为蒸馏水组的3.30倍,在处理24 h达最低,为蒸馏水处理组的1.23倍。用20 mg·L-1的鱼藤酮处理3龄舞毒蛾幼虫,CAT活性在处理36 h时最大,为蒸馏水组的3.82倍,在处理12 h达最低,为蒸馏水处理组的1.31倍。5、10、20 mg·L-1的鱼藤酮药液处理3龄舞毒蛾幼虫后,CAT活性均呈现先增加后降低的趋势,处理12 h均未引起CAT活性的显著变化,而在24、36、48、60、72 h均引起CAT活性的显著增加(p<0.05)。
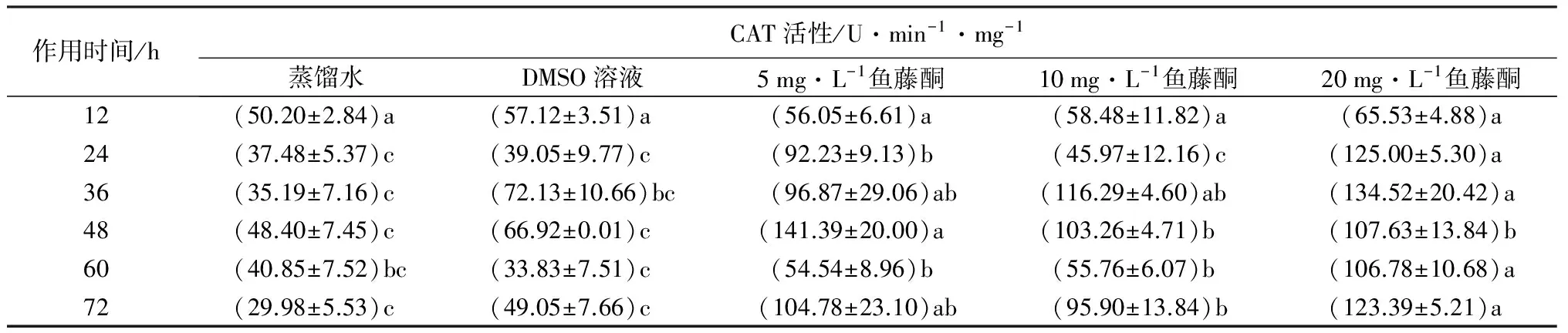
表2 鱼藤酮对舞毒蛾幼虫CAT活性的影响
注:表中数据为平均值±标准误。不同字母表示同一时间不同处理间差异显著(p<0.05)。
2.4 鱼藤酮对舞毒蛾幼虫生长发育的影响
蒸馏水与DMSO溶液处理舞毒蛾3龄幼虫后,幼虫鲜质量变化趋势较一致:处理1 d,幼虫鲜质量增长率分别为29.75%和41.30%;处理2 d,幼虫鲜质量增长率分别为109.72%和110.14%;处理3 d,幼虫鲜质量增长率分别为125.46%和126.57%。与蒸馏水处理组相比,5、10 mg·L-1鱼藤酮药液处理1~2 d时,3龄幼虫鲜质量增长较为缓慢,在处理1 d时,鲜质量增长率分别为4.55%和3.26%,处理2 d时,鲜质量增长率分别为35.10%和19.25%;处理3 d时,幼虫鲜质量增长加快,分别为94.44%和62.87%,但仍低于蒸馏水和DMSO溶液处理组的增长率。5、10 mg·L-1鱼藤酮药液处理3龄幼虫3 d后,幼虫鲜质量均显著低于蒸馏水与DMSO溶液处理组,说明植物源杀虫剂鱼藤酮对舞毒蛾幼虫生长具有抑制作用(表3)。
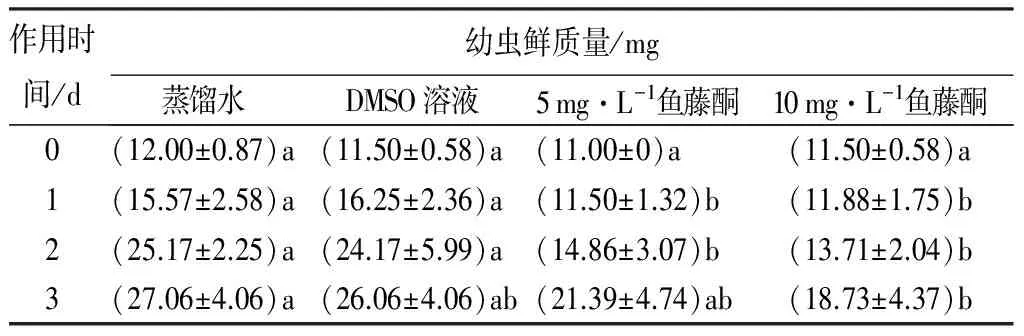
表3 鱼藤酮对舞毒蛾幼虫鲜质量的影响
注:表中数据为平均值±标准误。不同字母表示同一时间不同处理间差异显著(p<0.05)。
3 结论与讨论
鱼藤酮是早期人们从豆科藤本植物中提取的一种天然杀虫剂,主要来源于豆科的鱼藤属(Derris)、灰毛豆属(Tephrosia)、尖荚豆属(Lonchocarpus)、鸡血藤属(Millettia)、黄檀属(Dalbergia)、毒鱼豆属(Piscidia)和蝶豆属(Clitoria)等植物[7-9],其中对鱼藤属和灰毛豆属植物研究较为深入,是三大传统植物源杀虫剂之一。鱼藤酮的作用方式较多,它对一些鳞翅目昆虫有强烈的触杀作用和胃毒作用,对储粮害虫有拒食作用[10-11],也可作为熏蒸剂使用,具有广谱的杀虫活性,可防治15个目137个科的800余种害虫[12-14],对螨类、蚜虫、菜粉蝶等害虫都有优良的防治效果[15]。本试验的研究结果显示,鱼藤酮对舞毒蛾3龄幼虫具有低毒高效的触杀作用,12、24、36、48 h致死中浓度LC50分别为14.10、10.44、9.75、9.51 mg·L-1,且鱼藤酮毒力随作用时间的增加而增强。
早期研究表明,鱼藤酮主要作用于电子传递、氧化磷酸化及三羧酸循环(TCA)等内呼吸过程[16],影响昆虫的呼吸作用。它能直接通过气孔、表皮等部位进入虫体,迅速抑制线粒体呼吸,中毒症状表现快速。生物体在逆境中体内具有强氧化能力的自由基活性增加,这些自由基对很多生物功能分子起破坏作用。正常情况下,昆虫体内有超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶能使自由基保持在低水平,以防止其毒害,是一种动态平衡的状态,一旦受到外界刺激,昆虫体内抗氧化酶活性发生变化。本试验发现,给舞毒蛾3龄幼虫施药后,试虫体内CAT活性整体呈增强趋势,呈现先上升后又下降的波动,最低值为蒸馏水处理组的1.23倍。最高值为蒸馏水组的3.82倍。5、10、20 mg·L-1鱼藤酮药液处理试虫12 h均未引起CAT活性的显著变化,随作用时间的增长,CAT活性逐渐增强,说明CAT活性的激发具有时间效应。低质量浓度的鱼藤酮是否能够诱导试虫体内过氧化氢酶基因的过表达,从而引起CAT活性的增加,有待于进一步研究。
鱼藤酮能够使害虫细胞内的电子传递链受到抑制,迫使电子传递途径中断,氧化-还原反应也不能顺利进行,促使生物体内ATP含量降低,使害虫因不能得到能量供应而出现麻痹、行动迟缓症状,并逐渐死亡。鱼藤酮还可以使细胞中纺锤体微管的组装受到抑制,并已有相关研究证实。从细胞遗传学角度看,微管形成受到抑制必然会影响纺锤体的形成,从而影响细胞的正常分裂,鱼藤酮可能通过这一途径影响虫体的生长[17]。张双喜进行了鱼藤酮对菜粉蝶(Pierisrapae)作用效果的研究,由于鱼藤酮能够抑制菜粉蝶幼虫的呼吸作用,而菜粉蝶幼虫生长发育过程所需要的能量供给被迫减少,导致幼虫蜕皮、化蛹因不能突破旧表皮而完成蜕皮化蛹形成畸形虫态[10]。本试验发现,对舞毒蛾3龄幼虫进行鱼藤酮药液点滴处理后,试虫连续3 d的鲜质量增长率都低于蒸馏水与DMSO溶液处理组,表明鱼藤酮能够抑制舞毒蛾幼虫的生长,低质量浓度的鱼藤酮是否能够引起试虫体内ATP合成酶基因表达的变化,有待于从分子水平上进一步研究。
[2] 赵日良,徐振昌,张来,等.毒环防治栎舞毒蛾试验研究[J].吉林林业科技,1999,141(4):4-5.
[3] 严静君.中国舞毒蛾寄生昆虫和捕食昆虫初步名录[J].森林病虫通讯,1985(1):21-24.
[4] 谷文祥,曾鑫年,谢建军.不同温度对毛鱼藤和西非灰毛豆愈伤组织生长的影响[J].华南农业大学学报,1999,20(4):125-126.
[5] BRADFORD M M. A rapid and sensitive method for the quantitmion of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem,1976,72(1/2):248-254.[6] 徐镜波,袁晓凡,郎佩珍.过氧化氢酶活性及活性抑制的紫外分光光度法测定[J].环境化学,1997,16(1):73-76.
[7] DEWICK P M. The Flavonoids-advances in research since 1980[M]. London: Chapman and Hall,1988:125-209.
[8] JACOBSON M, CROSBY D G. Naturally occurring insecticides[M]. NEW York: Marcel Dekker,1971:71-97.
[9] 曾鑫年,谢军,侯学文,等.植物离体培养物中鱼藤酮的分离与HPLC测定[J].热带作物学报,2000,21(4):27-32.
[10] 张双喜.鱼藤杀虫作用的研究[D].广州:华南农业大学,1989.
[11] 张业光.非洲山毛豆提取物对菜青虫生物活性及其有效成分研究[D].广州:华南农业大学,1990.
[12] BLOSZYK E, NAWROT J, HARMATHA J, et al. Effectiveness of antifeedant of plant origin in protection of packaging materials against storage insects[J]. Journal of Applied Entomology,1990,110(1):96-100.
[13] NAWROT J, HARMATHA J, KOSTOVAL I, et al. Antifeeding activity of rotenone and some derivatives towards selected insect storage pests[J]. Biochemical Systematics and Ecology,1989,17(1):55-57.
[14] ZHONG Z L, ZHOU G L. Studies on the biological activity of rotenone ofCulexquinquefasciatus[J]. Annual Bulletin of the Society of Parasitology,1996,18:15-19.
[15] 赵莉蔺,刘素琪,侯辉,等.植物源杀螨剂的研究进展[J].植物医生,2004,17(3):4-6.
[16] ESPOSTI M D. Inhibitors of NADH-ubiquinone reductase: an overview[J]. Biochimica et Biophysica Acta,1998,1364(2):222-235.
[17] 徐汉虹,黄继光.鱼藤酮的研究进展[J].西南农业大学学报,2001,23(2):140-143.
Toxic Effect of Rotenone on Gypsy Moth//
Wen Rongrong, Ma Ling, Dong Wanying, Wang Buyong
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2016,44(9):103-105 ,111.
Rotenone;Lymantriadispar; Catalase
1)国家“863”计划项目(2013AA102701);黑龙江省自然科学基金项目(ZD201404);中央高校基本科研业务专项(2572016AA09)。
问荣荣,女,1987年8月生,东北林业大学林学院,博士研究生,E-mail:wenrongrong87@163.com。
马玲,东北林业大学林学院,教授。E-mail:maling63@163.com。
2016年3月25日。
S763.3
责任编辑:程 红。

