动物源肌内磷脂及其脂肪酸含量、组成与生理功效研究进展
摘 要:动物源肌内磷脂是肉品脂肪的重要组成之一,其含量及脂肪酸组成是影响肉品加工特性、营养品质及风味组成的关键因素,对于改善肉品的食用价值有着重要的实际意义。然而,从目前的文献来看,动物源肌内磷脂的相关研究仍非常稀缺。本文系统地综述了肌内磷脂及其脂肪酸的基本特性、影响因素与生理功效,以期为动物源肌内磷脂的研究提供创新依据,为肉类工业的发展提供理论基础。
关键词:肌内磷脂;脂肪酸;含量;组成;生理功效
A Review of the Current Knowledge of Fatty Acid Contents, Composition and Physiological Functions of
Animal-Derived Intramuscular Phospholipids
XUE Shan
(College of Biological Science and Technology, Minnan Normal University, Zhangzhou 363000, China)
Abstract: Intramuscular phospholipids represent an important component of edible animal fats. The fatty acid contents and composition of meat products are the key factors that affect their processing characteristics, nutritional quality and flavor composition and have a great practical significance to improve their food value. However, a review of the current literature shows that very few studies have been conducted concerning animal-derived intramuscular phospholipids. This article provides a systematic review of the influencing factors and physiological properties of the general properties of intramuscular phospholipids and their constituent fatty acids, aiming to provide evidence for innovative studies on intramuscular phospholipids and provide a theoretical basis for the development of the meat industry.
Key words: intramuscular phospholipids; fatty acids; content; composition; physiological functions
DOI:10.15922/j.cnki.rlyj.2016.09.008
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2016)09-0040-05
引文格式:
薛山. 动物源肌内磷脂及其脂肪酸含量、组成与生理功效研究进展[J]. 肉类研究, 2016, 30(9): 40-44. DOI:10.15922/j.cnki.rlyj.2016.09.008. http://rlyj.cbpt.cnki.net
XUE Shan. A review of the current knowledge of fatty acid contents, composition and physiological functions of animal-derived intramuscular phospholipids[J]. Meat Research, 2016, 30(9): 40-44. (in Chinese with English abstract) DOI:10.15922/j.cnki.rlyj.2016.09.008. http://rlyj.cbpt.cnki.net
磷脂最早是由科学家Uauquelin于1812年从人脑中发现,之后由科学家Gobley于1844年从蛋黄中分离出来,并于1850年按希腊文Lekithos(蛋黄)命名为Lecithni(卵磷脂),继而陆续从诸多动植物体中分离、鉴定为磷脂物质,而迄今被认为含量最丰富的大豆磷脂是于1930年发现的[1-2]。磷脂是构成细胞膜的主要化学成分,不仅是生命的基础物质之一,同时又是肉品非常重要的营养和风味前提物质。随着生活水平的提高,居民对磷脂的重视程度日益增加[3]。动物性磷脂,来源于动物的卵、脑、肝脏、肾脏、心脏和肺等组织器官,较植物性的磷脂更易被机体吸收利用。
肌肉中脂肪及脂肪酸的种类与组成是决定脂肪组织理化性质、影响肉质营养和风味的关键因素,其对于改善肉品的食用价值有着重要的实际意义。肌肉中的脂肪是由甘油三酯、磷脂和游离脂肪酸组成的,但是较之总脂肪和甘油三酯的研究,国内外对肌内磷脂的研究报道还相对较少。作为影响肉品营养和风味的重要因素,肌内磷脂的含量和脂肪酸组成对肉及其制品的品质十分重要。因此,本文通过从脂肪酸角度对肌内磷脂的结构、理化特性进行简述、分析了影响畜禽肉类肌内磷脂及其脂肪酸组成的影响因素,综述了肌内磷脂及脂肪酸的生理功效,以期为肌内磷脂的相关研究提供一定的理论基础。
1 动物源肌内磷脂的化学结构及理化特性
1.1 化学结构
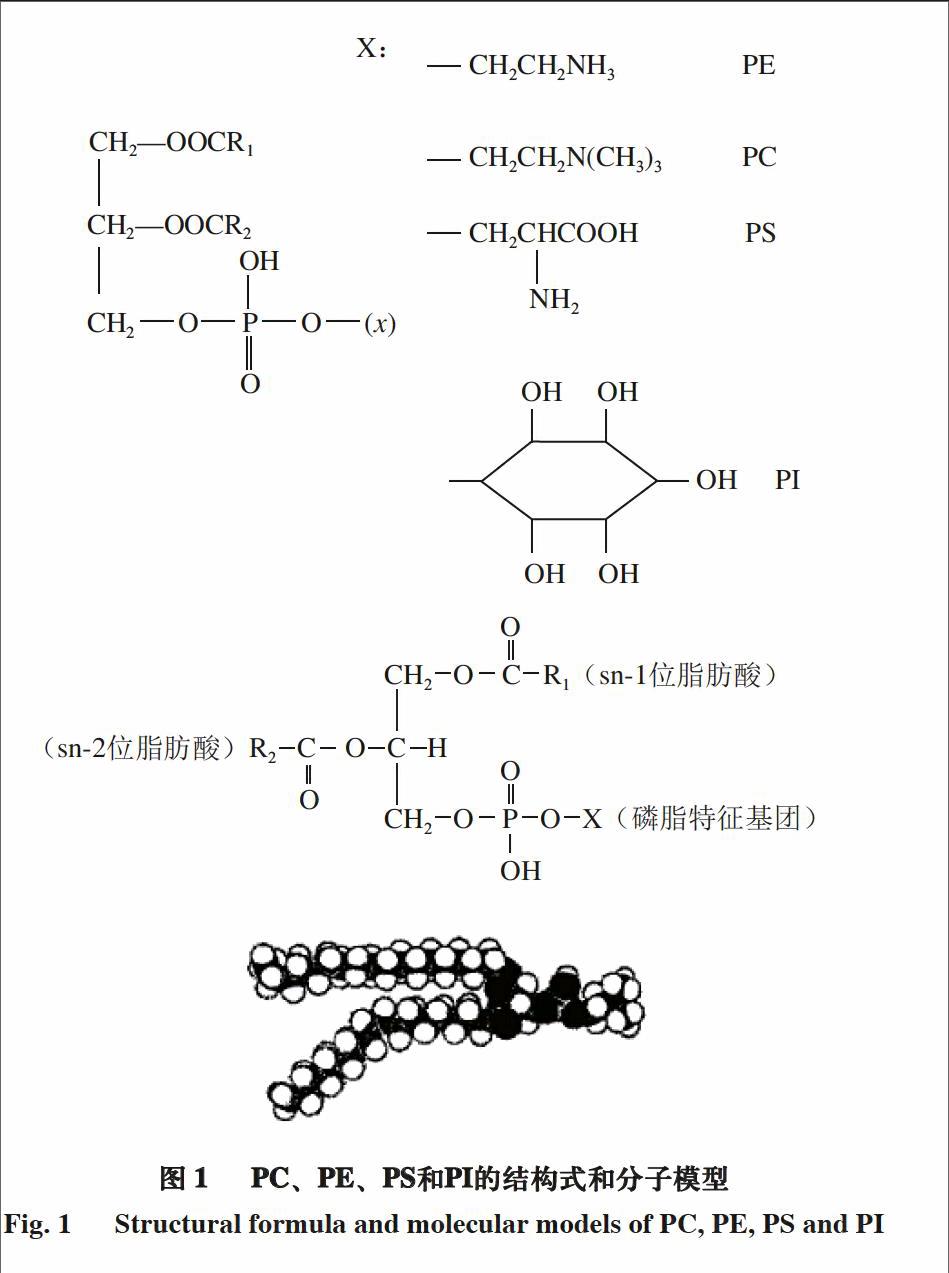
磷脂(phospholipids)是一种混合物,大多数为天然产物,少数为人工合成。肌内磷脂按照分子结构的不同,可将单体划分为卵磷脂(phosphatidylcholine,PC)、脑磷脂(phosphatidylethanolamine,PE)、丝氨酸磷脂(phosphatidylserine,PS)和肌醇磷脂(phosphatidylinositol,PI),其结构式和分子模型分别如图1所示。
磷脂分子在结构上具有非极性和极性部分,其中,非极性部分由2 条碳氢链(R1和R2)组成;极性部分(极性头),含磷酸根和各种极性取代基(X)。当X分别为CH2—CH2—N(CH3)3、CH2—CH2—NH3、CH2—CH(NH2)COOH、C6H(OH)5时,所生成的磷脂分别为卵磷脂、脑磷脂、丝氨酸磷脂和肌醇磷脂。然而,当极性头相同时,由于非极性部分的碳氢链的链长及饱和度不同,每类磷脂又可分为不同的分子类别(亚组分)。
1.2 理化特性
磷脂纯品无色、无味,在常温下为白色固体。但是,因提取、贮存方法等条件的差异,磷脂产品在室温下常呈现淡黄色至棕色,并具可塑性或流动性。磷脂能够溶解于脂肪烃类等有机溶剂。当有少量的油脂存在时,磷脂在极性溶剂中的溶解度将大大增加。由于磷脂碳氢链中含有大量的不饱和双键,其对光和热都十分敏感,极易氧化变质,因此,也使得分离和纯化磷脂的难度大大增加,成为分离技术和天然产物化学发展中的瓶颈[4]。
2 肌内磷脂的含量
畜禽肉的肌肉组织中均匀地分布着肌内脂肪,这些脂肪中约50%以上为肌内磷脂,通常与肌肉组织中的膜蛋白结合紧密[5]。肌内磷脂的种类及其脂肪酸构成直接决定了其氧化降解特性,进而对肉品的营养、风味都造成了显著的影响。
据报道,在100 g的新鲜肌肉组织中,磷脂的含量约为0.5~1.0 g,与肌肉中的总脂肪含量无关[6]。肌内磷脂主要由磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)组成,两者分别占磷脂总量的45%~60%和20%~30%,而其他磷脂组分的含量相对较低。研究表明,猪肉、牛肉和鸭肉中肌内磷脂主要是PC和PE[7-8]。磷脂酰丝氨酸在大脑和神经组织中含量最多。在动物组织中磷脂酰丝氨酸约占总磷脂总量的5%~25%。肌内磷脂的含量和组成与肌肉的代谢类型也密切相关,氧化型肌肉高于糖酵解型肌肉,这是因为氧化型肌肉多是由氧化型肌纤维组成,线粒体含量高,因而磷脂含量也较高。黄业传[9]报道,荣昌和PIC猪肌内磷脂的含量分别为0.97%和0.86%,这与Yang等[10]报道是一致的,同时指出猪肉中肌内脂肪含量的差异主要是由甘油三酯造成的,而磷脂主要是细胞膜的组成成分,因此含量比较恒定,大都在0.5%~1.0%范围内。此外,王道营等[11]认为,品种、饲养条件、日龄或日粮对肌内磷脂含量的影响很小或几乎没有。
3 肌内磷脂的脂肪酸组成
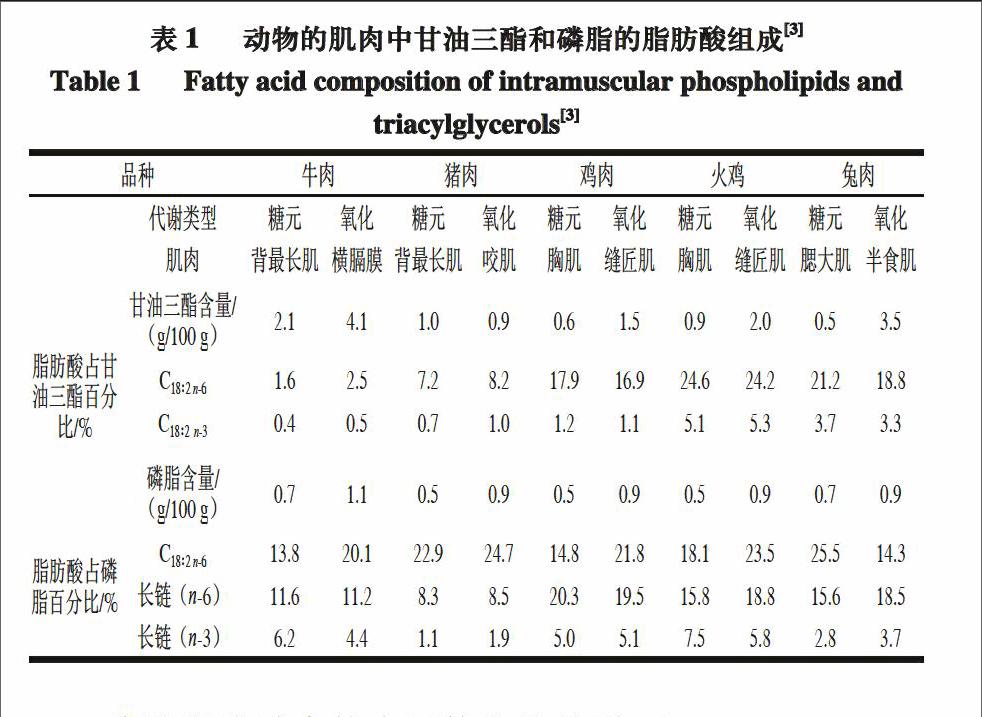
诸多研究表明[6],肌内甘油三酯与磷脂脂肪酸的组成差异很大(表1),这种差异也正好解释这类脂肪对肉品风味形成所造成的积极或消极的影响程度。
磷脂脂肪酸中的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)含量(45%~55%)明显高于甘油三酯[12]。肌内磷脂PUFA主要由亚油酸(14%~30%)和长链PUFA组成(如花生四烯酸C20∶4(8%~14%)、二十碳五烯酸和二十二碳多不饱脂肪酸(C22∶5和C22∶6))。肌内磷脂中PUFA的含量通常受动物体细胞内多种复杂酶系统的严格调控,且这些酶与脂肪酸的不饱和程度、碳链长度以及脂肪酸在磷脂分子中的酯化效应密切相关。王毅等[13]研究了伊拉兔肩胛肌、背腰肌、后腿肌和肝脏部位的肌内磷脂脂肪酸组成,结果显示,饱和脂肪酸(saturated fatty acid,SFA)主要是由棕榈酸(C16∶0)和硬脂酸(C18∶0)组成,肝脏中的C18∶0最高而背腰肌中的最低;单不饱和脂肪酸(monounsaturated fatty acid,MUFA)中的油酸(C18∶1 n-9)含量最高(约占80%),在背腰肌中最高而肝脏中最低;PUFA中的亚油酸
(C18∶2 n-6)和花生四烯酸(C20∶4 n-6)含量最高,肝脏中C18∶2 n-6最多而肩胛肌最低,C20∶4 n-6在肝脏中的含量显著低于肩胛肌、背腰肌和后腿肌,而这5 种磷脂脂肪酸的总含量约占总脂肪酸含量的86%。
4 影响肌内磷脂含量及脂肪酸组成的因素
磷脂的含量和脂肪酸组成与动物种类、肌肉代谢类型、喂饲过程中辅料的添加、肉品的加工条件以及贮存方式等紧密相关。磷脂的氧化活性很高,这是因为磷脂中富含易受自由氧攻击的长链PUFA,同时鉴于细胞膜中的磷脂双分子层结构,磷脂易与肌细胞中水相的脂肪氧化催化剂接触而发生氧化降解[14]。其中,磷脂酰乙醇胺中的长链PUFA比例最高,其对氧化的敏感效应也最强。
4.1 原料肉加工过程中磷脂含量及组成变化
据报道,肉品磷脂中富含PUFA(如C18∶2 n-6和C20∶4 n-6),因而极易被氧化或降解,PUFA是肉制品脂肪氧化反应中的主要底物[15]。不同处理条件下肉品中肌内磷脂的氧化降解产物将直接影响挥发性风味物质的组成,并且磷脂氧化降解的程度随脂肪酸碳链上双键数目的增加而
升高[5]。有研究报道在烘烤过程中鸡胴体磷脂含量及脂肪酸组成的变化,C18∶2 n-6的损失相对较小(约0~45%),而C20∶4 n-6
和二十二碳五烯酸或六烯酸的损失量分别高达50%~70%和70%~100%;糖酵解型肌肉的总磷脂含量略有下降(10%),而氧化型小腿肌肉下降显著(35%)[16]。
肉品在热加工处理过程中脂肪含量及脂肪酸组成都将发生不同程度的改变,尽管诸多学者进行了一些探究,但是大多仅局限于总脂肪酸组成,而有关磷脂的报道较为缺乏。黄业传等[17-18]研究显示,加工的方式与时间都会显著影响猪肉中磷脂脂肪酸组成、脂肪含量、营养特性及挥发性风味物质组成,相比而言,脂肪酸组成、营养特性和风味组成受加工方式的影响较大,而脂肪含量受加工时间的影响则更为显著。
徐为民等[5]指出,肌内磷脂是腌腊肉制品风味形成的重要前体物质。在腌制的过程中,肌内磷脂将会发生水解及氧化反应,并可进一步通过美拉德反应与其他物质反应生成风味物质。在腌腊肉的加工生产过程中,肌内磷脂的含量呈现显著下降趋势[10,19-20],而甘油三酯含量的变化很小,游离脂肪酸含量将随之升高。由于游离脂肪酸中富含长链的PUFA,由此说明这些PUFA几乎全部来源于磷脂。
据报道[3],在南京板鸭的不同加工阶段,股二头肌中磷脂的脂肪酸组成发生了很大的变化。在腌腊肉制品加工过程中,脂质能够在酶的催化作用下水解,而不同pH值的酸碱环境会导致不同程度的脂质水解。有报道称[21]内源酶是肌内磷脂氧化、水解的重要原因,常见的有脂肪酶、酯酶和磷脂酶,这些能够参与水解磷脂的酶统称为磷脂水解酶。
4.2 肉或肉制品冷藏过程中磷脂含量及组成变化
据了解,有关冻藏对原料肉以及加工肉制品脂肪酸组成或脂肪含量的影响,已有很多学者[22-23]进行了研究,但是对于加工肉制品在冷藏期间脂肪含量及总脂肪酸组成的变化,只有少数学者如Byrne[24]、Igene[25]、Yamamoto[26]等给予了报道。针对磷脂在冷藏期间变化的研究,国内外都非常欠缺。黄业传等[27]研究认为,猪肉在冷藏期间磷脂中大多数脂肪酸的含量都发生了变化,SFA比例升高,而PUFA比例降低,其中C18∶1 n-9、C18∶2 n-6、
C20∶4 n-6、MUFA和PUFA含量的变化幅度显著,且肌内磷脂中各脂肪酸组成的变化幅度几乎全都大于甘油三酯,推测其原因可能是冷藏期间肌肉组织细胞膜中的磷脂更易接触脂肪酶而发生氧化降解引起的,同时磷脂中高含量的PUFA也极易引起脂肪的氧化[28-29]。
5 肌内磷脂及其脂肪酸的生理功能
磷脂是构成细胞基本结构的必需物质,它是生命的基础物质之一,对于维持细胞通透性与细胞内氧的传递发挥着重要作用[30]。鉴于磷脂能够为人们提供必需脂肪酸和胆碱等营养物质,其被誉为“本世纪最伟大的保健品”。有研究证实,磷脂与体内脂肪代谢、肌肉生长、神经系统发育、机体抗氧化损伤以及生殖、激素等方面都有着密切的关系[31],而磷脂代谢紊乱可引发诸多疾病,比如糖尿病[32-33]、肥胖症[34]、动脉硬化症[35]、冠心病[32]、阿尔茨海默病[36]、脑损伤[37]、癌症[38-39]、脂肪肝[40]及巴特综合症[41]等。此外,肌内磷脂中高含量的n-6和n-3 PUFA均是类二十烷酸的有效前体,因而磷脂中PUFAs的含量和组成与诸多慢性疾病(如冠心病、高血压、癌症、关节炎、精神疾病[42]及其他免疫疾病)的发生都有一定的关联[43]。
5.1 延缓衰老
肌内磷脂是组成脂蛋白与生物膜(如核膜、细胞质膜、线粒体膜以及内质网等)的基本结构。随着生物个体的不断成长,机体中的生物膜愈加容易受到自由氧的攻击而造成系统损伤,而磷脂成分能够有效地发挥延缓衰老的功效,有助于受损生物膜的修复[44]。
5.2 促进神经传导,提高大脑活力
毕洁琼等[45]研究证实,大豆磷脂具有增强记忆的功能,其在延缓细胞衰老方面有着积极的作用,可显著减少组织中丙二醛(malondialdehyde,MDA)的积累,增强超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)的活性,从而缓解或部分缓解由D-半乳糖引起的对大鼠的致衰作用。磷脂酰丝氨酸(phosphatidylserines,PS)具有多种生理功能,如增加细胞膜的流动性、提高大脑记忆、缓解老年痴呆等[46]。
5.3 保护心血管
磷脂成分不仅能够改善血液供氧循环从而降低血液黏度,还可以延长血红细胞的寿命从而增强机体造血性能,辅助治疗再生障碍性贫血。池莉平[47]、李春艳[48]等证实大豆磷脂和蛋黄磷脂均能够有效地调节大鼠的血脂代谢,降低大鼠血清总胆固醇(total cholesterol,TC)和血清甘油三酯(triglyceride,TG)的含量。
5.4 促进脂肪代谢,保护肝脏
肝细胞膜的损伤大多与肝脏细胞膜中磷脂成分的缺乏有关,如脂肪肝、肝炎、肝硬化等肝病的发生也多与磷脂的合成紧密联系。Wat[49]、Kamili[50]等研究发现,牛乳磷脂可以改善小鼠高血脂、肝肿大、脂肪肝这些不良症状。王玉明等[51]研究表明,大豆磷脂、蛋黄磷脂以及牛乳磷脂均有着降血脂和降肝脂的作用,其中以大豆磷脂尤为明显,并且大豆磷脂和蛋黄磷脂的益智功效甚至可能优于牛乳磷脂。此外,肌内磷脂中含有大量的n-3 PUFA,病患手术后实行n-3 PUFA免疫营养治疗,能够改善谷草转氨酶、谷丙转氨酶和乳酸脱氢酶等肝功能指标的下降情况[52]。
5.5 免疫调节功能
在免疫学领域,通常将一些抗原分子通过共价或非共价键与磷脂组成的脂质体结合,其中卵磷脂是经常用到的一种脂质体,它的抗原性显著弱于磷脂酸、磷脂酰甘油以及磷脂酰肌醇。与游离抗原相比,卵磷脂包埋的抗原能够明显地提高抗体的滴定度,从而起到免疫调节的生理功能。
5.6 抗肿瘤功能
近年来,磷脂及其衍生物的抗肿瘤作用引起了人们的广泛关注。据报道[53],不同磷脂衍生物对肿瘤的抑制效果不同。肌内磷脂抗肿瘤作用的发挥与其富含的PUFA中的n-3 PUFA息息相关。大量的动物实验及细胞实验证实,n-3 PUFA抗肿瘤作用卓有成效,尤其对胰腺癌、乳腺癌、直(结)肠癌以及前列腺癌抑制作用明显[54]。研究显示,n-3 PUFA能够通过诸多生理代谢途径达到抑制肿瘤细胞增殖、促进肿瘤细胞分化以及诱导肿瘤细胞凋亡的目的。与此同时,n-3 PUFA还可以显著改善肿瘤患者的体质水平,降低肿瘤患者的死亡率[55]。
参考文献:
[1] 胡小中. 磷脂酰胆碱的生理功能和作用机理[J]. 粮油食品科技, 2011, 19(4): 42-44. DOI:10.3969/j.issn.1007-7561.2011.04.016.
[2] JAN W, DIETER L, HERBERT T. Hyphenated tools for phospholipidomics[J]. Journal of Biomolecular Techniques, 2008, 19(3): 211-216.
[3] 王道营. 南京板鸭肌内磷脂的分析检测及其在加工过程中的变化规律研究[D]. 南京: 南京农业大学, 2006.
[4] 姚辉. 磷脂微胶囊制备技术的研究[D]. 大连: 大连理工大学, 2004.
[5] 徐为民, 王道营, 诸永志, 等. 肌内磷脂在腌腊肉制品风味形成中的作用机制研究进展[J]. 江苏农业学报, 2010, 26(1): 204-207. DOI:10.3969/j.issn.1000-4440.2010.01.038.
[6] 马长伟, 杨红菊, 乔发东. 脂肪变化和美拉德反应与肉品风味质量的关系[J]. 食品科技, 2003(增刊1): 177-183.
[7] BOSELLI E, PACETTI D, CURZI F, et al. Determination of phospholipid molecular species in pork meat by high performance liquid chromatography-tandem mass spectrometry and evaporative light scattering detection[J]. Meat Science, 2008, 78(3): 305-313. DOI:10.1016/j.meatsci.2007.06.017.
[8] CABONI M F, MENOTTA S, LERCKER G. High-performance liquid chromatography separation and light scattering detection of phospholipids from cooked beef[J]. Journal of Chromatography A, 1994, 683(1): 59-65. DOI:10.1016/S0021-9673(94)89102-8.
[9] 黄业传. 不同处理条件下猪肉脂肪酸组成变化及脂肪对猪肉风味作用的研究[D]. 重庆: 西南大学, 2011.
[10] YANG H, MA C, QIAO F, et al. Lipolysis in intramuscular lipids during processing of traditional Xuanwei ham[J]. Meat Science, 2005, 71(4): 670-675. DOI:10.1016/j.meatsci.2005.05.019.
[11] 王道营, 徐为民, 徐幸莲. 板鸭肌间磷脂的高效液相色谱分析[J]. 南京农业大学学报, 2006, 29(1): 108-111.
[12] PETR?N M J, MURIEL E, TIM?N M L, et al. Fatty acids and triacylglycerols profiles from different types of Iberian dry-cured hams[J]. Meat Science, 2004, 68(1): 71-77. DOI:10.1016/j.meatsci.2004.01.012.
[13] 王毅, 贺稚非, 陈红霞, 等. 不同部位伊拉兔肉脂肪酸组成的对比分析[J]. 食品科学, 2014, 35(4): 50-54. DOI:10.7506/spkx1002-6630-201404028.
[14] ALFAIA C M M, ALVES S P, LOPES A F, et al. Effect of cooking methods on fatty acids, conjugated isomers of linoleic acid and nutritional quality of beef intramuscular fat[J]. Meat Science, 2010, 84(4), 769-777. DOI:10.1016/j.meatsci.2009.11.014.
[15] BRUGIAPAGLIA A, DESTEFANIS G. Effect of cooking method on the nutritional value of Piemontese beef[C]//Proceedings of the 58th International Congress of Meat Science and Technology, Montreal, Canada. 2012: 12-17.
[16] 杨红菊, 乔发东, 马长伟. 脂肪氧化和美拉德反应与肉品风味质量的关系[J]. 肉类研究, 2004, 18(1): 25-28. DOI:10.3969/j.issn.1001-8123.2004.01.012.
[17] 黄业传, 李洪军, 吴照民, 等. 猪肉烤制过程中脂肪含量和脂肪酸组成的变化[J]. 食品科学, 2011, 32(24): 213-219.
[18] 黄业传, 李洪军, 秦刚, 等. 不同加工方式与时间对猪肉脂肪含量和脂肪酸组成的影响[J]. 食品工业科技, 2012, 33(1): 159-174.
[19] SAMPLES S, PICKOVA J, WIKLUND E. Fatty acids, antioxidants and oxidation stability of processed reindeer meat[J]. Meat Science, 2004, 67(3): 523-532. DOI:10.1016/j.meatsci.2003.12.006.
[20] 佘兴军, 童群义. 金华火腿加工过程中肌肉肌内脂的水解变化研究[J]. 食品与发酵工业, 2005, 31(5): 139-142. DOI:10.3321/j.issn:0253-990X.2005.01.037.
[21] ZHOU G H, ZHAO G M. Biochemical changes during processing of traditional Jinhua ham[J]. Meat Science, 2007, 77(1): 114-120. DOI:10.1016/j.meatsci.2007.03.028.
[22] ALVAREZ I, de la FUENTE J, CANEQUE V, et al. Changes in the fatty acid composition of M. longissimus dorsi of lamb during storage in a high-oxygen modified atmosphere at different levels of dietary vitamin E supplementation[J]. Journal of Agricultural and Food Chemistry, 2009, 57(1): 140-146. DOI:10.1021/jf801940c.
[23] de CASTRO F A F, ANA H M P S, CAMPOS F M, et al. Fatty acid composition of three freshwater fishes under different storage and cooking processes[J]. Food Chemistry, 2007, 103(4): 1080-1090. DOI:10.1016/j.foodchem.2006.10.002.
[24] BYRNE D V, BREDIE W L P, BAK L S, et al. Sensory and chemical analysis of cooked porcine meat patties in relation to warmed-over flavour and pre-slaughter stress[J]. Meat Science, 2001, 59(3): 229-249. DOI:10.1016/S0309-1740(01)00072-9.
[25] IGENE J O, PEARSON A M. Role of phospholipids and triglycerides in warmed-over flavor development in meat model systems[J]. Journal of Food Science, 1979, 44(5): 1285-1290. DOI:10.1111/j.1365-2621.1979.tb06420.x.
[26] YAMAMOTO Y, IMOSE K. Changes in fatty acid composition in sardines (Sardinops melanosticta) with cooking and refrigerated storage[J]. Journal of Nutritional Science and Vitaminology, 1989, 35(1): 39-47.
[27] 黄业传, 李洪军, 贺稚非. 兔肉冷藏过程中脂肪酸组成的变化[J]. 食品科学, 2013, 34(19): 52-57. DOI:10.7506/spkx1002-6630-201319012.
[28] 熊国远. 致昏、禁食方式和贮藏温度对獭兔品质的影响研究[D]. 南京: 南京农业大学, 2006.
[29] HUANG Y C, HE Z F, LI H J, et al. Effect of antioxidant on the fatty acid composition and lipid oxidation of intramuscular lipid in pressurized pork[J]. Meat Science, 2012, 91(2): 137-141. DOI:10.1016/j.meatsci.2012.01.006.
[30] 谢朝顺, 李桂. 羊、猪、鸡脑中磷脂及磷脂脂肪酸组成分析[J]. 河南工业大学学报(自然科学版), 2010, 31(4): 29-31; 36.
[31] MANAHAN D J. A guide to phospholipid chemistry[M]. New York: Oxford University Press, 1997.
[32] ATTIA N, DOMINGO N, LOREC A M, et al. Reverse modulation of the HDL anionic peptide factor and phspholipid transfer protein activity in coronary artery disease and type 2 diabetes mellitus[J]. Clinical Biochemistry, 2009, 42(9): 845-851. DOI:10.1016/j.clinbiochem.2008.12.008.
[33] ZHU C, LIANG Q L, HU P, et al. Phosphlipidomic identification of potential plasma biomarkes associated with type 2 diabetes mellitus and diabetic nephropathy[J]. Talanta, 2011, 85(4): 1711-1720. DOI:10.1016/j.talanta.2011.05.036.
[34] de VRIES R, KAPPELLE P J, DALLINGA-THIE G M, et al. Plasma phospholipid transfer protein activity is independently determined by obesity and insulin resistance in non-diabetic subjects[J]. Atherosclerosis, 2011, 217(1): 253-259. DOI:10.1016/j.atherosclerosis.2011.03.021.
[35] KRAUSS R M. Phospholipid transfer pritein and atherosclerosis: genetic studies take aim at a moving target[J]. Circulation, 2010, 122(5): 452-454. DOI:10.1161/CIRCULATIONAHA.110.966572.
[36] IGARASHI M, MA K, GAO F, et al. Disturbed choline plasmalogen and phospholipid fatty acid concentrations in Alzheimers disease prefrontal cortex[J]. Journal of Alzheimers Disease, 2011, 24(3): 507-517.
[37] PASVOGEL A E, MIKETOVA P, MOORE I M. Differences in CSF phospholipid concentration by traumatic brain injury outcome[J]. Biological Research For Nursing, 2010, 11(4): 352-331.
[38] JEONG R U, LIM S, KIM M O, et al. Effect of D-allose on prostate cacer cell lines: phospholipid profiling by nanoflow liquid chromatography-tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2011, 401(2): 689-698. DOI:10.1007/s00216-011-5113-1.
[39] KIEBISH M A, HAN X, CHENG H, et al. Cardiolipin and electron transport chain abnormalities in mouse brain tumor mitochndria: lipidomic evidence supporting the Warburg theory of cancer[J]. Journal of Lipid Research, 2008, 49(12): 2545-2556. DOI:10.1194/jlr.M800319-JLR200.
[40] LOGUERC?O C, FEDERICO A, TRAPPOLIERE M, et al. The effect of a silybin-vitamin E-phospholipid complex on nonalcholic fatty liver disease: apilot study[J]. Digestive Diseases and Sciences, 2007, 52(9): 2387-2395.
[41] SCHLAME M, REN M. Barth syndrome, a human disorder of cardiolipin metabolism[J]. FEBS Letters, 2006, 580(23): 5450-5455. DOI:10.1016/j.febslet.2006.07.022.
[42] SIMOPOULOS A P. Evolutionary aspects of diet: the omega-6/omega-3 ratio and the brain[J]. Molecular Neurobiology, 2011, 44(2): 203-215. DOI:10.1007/s12035-010-8162-0.
[43] KAUR N, CHUGH V, GUPTA A K. Essential fatty acids as functional components of foods: a review[J]. Journal of Food Science and Technology, 2014, 51(10): 2289-2303. DOI:10.1007/s13197-012-0677-0.
[44] 王兴国. 磷脂酶D的制取及在非水介质中磷脂的酶改性[D]. 无锡: 江南大学, 1994.
[45] 毕洁琼, 邵邻相, 徐玲玲, 等. 大豆磷脂对D-半乳糖致衰大鼠学习记忆及抗氧化能力的影响[J]. 中国粮油学报, 2011, 26(2): 9-13.
[46] 李阅兵, 刘承初, 谢晶, 等. 磷脂酰丝氨酸的提取分离研究进展[J]. 中国油脂, 2011, 36(3): 56-61.
[47] 池莉平, 谭剑斌, 陈瑞仪. 大豆卵磷脂调节血脂作用的动物实验研究[J]. 海峡预防医学杂志, 2007, 13(2): 51-52. DOI:10.3969/j.issn.1007-2705.2007.02.030.
[48] 李春艳, 成小松, 崔美芝, 等. 蛋黄卵磷脂对高血脂大鼠血脂水平的影响[J]. 中国实验动物学杂志, 2002, 12(5): 269-271. DOI:10.3969/j.issn.1671-7856.2002.05.004.
[49] WAT E, TANDY S, KAPERA E, et al. Dietary phospholipid - rich dairy milk extract reduces hepatomegaly, hepatic steatosis and hyperlipidemia in mice fed a high-fat diet[J]. Atherosclerosis, 2009, 205(1): 144-150. DOI:10.1016/j.atherosclerosis.2008.12.004.
[50] KAMILI A, WAT E, TANDY S, et al. Dietary milk phospholipid improves diet - induced hepatic steatosis in mice by reducing intestinal cholesterol absorption[J]. Atherosclerosis Supplements, 2010, 11(1): 72-73. DOI:10.1016/S1567-5688(10)70331-7.
[51] 王玉明, 李金章, 薛勇, 等. 摄食不同来源磷脂对大鼠脂质代谢及脑内磷脂脂肪酸组成的影响[J]. 中国油脂, 2012, 37(2): 31-34. DOI:10.3969/j.issn.1003-7969.2012.02.008.
[52] PARKER H M, JOHNSON N A, BURDON C A, et al. Omega-3 supplementation and non-alcoholic fatty liver disease: a systematic review and meta-analysis[J]. Journal of Hepatology, 2012, 56(4): 944-951.
DOI:10.1016/j.jhep.2011.08.018.
[53] 黄素芬. 鸭蛋黄卵磷脂提取技术研究[D]. 杭州: 浙江大学, 2004.
[54] MANNI A, XU H, WASHINGTON S, et al. The impact of fish oil on the chemopreventive efficacy of tamoxifen against development of N-methyl-N-nitrosourea-induced rat mammary carcinogenesis[J]. Cancer Prevention Research, 2010, 3(3): 322-330. DOI:10.1158/1940-6207.CAPR-09-0173.
[55] 王向群, 陈丽娟. n-3多不饱和脂肪酸抗肿瘤机制的研究进展[J]. 实用癌症杂志, 2011, 26(3): 321-324. DOI:10.3969/j.issn.1001-5930.2011.03.035.

