念珠地丝菌对五种抗真菌药的体外敏感性及电镜观察
武丽宁 李晨 王丹 曹冰兰 朱敬先
050011 石家庄,河北医科大学第四附属医院皮肤科(武丽宁、朱敬先);石家庄市第五医院感染科(李晨);承德医学院附属医院皮肤科(王丹);河北省元氏县中医院皮肤科(曹冰兰)
念珠地丝菌对五种抗真菌药的体外敏感性及电镜观察
武丽宁 李晨 王丹 曹冰兰 朱敬先
050011 石家庄,河北医科大学第四附属医院皮肤科(武丽宁、朱敬先);石家庄市第五医院感染科(李晨);承德医学院附属医院皮肤科(王丹);河北省元氏县中医院皮肤科(曹冰兰)
目的探讨5种临床常见抗真菌药对念珠地丝菌的体外抑制作用,并观察用药后念珠地丝菌的形态学变化。方法5种临床常见抗真菌药为特比萘芬、两性霉素B、氟胞嘧啶、氟康唑和伊曲康唑。参照美国国家临床试验标准委员会修订的M27⁃A2方案及相关文献,测定各药物对念珠地丝菌的MIC值。应用扫描电镜观察特比萘芬作用后念珠地丝菌的形态学变化。结果5种药物对念珠地丝菌的MIC值依次为:特比萘芬0.01 μg/ml、两性霉素B 0.4 μg/ml、氟胞嘧啶2 μg/ml、氟康唑2.69 μg/ml、伊曲康唑 0.25 μg/ml。念珠地丝菌对特比萘芬、两性霉素B、氟胞嘧啶、氟康唑均敏感,对伊曲康唑为剂量依赖性敏感。扫描电镜可见,经特比萘芬作用后念珠地丝菌菌体表面出现粗糙、皱缩、不规则缺损及孔洞,甚至呈碎片状。结论特比萘芬对念珠地丝菌的抗菌活性最显著,在一定范围内,特比萘芬浓度越高,念珠地丝菌被破坏的程度越严重。
地丝菌属;念珠菌属;体外研究;微生物敏感性试验;显微镜检查,电子,扫描;念珠地丝菌
念珠地丝菌(Geotrichum silvicola),旧称林生地霉,是新发现的一种罕见地丝菌[1],是无性繁殖,产生关节孢子的双相酵母样真菌。2002年,首次从巴西的果蝇和印度柞蚕幼虫身上分离出。2002年、2005年我们相继从1例脓癣患儿皮损和1例中毒性表皮坏死松解症患者的血液中分离到念珠地丝菌[2⁃3],两者分别应用特比萘芬及伊曲康唑辅以大蒜素注射液,均取得良好疗效。黄文明等[4]从l例足部溃疡患者的脓液中分离出该菌,经伊曲康唑治疗后好转。朱敬先等[2⁃3,5⁃9]已对该菌进行了一系列的研究包括其形态学、生理学、分子生物学及其致病性的初步探讨。我们通过体外药敏试验,旨在观察念珠地丝菌感染的有效治疗药物,并通过电镜进一步观察念珠地丝菌被药物破坏后的微观形态学变化,为今后的临床工作提供依据。
资料与方法
一、资料
1.实验菌株:念珠地丝菌(保藏号CGMCC2.3078)由我科临床分离所得,由中国科学院微生物研究所鉴定,近平滑念珠菌(ATCC22019)购自中国科学院微生物研究所菌种保藏中心。
2.主要试剂:特比萘芬(TER)、两性霉素B(AmB)、氟胞嘧啶(FC)、氟康唑(FCZ)、伊曲康唑(ICZ)均购于中国食品药品检定研究院,二甲基亚砜(DMSO)购于天津永大化学试剂开发中心。
3.培养基:改良沙氏培养基(SDA),RPMI 1640液体培养基购于上海立菲生物技术有限公司。
二、方法
1.菌悬液的制备:将冻存的念珠地丝菌及质控菌株近平滑念珠菌在常温下复苏2~3 d,转种于改良沙氏培养基上,在37℃恒温培养箱里培养1周。选择生长良好的菌落,用无菌的生理氯化钠溶液冲洗培养基斜面,并用3~4层纱布过滤,分别在血细胞计数板上调节孢子浓度至(1~5)×108cfu/ml,用RPMI 1640培养基先按照1∶20稀释菌悬液,再按照1∶50稀释,得到浓度为(1~5)×105cfu/ml的念珠地丝菌菌悬液及质控菌株菌悬液作为接种物。
2.药液的配制:准确称取药粉,AmB及ICZ用蒸馏水溶解,剧烈振荡使其溶解,得到浓度为640 μg/ml的药液。同样,FC及FCZ溶于蒸馏水中配制成浓度为1 280 μg/ml的药液。TER先用DMSO溶解,再以蒸馏水稀释得到浓度为1.6 μg/ml的药液,DMSO的终浓度不得超过1%[5]。用RPMI 1640液体培养基,采取倍比稀释法,将以上贮存液以2倍梯度稀释,最终得到2倍于终浓度的药液。即AmB、ICZ最终接种浓度为(0.031 3~16)μg/ml,FC、FCZ最终接种浓度为(0.125~ 64)μg/ml,TER最终接种浓度为(0.000 156~0.08)μg/ml。避光、密封,-20℃冰箱保存以备用。
3.药敏试验:用微量移液器将5种稀释好的药物按浓度由高到低依次吸取100 μl接种于96孔板的1~10列,吸取不同种类药物或不同浓度药物必须更换移液枪头,第11列加入100 μl RPMI 1640液体培养基。再将1~11列中分别加入菌悬液100 μl,第12列加入RPMI 1640液体培养基200 μl。即第11列为生长对照孔,第12列为空白对照孔。将96孔板置于37℃恒温培养箱中,培养5 d后读取结果。所有实验均重复3次取均值。
4.MIC值的判定:每次实验质控菌株的MIC值均需在参考范围之内方视为有效。在阳光充足的房间内,用肉眼观察,将各实验孔与生长对照孔比较。评分标准为:4分为浊度不降低;3分为浊度稍降低;2分为浊度显著降低;1分为浊度基本消失;0分为无浊度。因NCCLS方案里未明确规定特比萘芬及两性霉素B的判读终点,且此两种药物作用下的实验孔无拖尾现象,姑且将特比萘芬和两性霉素B0分(即肉眼观察通透、清晰)的试验孔定为MIC判读终点,氟胞嘧啶、氟康唑及伊曲康唑均以2分(即浊度显著降低)为判读终点[10]。
5.评判标准:根据NCCLS M27⁃A2方案推荐的抗真菌药物对酵母样真菌耐药或敏感的界定来解释实验所得数据。即特比萘芬MIC值≤8μg/ml为敏感,≥32μg/ml为耐药;两性霉素B MIC值≤2μg/ml为敏感,≥8μg/ml为耐药;氟胞嘧啶 MIC值≤4μg/ml为敏感,(8~16)μg/ml为临界性耐药,≥32μg/ml为耐药;氟康唑的MIC值≤8μg/ml为敏感,(16~32)μg/ml为剂量依赖性敏感,≥64μg/ml为耐药;伊曲康唑MIC值≤0.125μg/ml为敏感,(0.25~0.5)μg/ml为剂量依赖性敏感,≥1μg/ml为耐药。
6.电镜标本的制备:将特比萘芬组中浓度0.000156 μg/ml、0.00125 μg/ml、0.01 μg/ml、0.08 μg/ml及阳性对照孔中的液体分别收集到5个无菌试管中,送扫描电镜室。
三、统计学处理
应用SPSS 21.0软件用几何平均数及MIC值范围表示结果。
结 果
1.所受试菌株在37℃、培养5 d后阳性对照孔均生长良好,每次试验各质控菌株的MIC值均在参考范围内,试验有效。处理数据得出各抗真菌药物对念珠地丝菌的MIC值的几何平均数及其范围(表1)。将各组MIC值几何均数与NCCLS推荐的抗真菌药物对酵母样真菌敏感性的界定范围对比,得出念珠地丝菌对各抗真菌药物的敏感性:特比萘芬、两性霉素B、氟胞嘧啶、氟康唑均为敏感,伊曲康唑为剂量依赖性敏感。其中特比萘芬的MIC值最低。
2.扫描电镜可见,受试菌株经不同浓度特比萘芬作用5 d后,菌体均发生了改变。浓度0.000 156 μg/ml时,镜下可见菌体表面粗糙、凹凸不平;浓度0.001 25 μg/ml时,菌体变得皱瘪、粗细不匀;浓度0.01 μg/ml时,可见不规则缺损及虫蚀样孔洞;浓度0.08 μg/ml时,可见菌体彻底碎裂;阳性对照组菌体光滑饱满。见图1~5。
讨 论
近年来,随着免疫抑制剂、广谱抗生素的大量使用,导管插管、器官移植、放射治疗等广泛应用于临床,发生系统性真菌感染的概率也在不断上升,并且陆续发现一些新病种,如阿萨希毛孢子菌引起的播散性毛孢子菌病[11]、肺部奔马赭霉暗色丝孢霉病[12]等。地丝菌为酵母样真菌,是一种腐物寄生菌,自然界广泛存在,亦可为人类皮肤以及胃肠道的正常菌群,白地丝菌为地丝菌属中的经典代表菌种,最常引起侵入性及系统性感染的是头地丝菌,国内外相关研究较多。念珠地丝菌是新近发现的一种罕见地丝菌[1]。国内已有3例报道,在此菌的药物敏感性方面有待进一步探讨。
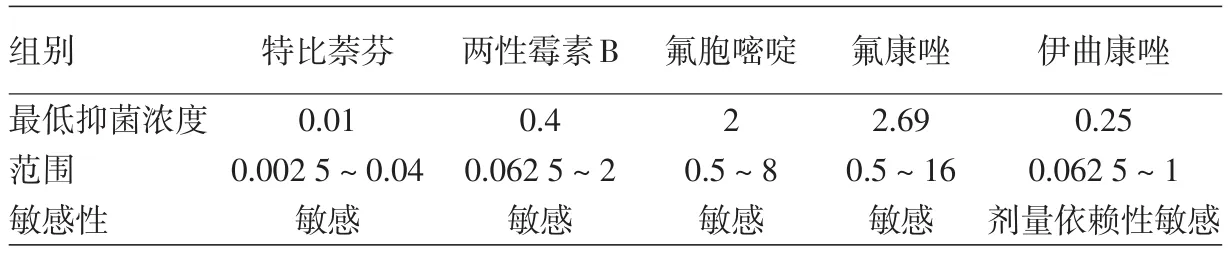
表1 5种药物最低抑菌浓度的几何均数及其范围(μg/ml)
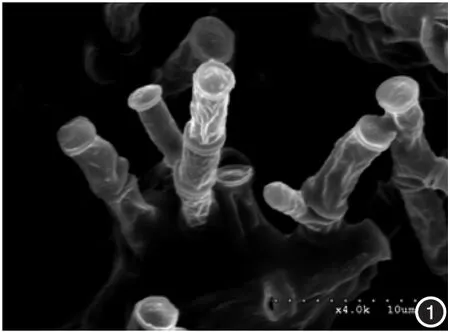
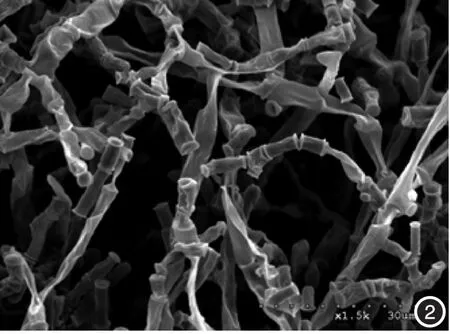



图1 0.000 156 μg/ml 特比萘芬作用5 d后,菌体表面粗糙不光滑、凹凸不平(SEM×40000) 图2 0.00125μg/ml 特比萘芬作用5 d后,菌体皱瘪、粗细不一(SEM×15 000)图3 0.01 μg/ml 特比萘芬作用5 d后,菌体可见不规则缺损和虫蚀样孔洞(SEM×40 000) 图4 0.08 μg/ml 特比萘芬作用5 d后,菌体呈碎片状(SEM×40 000) 图5阳性对照 孢子表面光滑饱满(SEM×40 000)
本文结果显示,该菌对TER、AmB、FC及FCZ均敏感,对ICZ为剂量依赖性敏感。其中特比萘芬的MIC值最低,是念珠地丝菌在体外的最敏感药物。伊曲康唑属于广谱抗真菌药,但在本实验中其敏感性最差,可能体外试验时受一定环境因素的干扰,另外也可能与试验菌株本身的敏感性有关。黄文明等[4]也曾对念珠地丝菌展开体外药物敏感试验,其研究显示氟康唑、伊曲康唑、克霉唑、两性霉素B、制霉菌素高度敏感,酮康唑、咪康唑中度敏感。益康唑、氟胞嘧啶耐药。而本次的试验菌株对特比萘芬、两性霉素B、氟康唑、氟胞嘧啶均敏感,对伊曲康唑敏感性较差。黄文明等的试验菌株与我们研究中的菌株仅有3个碱基的差异,相似率为99.4%,但二者在菌落形态、API 20c Aux生化鉴定试验及体外药敏试验上存在明显差异,黄文明等认为这是由于两者在发育过程中有性期与无性期出现的表型差异所致。因此,对于地丝菌病的治疗,临床上一方面可依据以往临床经验选择用药;另一方面若能依据致病菌株的体外药敏实验结果选择用药则疗效更确切。
特比萘芬为丙烯胺类第二代衍生物,有广谱抗真菌作用,对皮肤癣菌有杀菌作用,对白念珠菌则起抑菌作用。其主要作用于真菌细胞膜麦角甾醇合成通路,抑制麦角甾醇的生物合成,而麦角甾醇对于维持真菌细胞膜的流动性和通透性有重要作用,从而使真菌细胞膜破坏,通透性增加,内容物外泄,发挥其抗真菌作用。本研究对实验菌株经特比萘芬作用后进行了电镜观察,发现菌体出现了皱褶、孔洞和碎片等不同程度的破坏,且随着药物浓度的增高,其被破坏的程度逐渐加重,证明特比萘芬对该菌有较大的破坏作用。我科1例由念珠地丝菌所致头癣的患者,经特比萘芬治疗后痊愈,这一病例与我们的药敏试验结果一致。本文结果为临床治疗地丝菌病的抗菌药选择提供了新的依据。
[1]Pimenta RS,Alves PD,Corrêa A Jr,et al.Geotrichum silvicolasp.nov.,a novel asexual arthroconidial yeast species related to the genus Galactomyces[J].Int J Syst Evol Microbiol,2005,55(Pt 1):497⁃501.DOI:10.1099/ijs.0.63187⁃0.
[2]李秀丽,朱敬先,林元珠,等.我国首见由地霉引起的脓癣一例及实验研究[J].中华皮肤科杂志,2004,37(8):446⁃448.DOI:10.3760/j.issn:0412⁃4030.2004.08.002.Li XL,Zhu JX,Lin YZ,et al.Kerion caused byGeotrichumin china:first case report in China[J].Chin J Dermatol,2004,37(8):446⁃448.DOI:10.3760/j.issn:0412⁃4030.2004.08.002.
[3]高顺强,朱敬先,林元珠,等.中毒性表皮坏死松解症伴发林生地霉感染一例[J].中华皮肤科杂志,2006,39(11):648⁃650.DOI:10.3760/j.issn:0412⁃4030.2006.11.010.Gao SQ,Zhu JX,Lin YZ,et al.A case report of toxic epidermal necrolysis associated with geotrichosis due toGeotrichum silvicola[J].Chin J Dermatol,2006,39(11):648⁃650.DOI:10.3760/j.issn:0412⁃4030.2006.11.010.
[4]黄文明,樊翌明,白逢彦,等.从足部溃疡分离出林生地霉及其实验研究[J].中华皮肤科杂志,2006,39(8):448⁃450.DOI:10.3760/j.issn:0412⁃4030.2006.08.006.Huang WM,Fan YM,Bai FY,et al.A laboratory study ofGeotrichum silvicolaisolated from a case of foot ulcer[J].Chin J Dermatol,2006,39(8):448 ⁃450.DOI:10.3760/j.issn:0412 ⁃4030.2006.08.006.
[5]朱敬先,唐旭华,尹瑞瑞,等.林生地霉血液分离株的形态学观察[J].中国真菌学杂志,2006,1(2):81⁃84.DOI:10.3969/j.issn.1673⁃3827.2006.02.005.Zhu JX,Tang XH,Yin RR,et al.Observation on the morphology of oneGeotrichum silvicolaisolated from a patient′s blood[J].Chin J Mycol,2006,1(2):81⁃84.DOI:10.3969/j.issn.1673 ⁃3827.2006.02.005.
[6]朱敬先,张立欣,高顺强,等.林生地霉培养基形态学观察及生理学实验[J].中国真菌学杂志,2007,2(5):261⁃263.DOI:10.3969/j.issn.1673⁃3827.2007.05.002.Zhu JX,Zhang LX,Gao SQ,et al.Experiment research on the morphology and physiology ofGeotrichum silvicola[J].Chin J Mycol,2007,2(5):261 ⁃263.DOI:10.3969/j.issn.1673 ⁃3827.2007.05.002.
[7]朱敬先,朱海军,高顺强,等.林生地霉皮损分离株和血液分离株致病性的实验研究[J].中国皮肤性病学杂志,2008,22(4):204⁃206.Zhu JX,Zhu HJ,Gao SQ,et al.The experimental study of the pathogenicity ofGeotrichum silvicolaisolated from the skin lesion and blood[J].Chin J DermVenereol,2008,22(4):204⁃206.
[8]郑树茂,王华,朱敬先,等.应用RAPD技术鉴定地霉的实验研究[J].中国真菌学杂志,2010,5(4):210⁃213.DOI:10.3969/j.issn.1673⁃3827.2010.04.005.Zheng SM,WangHua,Zhu JX,et al.Identification ofGeotrichumby RAPD[J].Chin J Mycol,2010,5(4):210⁃213.DOI:10.3969/j.issn.1673⁃3827.2010.04.005.
[9]朱敬先,王华,郑树茂,等.任意引物聚合酶链反应对致病性地霉株间分型的鉴定[J].中国皮肤性病学杂志,2010,24(8):724⁃726.Zhu JX,Wang H,Zheng SM,et al.Genotyping of the different pathogenicGeotrichumstrains using arbitrarily primed polymerase chain reaction[J].Chin J Derm Venereol,2010,24(8):724⁃726.
[10]王文莉,郑玮清,李若瑜,等.采用NCCLS M27⁃A方案微量法检测念珠菌对抗真菌药物的敏感性[J].中华检验医学杂志,2001,24(2):107⁃108.DOI:10.3760/j:issn:1009⁃9158.2001.02.015.Wang WL,Zheng WQ,Li RY,et al.Susceptibility test of antifungal agents againstCandidaby using the method of NCCLS M27 ⁃A[J].Chin J Lab Med,2001,24(2):107 ⁃108.DOI:10.3760/j:issn:1009⁃9158.2001.02.015.
[11]杨蓉娅,敖俊红,王文岭,等.阿萨希丝孢酵母引起播散性毛孢子菌病国内首例报告[J].中华皮肤科杂志,2001,34(5):329⁃332.DOI:10.3760/j.issn:0412⁃4030.2001.05.001.Yang RY,Ao JH,Wang WL,et al.Disseminated trichosporonosis:the first case report in China[J].Chin J Dermatol,2001,34(5):329⁃332.DOI:10.3760/j.issn:0412⁃4030.2001.05.001.
[12]赵俊英,王增芳,李若瑜,等.天疱疮合并肺部奔马赭霉暗色丝孢霉病一例的诊断及治疗[J].中华医学杂志,2002,82(19):1310⁃1313.Zhao JY,Wang ZF,Li RY,et al.Pemphigus patient with pulmonary fungal infection caused byOchroconis gallopava:the first case report in China[J].Natl Med J China,2002,82(19):1310⁃1313.
In vitrosusceptibility ofGeotrichum silvicolato five antifungal agents and electron microscopic observation of terbinafine⁃treatedGeotrichum silvicola
Wu Lining,Li Chen,Wang Dan,Cao Binglan,Zhu Jingxian
Department of Dermatology,Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China(Wu LN,Zhu JX);Department of Infectious Diseases,Fifth Hospital of Shijiazhuang,Shijiazhuang 050021,China(Li C);Department of Dermatology,Affiliated Hospital of Chengde Medical University,Chengde 067000,Hebei,China(Wang D);Department of Dermatology,Yuanshi County Hospital of Traditional Chinese Medicine,Shijiazhuang 051130,China(Cao BL)
ObjectiveTo evaluatein vitroantifungal activities of five clinically common antifungal agents againstGeotrichum silvicola,and to observe morphological changes ofGeotrichum silvicolaafter treatment with terbinafine.MethodsFive antifungal agents commonly used in clinic,including terbinafine(TER),amphotericin B(AmB),flucytosine(FC),fluconazol(FCZ)and itraconazole(ICZ),were tested in this study.According to the National Committee for Clinical Laboratory Standards(NCCLS)M27⁃A2 document and relevant literatures,a susceptibility test was performed to determine the minimal inhibitory concentration(MIC)values of the five antifungal agents againstGeotrichum silvicola.Scanning electron microscopy(SEM)was used to observe morphological changes ofGeotrichum silvicolatreated with different concentrations of TER.ResultsThe MIC values againstGeotrichum silvicolawere as follows:TER,0.01 μg/ml;AmB,0.4 μg/ml;FC,2 μg/ml;FCZ,2.69 μg/ml;ICZ,0.25 μg/ml.Geotrichum silvicolawas sensitive to TER,AmB,FC and FCZ,and sensitive to ICZ in a dose⁃dependent manner.SEM revealed that after TER treatment,the surface ofGeotrichum silvicolabecame rough and shrinking with irregular defects and holes,and even gave a fragment⁃like appearance.Conclusions Among the five tested antifungal agents,TER shows the strongest activity againstGeotrichum silvicola.Within a certain range,the higher the concentration of TER,the more serious the damage toGeotrichum silvicola.
Geotrichum;Candida;In vitro;Microbial sensitivity tests;Microscopy,electron,scanning;Geotrichum silvicola
Zhu Jingxian,Email:zhujingxian@medmail.com.cn
2015⁃12⁃01)
(本文编辑:吴晓初)
朱敬先,Email:zhujingxian@medmail.com.cn
10.3760/cma.j.issn.0412⁃4030.2016.09.005

