冻融对面筋蛋白结构及面粉粉质特性的影响
赵 雷, 胡卓炎, 刘国琴, 李 冰,3, 李 琳,3,*
(1.华南农业大学食品学院,广州 510642; 2.华南理工大学轻工与食品学院,广州 510640; 3.广东省天然产物绿色加工与产品安全重点实验室,广州 510640)
冻融对面筋蛋白结构及面粉粉质特性的影响
赵雷1, 胡卓炎1, 刘国琴2, 李冰2,3, 李琳2,3,*
(1.华南农业大学食品学院,广州 510642; 2.华南理工大学轻工与食品学院,广州 510640; 3.广东省天然产物绿色加工与产品安全重点实验室,广州 510640)
探讨冻融(以10 d作为一个冻融周期,在每个冻融周期的第5天,将冷冻在-18 ℃的样品升温至0 ℃,并在此温度下保持12 h后降温至-18 ℃继续冻融)对小麦面筋蛋白分子结构、自由氨基、自由巯基及粉质特性的影响.研究发现,随着冻融时间的延长,I(0)值(散射角度为0时散射强度)呈现下降趋势,尤其是冻融前60 d,I(0)由原样品的2.75×105下降到1.75×105,说明面筋蛋白的相对分子质量随着冻融时间的延长而降低.在冻融过程中自由氨基含量没有变化,而自由巯基含量上升,表明面筋蛋白相对分子质量下降的原因是由于二硫键断裂使得高聚物发生了解聚现象.添加冻融后面筋蛋白的粉质特性高于未添加的样品,而相对分子质量的下降对面粉粉质特性的影响表现在稳定时间和衰减时间上,而随着冻融时间延长其粉质特性呈现下降趋势,且与面筋蛋白的平均相对分子质量呈正相关.
冻融; 面筋蛋白; 相对分子质量; 粉质特征
近年来,随着冷冻面制品的发展,逐渐出现一些行业共性问题:冻融过程中面团的流变性能与网络的强度随时间的延长发生下降,导致产品的质构特性下降[1-3].冷冻面团的品质很大程度上取决于面筋蛋白的特性,在面包焙烤中,面包的体积和延伸性能与面筋蛋白中高分子亚基(HWM-GS)的含量成正相关[4-5];在加工面团时,面团的质构特性取决于其所含的面筋蛋白相对分子质量的大小及其分布[6-7].因此,探讨冻融过程中面筋蛋白分子的结构对于研究冻融后产品品质的变化有重要意义.
对于小麦制品,可通过测定面团的流变学特性来表征其加工特性品质.采用微量掺粉实验用以探讨蛋白质和食品胶等添加物对加工品流变学特性的影响,面团所具有的耐揉和特性可以通过其形成时间、稳定时间、带宽和弱化度等用以表征[8-9].而小角X射线散射(SAXS)在研究高分子结构领域运用的范围十分宽广.通过对散射图或散射曲线的计算和分析可以推导相对分子质量的大小、微观结构的形状、分布及分子链的构象等[10-11].
因此,将面筋蛋白置于冻融的环境中,模拟产品在加工运输过程中不可避免产生的温度波动,拟采用SAXS表征面筋蛋白分子结构的变化,并利用微量掺粉实验探讨冻融后面筋蛋白对面团粉质特性的影响.在研究面团流变特性规律的基础上,探讨冻融后面筋蛋白的添加对面团流变学特性的影响机理,进而为冷冻后面制品品质的研究提供理论依据.
1 研究方法
1.1实验材料
材料与试剂:高筋粉、中筋粉,广州南方面粉厂提供(加拿大硬红冬麦);牛血清白蛋白(BSA),美国Sigma公司;氯化钠、碘化钾、乙酸、乙二酸四乙酸四钠、十二烷基硫酸钠(SDS)、二硫二硝基苯甲酸等均为国产的分析纯.
1.2面筋蛋白的提取及冻融实验
采用面筋洗涤仪(JJJM54S,上海嘉定粮油)进行高筋粉的和面与面筋蛋白的洗涤.分别采用质量分数5%的氯化钠溶液洗除球蛋白与淀粉,蒸馏水洗除清蛋白和剩余的氯化钠.用碘-碘化钾溶液确定淀粉是否被去除完全.将洗涤后的样品在60 000 r/min离心10 min.最终样品的水分为(60±1)%.
将离心后的样品放置于-80 ℃的冰箱中速冻4 h,速冻后铝盒封存,在温度为(-18±1)℃的冰箱中冻融,以10 d作为一个冻融的周期,其中包括在冻融第5 天时,将样品升温至0℃,保持12 h,后继续降温至-18 ℃为一个周期.在一个完整的冻融周期后,第0、30、60、90和120 天分别取样.将取出的样品立即冷冻干燥,粉碎,过筛后在干燥皿中保存.
1.3面筋蛋白溶液的制备
取0.5 g样品溶于50 mL 500 mmol/L乙酸溶液中,磁力搅拌24 h.将溶解后的样品超声处理15 s,12 500 r/min离心30 min,取其上清液测定其中蛋白质的含量,稀释至8 g/L待测.
1.4SAXS测定方法
将样品放置于光源X射线散射站测试.X射线发射器包含了X射线管(PANalytical),其电子能量为40 kV,平均电子束强度为50 mA.单一的原始光源(Cu-Kα),入射X射线的波长为λ=0.154 2 nm.样品置于真空半透明毛细管状的样品器中,温度控制26.0 ℃,样品到成像板的距离为261.2 nm,测定时间为30 min.利用SAXS 数据分析软件(Perkin Elmer, USA),将初始散射曲线转换为相应的散射强度q(q= 4πsinθ/λ, 2θ为散射角)与散射矢量的关系曲线I(q).所有的散射数据都经过扣除背景、归一化处理.
1.5自由巯基含量(SH)的测定方法
1 mL(质量浓度为3 g/L)蛋白溶液与1.0 mL pH6.5、0.05 mol/L磷酸钠缓冲液混合后,加入100 μL的二硫二硝基苯甲酸(DTNB),静置45 min,在412 nm测定吸光值.以谷胱甘肽(0~0.10 μmol)为校正曲线计算得到自由巯基含量[12].其中磷酸钠缓冲液含有体积分数2.0%SDS、3.0 mol/L尿素、1.0 mmol/L 乙二酸四乙酸四钠.
1.6微量掺粉测定方法
微量掺粉采用Micro-dough LAB粉质仪,在中筋粉中加入4%质量分数的面筋蛋白,空白对照组为添加了对照品的面筋蛋白.在掺粉实验中添加63.5%(质量分数)的水,混合时间和揉混时间分别设定为2 min和15 min.从粉质曲线上得到样品的形成时间、稳定时间、弱化度等参数.每组实验重复3次,取其均值.
1.7数据处理
取3次重复实验的均值,采用SPSS16.0软件进行Duncan′s新复极差检验(P<0.05),评价样品平均值之间的差异显著性,采用OriginPro8.0作图.
2 结果与讨论
2.1冻融过程中面筋蛋白相对分子质量的变化
冻融后面筋蛋白在不同冻融时间下会有不同的散射曲线(图1).面筋蛋白溶液质量浓度为8 g/L,q和I分别代表散射矢量和强度.从图1可以明显的看出,当散射强度q值在0.09~0.10 nm-1附近时,面筋蛋白溶液散射曲线中都出现了一个较为尖锐的峰(图中虚线方框内所示).根据高分子稀溶液理论,选取一种良溶剂,在较低质量浓度下,高分子的分子链充分伸展,可以忽略溶剂对分子链以及分子链间相互作用的影响.因此,采用500 mmol/L乙酸溶液,在蛋白质质量浓度为8 g/L的状态下,其在低q区域区域内出现了尖锐的峰值,说明此溶剂为良溶剂,可以忽略其对蛋白溶液中分子链的影响及分子链间的相互作用,在此溶液中计算出的蛋白质的结构更加具有客观真实性[13-15].
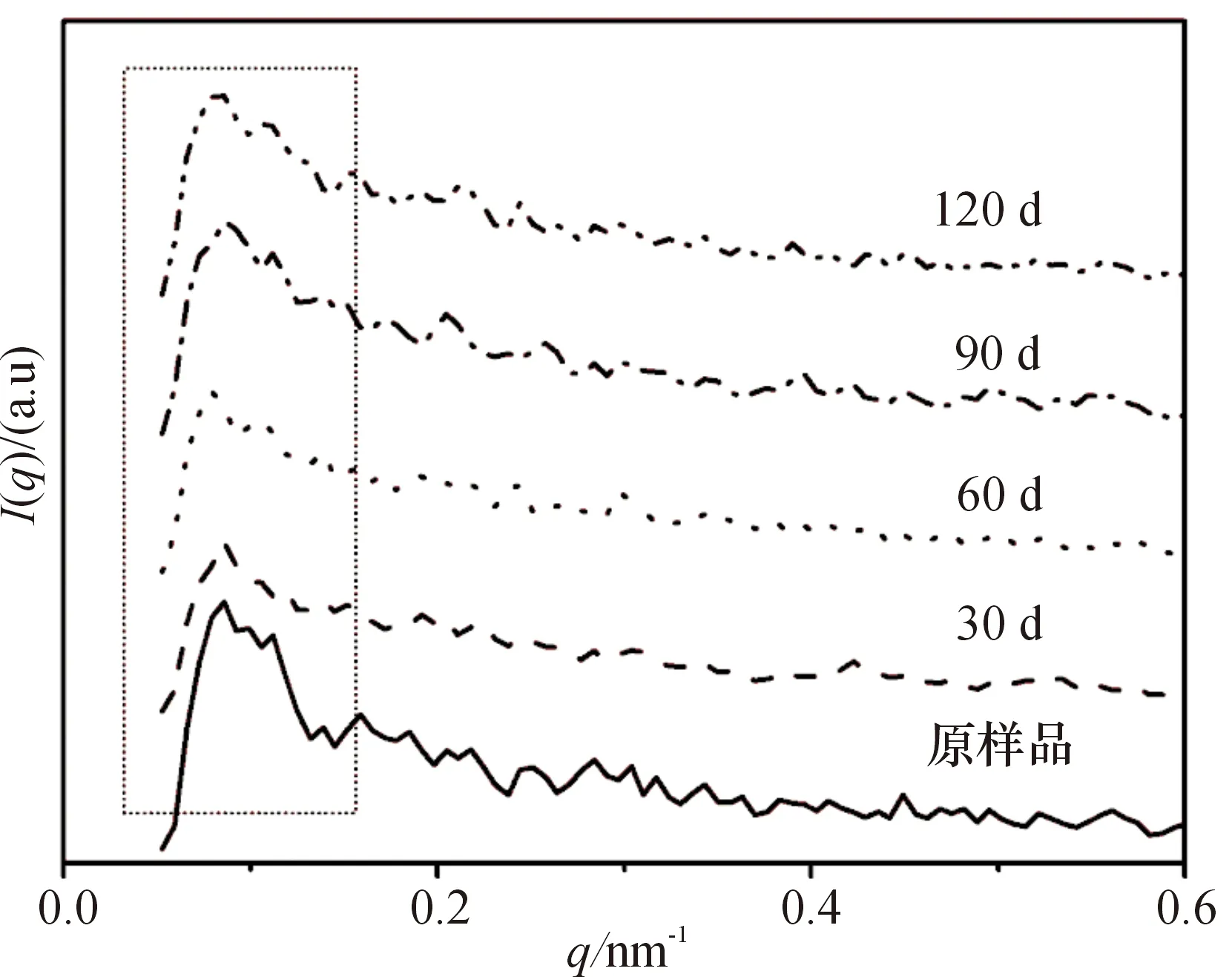
图1 冻融时间对面筋蛋散射曲线的影响
Figure 1Effect of frozen-thaw cyclic storage time on the scattering curve of gluten


图2 冻融后面筋蛋白的Guinier散射曲线
Figure 2Guinier plots of scattering curves of gluten from different frozen-thaw cyclic storage time
根据I(0)的公式计算得到不同冻融时间后面筋蛋白溶液的I(0)(图3).其中I(0)值随着冻融时间的增加而呈现明显的下降趋势,说明在冻融过程中,蛋白质的平均相对分子质量随着冻融时间的延长而下降.在前60 d的冻融过程中,I(0)下降的速度相对较快,由原样品的2.75×105下降到30 d后的2.0×105,而60 d之后只有1.75×105,说明在冻融条件下较短的贮藏时间对面筋蛋白的相对分子质量的影响较大;当继续延长冻融时间,发现其I(0)值没有明显的变化.主要原因为冻融过程中温度波动显著(-18 ℃上升至0 ℃后继续降低到-18 ℃),穿越了最大冰晶体的生成区,更容易重结晶现象.而在此过程中产生了大量水分的迁移,对蛋白造成物理损伤,导致面筋蛋白网络结构出现一定数量的无规则孔洞,这种机械作用造成了面筋蛋白结构的变化[18],在图3中表现为面筋蛋白相对分子质量的下降.众所周知,面筋蛋白是自然界发现的相对分子质量最大的蛋白质[3],其分布较宽,而I(0)值表征的是其平均相对分子质量,而冻融对于面筋蛋白相对相对分子质量分布的影响还需进一步的研究.
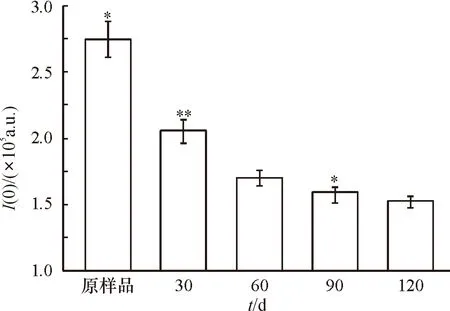
图3 冻融时间对面筋蛋白溶液I(0)的影响
Figure 3Effect of the frozen-thaw cyclic storage on theI(0) of the gluten solution
2.2冻融过程中面筋蛋白自由氨基含量的变化
SAXS实验发现面筋蛋白平均相对分子质量在冻融过程中下降明显,分析其主要原因:首先有可能是肽键的断裂,其次也可能是二硫键的断裂.研究发现水洗后的面筋蛋白中含有一定量具有活性的蛋白水解酶类(Azocaseinase与Haemoglobinase),研究[19]表明,一般实验室采用NaCl(0.1 mol/L)溶液和水制备的面筋蛋白,其含有一定量的蛋白水解酶,且活性可以达到原面粉中的90%以上.为了避免蛋白水解酶对冻融过程中面筋蛋白相对分子量变化的影响,在样品制备及转移过程中采用冰浴,保持温度不超过5 ℃,并测定其自由氨基的变化,观察是否存在蛋白水解酶的作用.为排除活性蛋白水解酶对本实验的影响,在样品的溶解和前处理过程中,维持环境的低温状态(低于5 ℃).图4可见,未经冻融前样品中自由氨基为51.25 mmol/L,经过冻融后,其自由氨基含量几乎没有变化(P>0.05).表明,在低温状态抑制蛋白水解酶的活性,消除了蛋白酶的水解导致肽链的断裂.因此,面筋蛋白相对分子量的下降主要是由于面筋蛋白在冻融过程中温度的波动造成的.
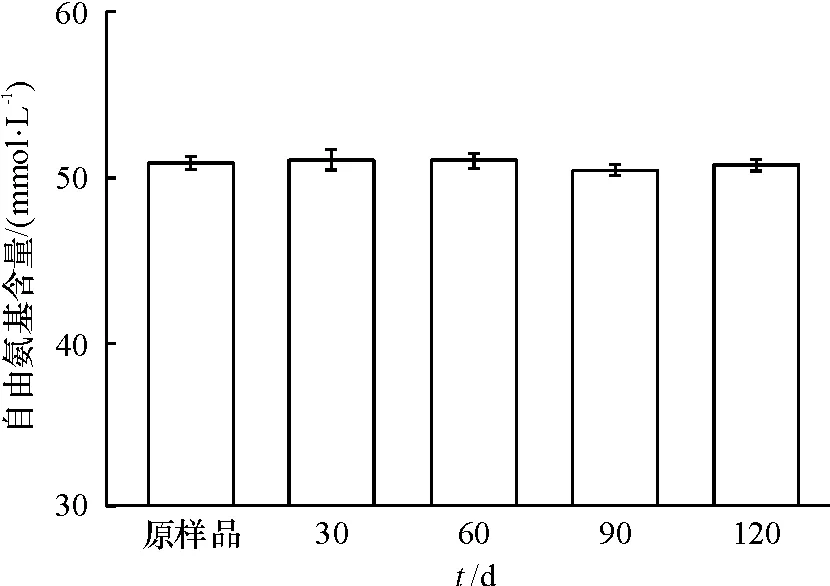
图4 冻融后面筋蛋白自由氨基含量的变化
Figure 4Effect of frozen-thaw cyclic storage time on the free amino groups content of the gluten
2.3冻融对面筋蛋白自由SH含量的影响
面筋蛋白自由SH含量随着冻融时间的变化而变化(图5).随着冻融时间的延长,自由SH的含量在呈现上次的趋势.在前60天的冻融过程中,自由SH的含量明显增加,原样品中自由SH含量为9.8 μmol/L,冻融30 d后,自由SH含量上升至11.2 μmol/L (P<0.05),当冻融达到60天时,自由SH增大至12.7 μmol/L(P<0.05);而继续延长冻融时间,自由SH含量也会上升,但是上升速率相对较慢,冻融90 d时,自由SH含量为13.3 μmol/L,而冻融120 d的面筋蛋白所含SH含量与90d相近,13.8 μmol/L.结合图3可以发现,在冻融30 d和60 d后,面筋蛋白平均相对分子质量与原面筋蛋白相比都有明显的下降,表明在冻融过程中,相对较短时间(60 d)内产生大量的重结晶现象,这种物理作用破坏分子间二硫键,使体系中自由SH含量的上升,造成了分子部分解聚,相对分子质量下降.而当冻融时间达到90 d和120 d时,发现面筋蛋白相对分子质量很接近,但是自由SH含量却会继续上升,表明这部分自由SH含量主要来自于分子内二硫键断裂,而分子内二硫键断裂不会导致分子解聚,因此,在冻融后期(90 d到120 d)SH含量升高,但是其相对分子质量减少并不明显.

图5 冻融后面筋蛋白SH含量的变化
Figure 5Effect of frozen-thaw cyclic storage time on the SH content of the gluten
研究[21]发现,在面团揉混的过程中,所含的面筋蛋白大聚合体也会发生二硫键的断裂,尤其是一些由较弱的麦谷蛋白亚基聚合而成的,在揉混的物理作用下分解成低聚物和二聚物.同时也有报道显示,具有低分子质量的谷蛋白亚基(B型)和高分子量的亚基在较强物理作用下都有可能会发生明显的解聚现象[21-23].因此在冻融过程中,剧烈的温度波动发生大量水分迁移和重结晶,产生巨大的物理机械作用使得面筋蛋白承受了激烈的物理挤压,导致蛋白分子之间发生相互作用,使蛋白质的结构发生改变,尤其是对于一些电子云密度分布不均匀的二硫键产生影响,从而导致其键合作用发生弱化;同时在冻融过程中存在着氧气与样品接触,从而使其二硫键氧化,最终使部分二硫键发生断裂,其中分子间二硫键断裂致使面筋蛋白平均相对分子量下降.这与面团揉混过程中二硫键断裂的机理类似.2.4添加冻融的面筋蛋白后面粉粉质特性的变化
添加不同的面筋蛋白会对面粉粉质特性有所影响,由表1可见,将不同冻融时间后的面筋蛋白掺入中筋粉中进行粉质实验,提升了面粉中蛋白质含量,对于面团的空间结构发生了重要的转变,其主要参数发生了显著变化.首先,当中筋粉中添加对照样品的面筋蛋白(无处理原蛋白)后,与无任何添加的面粉相比,形成时间、稳定时间和衰减时间均发生了一定的延长,形成时间从0.6 min增长至1.0 min,其中稳定时间和衰减时间延长较为显著,分别从3.1 min和3.0 min增长至12.8 min与13.4 min.在揉混过程中,粉质的形成时间主要与形成网络结构的面筋蛋白的含量有关.而与无添加物的样品相比,添加对照样品后中面筋蛋白的含量相对增加,但增加量不超过4%,表明形成时间延长并不明显.而在揉混过程中稳定时间和衰减时间不仅与添加的面筋蛋白的含量有关,而且与其结构亦有密切的关联.在本实验中面筋蛋白来自于加拿大硬红麦粉,其功能特性相对较好,能够形成紧密的网络结构,将其添加到面粉中后,在揉混过程中,有助于形成相对稳定和均匀的网络结构,增强其对淀粉、水分和CO2的束缚能力,增强其流变学性质,使面团可以承受较大的机械作用.同时发现其弱化度从100 BU下降至30 BU,带宽从55 BU增长至80 BU,进一步说明其改善了面团流变学的性质,从而增强其机械强度.换言之,对照样面筋蛋白的添加可以显著提高粉质的特性.
在中筋粉中添加冻融后的面筋蛋白,粉质特性发生显著的变化.与对照样相比,粉质特性都有一定程度的下降,但是却要高于无添加的样品.随着添加物面筋蛋白冻融时间的延长,其面粉的粉质特性呈现下降的趋势(表1).这说明,面筋蛋白的加入,增强了面团中网络结构,从而提升面团的流变学性质与机械性能.但是随着添加的面筋蛋白冻融时间的延长,其面团的粉质特性也发生下降,根据上文的研究结果,面筋蛋白二硫键和平均相对分子质量都随着冻融时间的延长而下降,而二硫键和相对分子质量对面筋蛋白的网络结构的形成起到十分重要的作用,其随冻融时间下降而导致面筋蛋白结构的弱化,从而引起其粉质特性的下降.综上所述,添加物面筋蛋白是主导受体面粉的粉质特性的主要因素,而其自身的结构与功能特性与粉质的特性关联密切,粉质的特性与其所含面筋蛋白相对分子质量大小及分子内二硫键的数目成正相关.此外,如表1所示,随着添加物面筋蛋白冻融时间的延长,其粉质的弱化度与单宽分别呈现上升和降低的趋势,同样显示了面团的流变学性质与机械性能受到冻融后面筋蛋白的影响,与稳定时间和衰减时间的结果相一致.

表1 添加冻融的面筋蛋白后对面粉粉质特性的影响
注:同列中不同上标字母显示显著性(P<0.05).
3 结论
当面筋蛋白溶解在500 mmol/L的乙酸溶液中质量浓度为8 g/L时,蛋白质在溶液中完全伸展,符合高分子溶液理论.面筋的平均相对分子质量随着冻融时间的延长呈现下降趋势.冻融后面筋蛋白中自由氨基含量几乎没有变化,而自由巯基含量上升,冻融过程中分子间二硫键的断裂导致面筋蛋白相对分子量下降.将冻融前及冻融后的面筋蛋白添加于中筋粉后,可以明显地改善面团的流变学性质.但是,面团的流变学特性随着添加物面筋蛋白冻融时间的延长而下降,添加物面筋蛋白主导了受体面粉的粉质特性.同样,添加物面筋蛋白的平均相对分子质量、分子间二硫键的数量与粉质特性成正相关.
[1]WANG Q, LI Y, SUN F, et al. Tannins improve dough mixing properties through affecting physicochemical and structural properties of wheat gluten proteins[J]. Food Research International, 2015, 69: 64-71.
[2]AHMED J. Effect of barley β-glucan concentrate on oscillatory and creep behavior of composite wheat flour dough[J]. Journal of Food Engineering, 2015, 152: 85-94.
[3]ZHAO L, LI L, LIU G Q, et al. Effect of freeze-thaw cycles on the molecular weight and size distribution of gluten[J]. Food Research International, 2013, 53(1): 409-416.
[4]DON C, MANN G, BEKES F, et al. HMW-GS affect the properties of glutenin particles in GMP and thus flour qua-lity[J]. Journal of Cereal Science, 2006, 44: 127-136. [5]TOSI P, GRITSCH C S, HE J, et al. Distribution of gluten proteins in bread wheat (Triticumaestivum) grain[J]. Annals of Botany, 2011, 108(1):23-35.
[6]SINGH H, MACRITHCIE F. Application of polymer Science to properties of gluten[J]. Jourmal of Cereal Science, 2001, 33(3):231-243.
[7]刘丽, 杨金花, 胡银星,等. 麦谷蛋白亚基与小麦品质的关系研究进展[J]. 中国农业科技导报, 2012, 14(1):33-42.
LIU L, YANG J H, HU Y X, et al. Research progressin effectsof glutenin subunitson wheat processing quality[J]. Journal of Agricultural Science and Technology, 2012,14(1):33-42.
[8]李敏, 高翔, 陈其皎, 等. 普通小麦中α-醇溶蛋白基因(GQ891685)的克隆、表达及品质效应鉴定[J]. 中国农业科学, 2010, 43(23): 4765-4774.
LI M, GAO X, CHEN Q J, et al. Cloning, prokaryotic expression and in vitro functional analysisof α-gliadin gene from common wheat[J]. Scientia Agricultura Sinica, 2010, 43(23): 4765-4774.
[9]王明霞, 高翔, 陈其皎, 等.小麦品种陕253γ-醇溶蛋白基因的克隆、原核表达与功能鉴定[J]. 作物学报, 2011, 37 (1): 79-86.
WANG M X, GAO X, CHEN Q J, et al. Cloning, prokaryotic expression, and functional testing of a γ-gliadin gene from wheat cultivar shaan 253[J]. Acta Agronomica Sinica, 2011, 37(1): 79-86.
[10]WATANABE Y, INOKO Y. Size-exclusion chromatography combined with small-angle X-ray scattering optics[J]. Journal of Chromatography A, 2009, 1216 (44): 7461-7465.
[11]ROBILLARD G T, DIJK A A V, BOEF E, et al. Size and shape of the repetitive domain of high molecular weight wheat gluten proteins: I: small-angle neutron scattering[J]. Biopolymers, 2003, 69: 311-324.
[12]赵雷. 冻藏对面筋蛋白分子量、链结构及聚集态影响的研究[D]. 广州: 华南理工大学, 2012.29.
ZHAO L.Study on effect frozen stroage on molecular weight and distriution chain conformatuin and aggregated state structure of gluten[D]. Guangzhou: South China University of Technology, 2012,29.
[13]HIRAI M, ARAI S, TAKIZAWA T, et al. Dynamics and phase behavior of a supermacromolecular suspension under a magnetic field studied by time-resolved x-ray scattering[J]. Physical Review B, 1997, 55(6): 3490.
[14]HIRAI M, NIIMURA N, ZAMA M, et al. Interparticle interactions and structural changes of nucleosome core particles in low-salt solution[J]. Biochemistry, 1988, 27 (20): 7924-7931.
[15]赵雷, 汪星星, 胡卓炎,等. 小角X-射线法解析恒温冻藏过程对面筋蛋白分子链结构的影响[J]. 现代食品科技,2016, 32(1):95-99.
ZHAO L, WANG X X, HU Z Y, et al. Effect of frozen storage at constant temperature on the molecular chain structure of hydrated gluten by Small-angle X-ray Scatte-ring (SAXS)[J]. Modern Food Science and Technology, 2016, 32(1):95-99.
[16]KATAOKA M, HEAD J F, SEATON B A, et al. Melittin binding causes a large calcium-dependent conformational change in calmodulin[J]. Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(18): 6944-6948.
[17]WATANABE Y, INOKE Y. Size-exclusion chromatography combined with small-angle X-ray scattering optics[J]. Journal of Chromatography A, 2009, 1216(44): 7461-7465.
[18]ZOUNIS S, QUAIL K, WOOTTON M, et al. Studying frozen dough structure using low-temperature scanning electron microscopy[J]. Journal of Cereal Science, 2002, 35(2): 135-147.
[19]WADHAWAN C K. Fundamental studies on vitality of gluten for breadmaking[D]. Winnipeg: University of Manitoba, 1988.
[20]REDMAN D. Softening of gluten by wheat proteases[J]. Journal of the Science of Food and Agriculture, 1971, 22(2): 75-78.
[21]WEEGLES P, VANDE PIJPEKAMP A, GRAVELAND A, et al. Depolymerisation and re-polymerisation of wheat glutenin during dough processing: I: relationships between glutenin macropolymer content and quality parameters[J]. Journal of Cereal Science, 1996, 23(2): 103-111.
[22]WEEGELS P, HAMER R, SCHOFIELD J. Depolymerisation and re-polymerisation of wheat glutenin during dough processing: II: changes in composition[J]. Journal of Cereal Science, 1997, 25(2): 155-163.
[23]LINDSAY M P, SKERRITT J H. The glutenin macropolymer of wheat flour doughs: structure-function perspectives[J]. Trends in Food Science & Technology, 1999, 10(8): 247-253.
【中文责编:成文英文责编:李海航】
Effects of Frozen-Thaw Cyclic Storage on the Molecular Structure ofHydrated Gluten and Farinograph Properties of the Dough
ZHAO Lei1, HU Zhuoyan1, LIU Guoqin2, LI Bing2,3, LI Lin2,3*
(1. College of Food Science, South China Agricultural University, Guangzhou 510642, China; 2. College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510641, China; 3. Guangdong Province Key Laboratory for Green Processing of Natural Products and Product, Guangzhou 510640, China)
In this study, the effects of frozen-thaw cycles (frozen at -18 ℃ with cycling to 0 ℃ for 12 h and then back to -18 ℃ per 10 days) on molecular structure, free amino groups content, free sulfhydryl groups and farinograph properties of gluten were studied by small-angle X-ray scattering (SAXS) and Micro-dough LAB mixer. The results showed that during the frozen-thaw cycles theI(0) of gluten proteins decreased with the increase in freeze-thaw cycles, especially in the first 60 days storage, the value ofI(0) (the scattered intensity implies at zero angle) decreased from 2.75×105for control to 1.75×105for the gluten stored for 60 days, which implies relative molecular mass dropping. The free amino group content changed only slightly, and the free sulphydryl group content increased, indicating that the depolymerisation of the gluten during freeze-thaw cycling was due to the breakage of disulphide bonds. The farinograph properties of the dough added gluten which after the storage was higher than the one without gluten. The farinograph properties of dough deteriorated with added the frozen stored gluten, especially in the stability time and development time, which related to the relative molecular mass of the additive of the gluten. This suggests that the relative molecular mass and the molecular chain were the decisive factors influencing the quality of the dough for frozen storage.
frozen-thaw cycles storage; gluten; relative molecular mass; farinograph properties
2015-12-15 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(31301412、31130042);国家科技支撑计划项目(2012BAD37B01); 广东省自然科学基金项目(S2013040014403); 广东省科技计划项目(2015A020209143)
李琳,教授,Email: felinli@scut.edu.cn.
TS213
A
1000-5463(2016)03-0122-06

