131I治疗后分化型甲状腺癌患者近期外周血中中性粒细胞、淋巴细胞的动态表达
范贤东,廖梓宏,王安波
(四川省内江市第一人民医院核医学科,四川内江641000)
131I治疗后分化型甲状腺癌患者近期外周血中中性粒细胞、淋巴细胞的动态表达
范贤东,廖梓宏,王安波
(四川省内江市第一人民医院核医学科,四川内江641000)
目的 分析分化型甲状腺癌(DTC)患者接受131I治疗后近期外周血中白细胞(WBC)、中性粒细胞(Neu)、淋巴细胞(LY)的动态表达情况。方法 前瞻性分析86例在我院就诊的DTC患者的临床资料,按照接受131I治疗剂量分为:大剂量组(共38例,累积放射剂量3.60~5.50GBq)和小剂量组(共48例,累积放射剂量1.11~1.50 GBq)。于治疗前、治疗后第3天、第7天、第14天、第30天及第60天分别检测并比较两组患者的外周血WBC、Neu及LY差异,并分析外周血WBC、Neu及LY水平动态变化过程。结果 治疗后第3天至第30天,小剂量组外周血WBC、Neu及LY水平显著高于大剂量组(均P<0.05),而自治疗后第60天两组外周血WBC、Neu及LY水平差异无统计学意义(均P>0.05)。大剂量组患者外周血WBC、Neu及LY水平在治疗第3天降至最低,后随时间延长而增加(均P<0.05),但仍较治疗前水平低(均P<0.05)。小剂量组患者外周血LY水平在治疗第7天将至最低,后随时间延长而增加(均P<0.05),在治疗第60天与治疗前水平无差异(P>0.05);而外周血WBC及Neu在治疗第3天升高,后随时间延长而降低(均P<0.05),在治疗第30天与治疗前水平无差异(P>0.05)。结论 小剂量131I放射治疗DTC患者的近期外周血Neu及LY动态影响更小,应在临床实际予以选择。
分化型甲状腺癌;131I; 放射治疗; 白细胞; 中性粒细胞; 淋巴细胞
分化型甲状腺癌(differentiated thyroid cancer,DTC)是甲状腺癌最常见病理类型,约占80%~90%[1]。DTC临床治疗方法主要为先行手术切除,术后再选择性131I放射治疗。临床实践显示,大多数患者对131I放射治疗耐受性良好,但也有部分患者发生不良反应,最为严重的不良反应为骨髓抑制,表现为外周血白细胞或其某系白细胞减少[2]。因此临床上对于DTC患者接受选择性131I放射治疗的剂量存在争议,争议焦点在于放射剂量对DTC患者外周血白细胞(white blood cell,WBC)、中性粒细胞(neutrophils,Neu)、淋巴细胞(lymphocytes,LY)造成的影响程度[3]。为此本研究前瞻性分析我院DTC患者接受不同剂量的131I放射治疗后近期外周血Neu及LY的动态变化情况,为临床治疗提供循证依据。
资料与方法
1 研究对象
选取2014年1月至2015年6月我院就诊的DTC患者86例作为研究对象进行前瞻性分析,其中男38例,女48例,平均年龄56.8±8.3岁,均签署知情同意书,所有患者均接受双叶甲状腺全切或近全切及颈淋巴结清扫术。入选标准:①术后病理均确诊为DTC;②均未服或停服甲状腺素,且维持低碘饮食至少3周;③甲状腺原发癌肿灶直径超过4cm、甲状腺外存在明显侵犯、淋巴结转移灶不能手术切除或术后发生远处转移;④无明确影响白细胞等血液系统疾病。排除标准:①存在与造血系统相关疾病,或近期服用影响血液系统的药物;②存在有严重的肺、肝、肾等重要器官功能不全;③妊娠及哺乳期的患者。
2 分组
患者每次131I放射治疗的剂量为1.20~1.50 GBq,根据接受131I放射治疗累积剂量分为两组,分别为:大剂量组,共38例,累积放射剂量3.60~5.50GBq,其中男17例,女21例,平均年龄53.9±7.6岁;小剂量组,共48例,累积放射量1.11~ 1.50GBq,其中男21例,女27例,平均年龄59.0±8.6岁。两组患者在年龄、性别比、体质量指数及既往内科疾病史等临床因素差异无统计学意义(P>0.05)。
3131I放射治疗
两组患者在131I放射治疗前3个月,禁止食用含碘的食物和药物,停服甲状腺素片3周,在外周血促甲状腺素(TSH)水平升至至少30IU/L后开始予以空腹口服Na131I(购自北京原子高科股份有限公司)治疗。每个患者具体治疗剂量主要根据美国甲状腺协会(American Thyroid Association,ATA)指南[4]及《甲状腺结节和分化型甲状腺癌诊治指南》[5]的建议,同时结合患者病理TNM分期以及复发危险分层等病情予以综合评估确定。患者131I放射治疗后住院观察1周,治疗后第3天晨起开始口服左旋甲状腺素,嘱患者大量饮水以促进131I排泄,同时予以维生素C、胃肠动力药、保肝等对症治疗。
4 外周血WBC、Neu及LY检测
本研究采用全自动血液分析仪(型号为:Sysmex XK-21,购自日本Sysmex公司)分别检测患者治疗前、治疗后第3天、第7天、第14天、第30天及第60天患者的外周血中WBC、Neu及LY数目。本实验室正常参考范围为:WBC(4~10)×109/L;Neu(2.0~7.5)×109/L;LY(0.8~4.0)×109/L。
5 统计学处理
使用SPSS 17.0软件进行统计检验,计量资料数值以x±s表示,两组间数据比较采取成组t检验方式进行检验。各个时间节点数据比较采用ANOVA检验,两个时间节点间比较采用SNK检验。所有统计分析均以α=0.05作为检验水准。
结 果
1 两组患者外周血WBC、Neu及LY水平比较
治疗后第3天至第30天,小剂量组外周血WBC、Neu及LY水平显著高于大剂量组(均P<0.05),而自治疗后第60天两组外周血WBC、Neu及LY水平差异无统计学意义(均P>0.05)。
2 各个时间节点两组外周血WBC、Neu及LY水平变化
大剂量组患者外周血WBC、Neu及LY水平在治疗第3天降至最低,后随时间延长而增加(均P<0.05),但仍较治疗前水平低(均P<0.05)。小剂量组患者外周血LY水平在治疗第7天将至最低,后随时间延长而增加(均P<0.05),在治疗第60天与治疗前水平无差异(P>0.05);而外周血WBC及Neu在治疗第3天升高,后随时间延长而降低(均P<0.05),在治疗第30天与治疗前水平无差异(P>0.05)(见表1、2、3)。

表1 两组患者各时间点外周血WBC水平比较(×109/L)

表2 两组患者各时间点外周血Neu水平比较(×109/L)
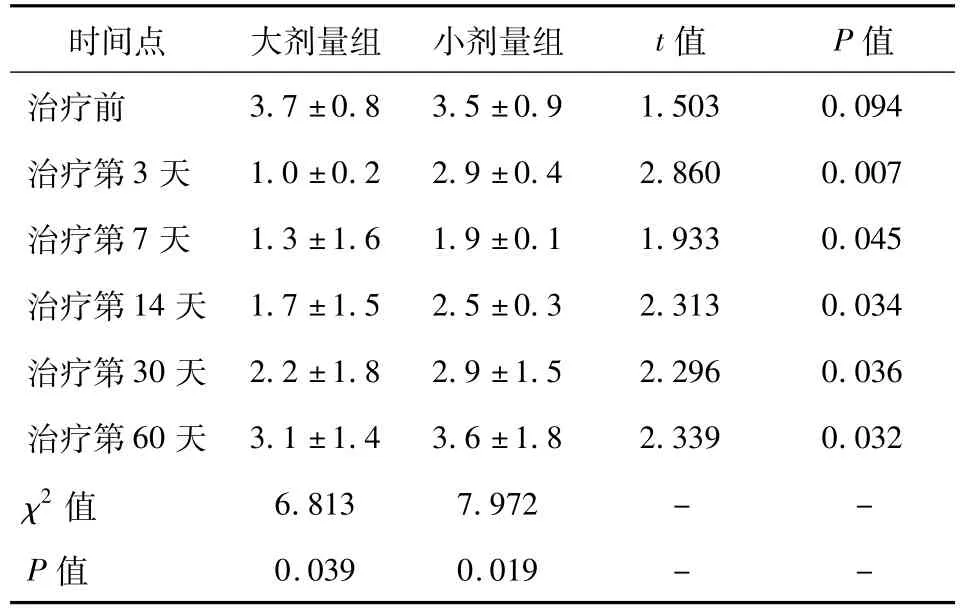
表3 两组患者各时间点外周血LY水平比较(×109/L)
讨 论
甲状腺癌发病率近年来呈现上升趋势,尤以乳头状癌、滤泡状癌等分化型甲状腺癌临床最为常见[2]。由于DTC较易发生全身广泛性转移且具有能浓缩碘的生物学功能,因此临床利用给予DTC患者口服131I,通过其发射出的射线对残余癌肿病灶及转移灶进行有效地破坏,这也被称之为选择性131I放射治疗[6]。目前临床证实此治疗方法对DTC患者的临床疗效较为肯定,能降低DTC复发率、延长患者生存时间[7-8]。但是131I也会对机体正常组织发生电离辐射效应,致使机体发生骨髓抑制、肺功能损害等不良反应[9],同时大多数研究者认为累计剂量过高的131I放射治疗最可能引发骨髓抑制,表现为外周白细胞全系或部分减少[10],然而临床上对于DTC患者术后131I放射治疗的适宜剂量仍不明确,因此本研究通过前瞻性分析接受不同剂量131I放射治疗的DTC患者近期外周血WBC、Neu及LY的水平差异,以此来为临床治疗提供循证依据。
本研究结果显示,治疗后第3天至第30天,小剂量组外周血WBC、Neu及LY水平显著高于大剂量组患者,这提示外周血白细胞全系均对131I放射剂量敏感,累计或一次性大剂量的放射治疗均会在治疗后30天内抑制造血系统恢复;而自治疗后第60天后,两组外周血 WBC、Neu及LY水平无差异,这提示DTC患者术后接受131I放射治疗造血系统恢复至治疗前水平为2月时间,因此累积放射剂量在3.60~5.50GBq范围的131I放射治疗也是较为安全的。在分析两组患者外周血WBC、Neu及LY水平各个时间节点的动态变化中,大剂量组患者外周血WBC、Neu及LY水平呈现“V”字型,即在治疗第3天降至最低,后随时间延长而增加,但仍较治疗前水平低,因此需要在治疗第3天注意监测患者的外周血WBC、Neu及LY水平,防止感染发生。而小剂量组患者的外周血LY动态变化趋势和大剂量组相似,但是其恢复速度更快,在治疗第60天与治疗前水平无差异,因此发生感染的并发症机会更小。值得注意的是,小剂量组患者外周血外周血WBC及Neu在治疗第3天发生升高,后随时间延长而降低,此现象也被称之为“顿挫上升”现象,有研究者认为这可能与131I放射治疗中射线破坏颈部残余正常甲状腺组织,进而引发无菌性炎有关[9]。同时有研究者也分析发现[11],低剂量反复照射可以诱导机体产生刺激作用和适应性反应,进而能提高免疫力、延长寿命及增加对二次辐射的抵抗力等,因此小剂量放射可能在短期内进一步提高外周血WBC及Neu,但是小剂量组患者在治疗第30天与治疗前水平无差异,恢复速度较快。
综上所述,在临床治疗实践中,应在DTC患者的具体情况基础上尽可能来选择小剂量131I放射治疗。然而本研究的纳入病例较少,故此结论仍需要大样本多中心的临床试验来证实。
[1]中华医学会核医学分会.131I治疗分化型甲状腺癌指南(2014版).中华核医学与分子影像杂志,2014,34(4):264-278.
[2]Jentzen W,Balschuweit D,Schmitz J,etal.The influence of saliva flow stimulation on the absorbed radiation dose to the salivary glands during radioiodine therapy of thyroid cancer using 124IPET(/CT)imaging.Eur JNuclMed Mol Imaging,2010,37(12):2298-2306.
[3]杨继文,程光华,葛俊亮,等.131I治疗分化型甲状腺癌伴转移术后的副作用分析.皖南医学院学报,2015,34(4):355-357.
[4]American Thyroid Association(ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer,Cooper D S,Doherty GM,et al.RevisedAmerican Thyroid Association management guidelines for patients withthyroidnodules and differentiatedthyroidcancer.Thyroid, 2009, 19(11):1167-1214.
[5]中华医学会内分泌学分会,中华医学会外科学分会内分泌学组,中国抗癌协会头颈肿瘤专业委员会,等.甲状腺结节和分化型甲状腺癌诊治指南.中华内分泌代谢杂志,2012,28(10):779-797.
[6]Padovani R P,Tuttle R M,Grewal R,etal.Complete blood counts are frequently abnormal 1 year after dosimetry-guided radioactive iodine therapy for metastatic thyroid cancer.Endocr Pract,2014,20(3):213-220.
[7]Monzen S,Mariya Y,Wojcik A,et al.Predictive factors of cytotoxic damage in radioactive iodine treatment of differentiated thyroid cancer patients.Mol Clin Oncol,2015,3(3):692-698.
[8]Kocer D,Karakukcu C,Karaman H,et al.May the neutrophil/ lymphocyte ratio be a predictor in the differentiation of different thyroid disorders?Asian Pac J Cancer Prev,2015,16(9):3875-3879.
[9]Cho JS,Park M H,Ryu Y J,et al.The neutrophil to lymphocyte ratio can discriminate anaplastic thyroid cancer against poorly orwell differentiated cancer.Ann Surg Treat Res,2015,88(4):187-192.
[10]Vrndi O B,Miloŝevi-Djordjevi O M,Mijatovi TeodoroviL C,et al.Correlation between micronuclei frequency in peripheral blood lymphocytes and retention of131I in thyroid cancer patients. Tohoku JExp Med,2013,229(2):115-124.
[11]Simonovic SZ,Mihaljevic O,Majstorovic I,et al.Cytokine production in peripheral blood cells of patients with differentiated thyroid cancer:elevated Th2/Th9 cytokine production before and reduced Th2 cytokine production after radioactive iodine therapy. Cancer Immunol Immunother,2015,64(1):75-82.
(李 凌编辑)
The Short-term Dynam ic Change of Neutrophils and Lym phocytes in Peripheral Blood Cell of Patients w ith Differentiated Thyroid Cancer by the131IRadiotherapy
FAN Xian-Dong,LIAO Zi-Hong,WANG An-Bo
(The First People's Hospital of Neijiang City,Sichuan Province,Neijiang 641000,China)
Objective To analyze the short-term dynamic change of white blood cell(WBC),neutrophils(Neu)and lymphocytes(LY)in peripheral blood cell of patients w ith differentiated thyroid cancer(DTC)by the131I radiotherapy.M ethods A total of 86 in-patientsw ith DTC were collected for the prospective study. Patients were divided into two groups according to the dose of the131I radiotherapy;high-dose group of 38 cases received cumulative radiological dose 3.60-5.50GBq,and low-dose group of 48 cases received cumulative radiological dose 1.11-1.50GBq.The levels of WBC,Neu and Ly in peripheral blood cellwere detected and compared between two groups at pre-therapy,post-therapy 3rd day,7thday,14thday,30thday and 60thday.The short-term dynamic changes of WBC,Neu and LY in two groupswere analyzed.Results The levels of WBC,Neu and Ly in low-dose group were higher than that in high-dose group from pretherapy to post-therapy 30thday(P<0.05),but the levels ofWBC,Neu and Ly had no differences between two groups at the post-therapy 60thday(P>0.05).The levels of WBC,Neu and Ly of peripheral blood cell in high-dose group were lowest at the post-therapy 3rd day,and the levels of WBC,Neu and Ly were increasing w ith time(P<0.05),but the levels of WBC,Neu and Ly at post-therapy 60thday were lower than that in pre-therapy(P<0.05).The level of Ly of peripheral blood cell in low-dose group was lowest at the post-therapy 7thday,and the level of Ly were increasing w ith the time(P<0.05),but the level of Ly had no difference between two groups at the post-therapy 60thday(P>0.05).The levels of WBC and Neuof peripheral blood cell in low-dose group were highest at the post-therapy 3rd day,and the levels of WBC and Neu were decreasing w ith time(P<0.05),but the level of Ly had no difference between two groups at the post-therapy 30thday(P>0.05).Conclusion Small dosage131I radiotherapy exhibits the least short-term dynamic change of Neu and LY in peripheral blood cell of patientsw ith DTC.It isworth of recommendation in clinical practice.
Differentiated thyroid cancer;131I; Radiotherapy; white blood cell; Neutrophils;Lymphocytes
10.11748/bjm y.issn.1006-1703.2016.05.009
2015-09-29;
2015-10-17

