芦苇腐解对白龟湖湿地水质的影响研究
刘 彪,杨晓玉,孙华鹏
(河南城建学院 市政与环境工程学院,河南 平顶山 467036)
芦苇腐解对白龟湖湿地水质的影响研究
刘彪,杨晓玉,孙华鹏
(河南城建学院 市政与环境工程学院,河南 平顶山 467036)
通过室内实验,对白龟湖湿地常见的挺水植物芦苇,在春季倒伏后的腐解过程以及其对水质的影响进行了研究,共设置了3个生物量密度,2 g/L、4 g/L和8 g/L,记为Ⅰ、Ⅱ和Ⅲ组。结果表明:实验结束时,Ⅰ、Ⅱ和Ⅲ组失重率分别达到了19.83%、20.53%和22.71%。三个处理组芦苇腐解速率存在一定差异,但总体变化趋势相似。腐解过程中,Ⅰ、Ⅱ和Ⅲ组植物残体TN和TP浓度的变化趋势一致,实验结束时,TN含量分别为4.32 mg/g、3.88 mg/g和4.35 mg/g,TP含量分别为0.21 mg/g、0.22 mg/g和0.20 mg/g,无显著差异,不同生物量密度的植物残体腐解时对水质影响程度不同。实验初期,植物残体向水体中释放大量N、P营养物质,水质因生物量密度不同而差异较大,实验后期,各组水质差异减小。此外,适量植物残体的存在有助于水体氮元素的循环,降低水体氮负荷。
挺水植物;芦苇;腐解;营养盐;水质。
水生植物是河流、湖泊生态系统的重要组成部分,在生长过程中吸收水体中的氮、磷等营养物质,为水体中微生物提供附着的载体,进一步增强水体的自净能力。目前,水生植物原位修复方法已成为富营养化水体治理的重要途径[1-2],但挺水植物进入衰亡期后,植物残体会逐渐腐烂分解,其体内氮(N)、磷(P)等营养物质会重新释放到水体环境中,有可能对水体造成二次污染[3-4]。曹培培等[5]的研究表明,不同类型或不同种类的水生植物,其腐解过程均能显著增加水体N、P含量,且腐解过程具有明显的阶段性,即前期腐解速率较快,随后缓慢下降。这种现象在水生植物残体腐解过程中具有普遍性[5-7],这是因为淋溶和有机物分解代谢转化速率具有明显的差别。不同挺水植物的腐解过程及营养盐释放规律存在较大差异,且植物残体的腐解过程与生物量密度及生存环境有很大关系。因此,针对不同湖泊水体生态系统中的优势物种开展研究十分必要。
芦苇是河南省平顶山市白龟湖湿地常见的挺水植物之一。芦苇在秋冬季枯萎衰亡,但不会立即倒伏。一方面,冬季水温较低,植物残体腐解速率较慢;另一方面,芦苇植株内木质素、纤维素等含量较高,性质稳定不宜腐解。春季来临之后,芦苇逐渐倒伏在水体中,导致水体营养盐类大幅提升,造成水质恶化。目前,对挺水植物腐解过程的研究一般是采集新鲜植物,在实验室内经过杀青、烘干后构建试验系统[5、6、8],这样并不能反映芦苇在衰亡后的自然腐解过程。
本研究在初春时节,以白龟湖湿地未倒伏的芦苇枯萎植株为原料,构建室内试验系统,研究不同生物量密度条件下芦苇枯落物的腐解过程及其对水质的影响,为利用芦苇对湖泊生态系统进行原位生态修复提供理论依据。
1 材料和方法
1.1样品的采集及处理
芦苇枯落物、水样和底泥于2016年3月25日采集于白龟湖湿地(33°46′12.74″N,113°09′20.29″E)。芦苇选取岸边未倒伏的枯一计划萎植株,仅采集水面之上的部分,运回实验室后用双蒸水漂洗干净,65 ℃烘干至恒重,剪成0.5 cm左右大小,充分混匀后备用。将采集的水样置于100 L水桶中过夜后,过200目筛网去除杂质。将采集的表层底泥充分混合后,过100目筛网去除底泥中植物残体和杂物。2016年5月12日在同一地点,采集新鲜芦苇,用双蒸水漂洗干净,风干后95 ℃杀青15 min,65 ℃烘干至恒重。
1.2试验设计
以12 L聚乙烯水桶作为试验容器,桶内加入2 kg底泥,10 L水样,静置3 d。试验设定3个生物量密度,2 g/L、4 g/L和8 g/L,分别记为Ⅰ、Ⅱ和Ⅲ组,同时设置1组对照,每组3个重复。将剪好的芦苇置于200目网孔袋,分别加入设定质量的样品。在试验开始的第0 d、2 d、6 d、12 d、18 d、24 d、30 d、36 d、42 d、48 d和60 d,分别测定芦苇和水样的相关理化指标。
1.3样品分析和数据处理
植物总氮(TN)采用半微量凯氏法测定;总磷(TP)采用钼锑抗比色法测定;分解速率参照文献[9]方法分析。水体pH采用雷磁PHS-3E测定;溶解氧(DO)采用雷磁JPSJ-605S测定;TP采用钼锑抗比色法测定;NH4+-N采用纳氏试剂分光光度法测定;NO3--N采用酚二磺酸分光光度法测定;NO2--N采用N-(1-萘基)-乙二胺分光光度法测定。利用SPSS 18.0进行线性相关性和单因素方差分析,采用Excel进行图表绘制。
2 结果与分析
2.1芦苇失重率及分解速率的变化
为期60 d的腐解过程中,Ⅰ、Ⅱ和Ⅲ组芦苇残体失重率呈现快速上升再缓慢上升的趋势,见图1(a)。前6 d失重速率较快,Ⅰ、Ⅱ和Ⅲ组失重率分别达到了9.6%、14.37%和11.73%,3组之间失重率差异显著,其中Ⅱ组失重率最高。第60 d时,失重率分别达到了19.83%、20.53%和22.71%,Ⅰ和Ⅱ组之间失重率无显著差异,Ⅲ组与其余两组之间失重率差异显著。由图1(b)可知,芦苇残体腐解速率k在前2 d最快,分别达到了0.050、0.049和0.052,k值在第6 d后快速下降,第12 d后缓慢下降并趋于平稳,三个处理组腐解速率趋势保持一致,且仅在第6 d时彼此存在显著差异。
2.2芦苇TN和TP的变化
如图2(a)所示,Ⅰ、Ⅱ和Ⅲ组芦苇残体TN均在前2 d大幅上升,由初始值0.02 mg/g分别上升到了3.93、4.35和7.83 mg/g,Ⅲ组与其余两组之间TN含量差异显著。第2 d至实验结束,Ⅰ组在第12 d时有短暂升高,随后降低并最终趋于平稳,Ⅱ组TN含量变化幅度不大,Ⅲ组从第2 d后呈现缓慢下降趋势,并于第12 d后趋于平稳,第60 d时,TN含量分别为4.32 mg/g、3.88 mg/g和4.35 mg/g,三者之间无显著差异。如图2(b)所示,在实验前2 d,Ⅰ、Ⅱ和Ⅲ组芦苇残体TP均有一个快速下降的过程,由初始值0.35 mg/g分别下降到0.15 mg/g、0.15 mg/g和0.14 mg/g,三者之间无显著差异。在整个实验周期内,Ⅰ、Ⅱ和Ⅲ组TP的变化趋势一致,第36 d时,Ⅰ、Ⅱ和Ⅲ组TP含量彼此存在显著差异,第42 d和48 d时,Ⅰ组与Ⅱ和Ⅲ组TP含量存在显著差异,实验结束时,TP含量分别为0.21 mg/g、0.22 mg/g和0.20 mg/g,彼此无显著差异。

图1 芦苇失重率(A)和分解速率(B)随时间变化趋势

图2 芦苇残体TN和TP随时间变化趋势
2.3水体pH、DO和TP的变化
由图3(a)可知,Ⅰ、Ⅱ、Ⅲ和对照组pH的变化趋势相似,在第6 d时,pH由初始值8.06分别降到了最低值,依次为7.40、7.25、6.95和7.82,呈显著差异,随后pH开始回升,第18 d后,pH波动幅度变小。实验结束时,Ⅰ、Ⅱ、Ⅲ和对照组pH分别为7.98、7.98、7.97和7.95,均略低于初始值,各组之间无显著差异。此外,在第2至30 d,对照组pH均高于3个处理组,且差异显著。
水体DO浓度初始值为7.62 mg/L,其中对照组在整个试验周期内变化范围介于5.14至8.02 mg/L,见图3(b)。Ⅰ、Ⅱ、Ⅲ和对照组,在实验初期均呈现快速下降趋势,在第6 d分别达到了2.05 mg/L、0.24 mg/L、0.23 mg/L和5.67 mg/L,处理组均与对照组差异显著。第6至36 d内,Ⅰ和Ⅱ组DO先上升再下降随后窄幅波动。Ⅲ组DO在第6至18 d内处于较低水平,并于第18 d达到最低值0.14 mg/L,随后缓慢上升。实验结束时,DO分别为7.82 mg/L、7.73 mg/L、6.33 mg/L和7.81 mg/L,Ⅲ组与其余各组差异显著。
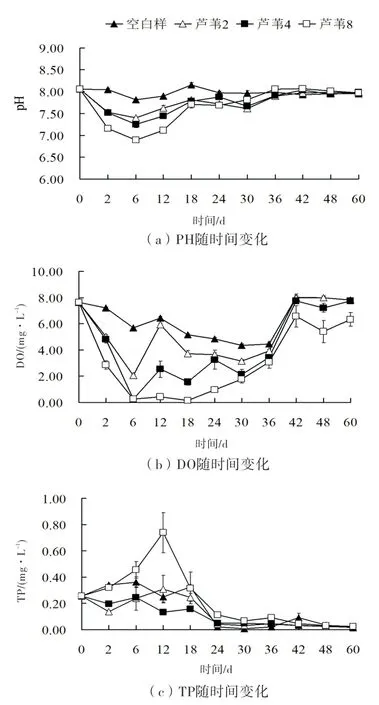
图3 水体pH、DO和TP随时间变化趋势

图4 水体NH4+-N、NO3--N和NO2--N浓度随时间变化趋势
如图3(c)所示,水体TP浓度初始值为0.26 mg/L,其中Ⅰ、Ⅱ和对照组在0至18 d内,TP浓度窄幅波动,并在第18 d后快速下降,第24 d时TP浓度分别为0.04 mg/L、0.05 mg/L和0.02 mg/L,此后再次进入窄幅波动直至实验结束;Ⅲ组在实验初期,TP浓度快速上升,并在第12 d时达到最大值0.74 mg/L,与其余各组差异显著,随后快速下降,并于第24 d时下降至0.11 mg/L,随后进入窄幅波动。

如图4(b)所示,水体NO3--N浓度初始值为0.81 mg/L,3个处理组和对照组表现出相同的变化趋势,初期快速下降,随后交替上升和下降,最后趋于平稳。实验结束时,Ⅰ和对照组NO3--N浓度略高于初始值,分别为0.87 mg/L和0.83 mg/L,Ⅱ和Ⅲ组NO3--N浓度均低于初始值,分别为0.71 mg/L和0.22 mg/L。
如图4(c)所示,水体NO2--N浓度初始值为0.005 mg/L。对照组表现为先上升再下降的趋势;3个处理组则有所不同,在0至24 d内,NO2--N浓度变化趋势与对照组类似,均表现为先上升再下降的变化趋势,但Ⅰ、Ⅱ和Ⅲ组分别在第30 d、第36 d和第48 d突然升高,分别达到了0.66 mg/L、0.85 mg/L和0.11 mg/L,随后迅速回落。实验结束时,Ⅰ和Ⅱ组NO2--N浓度略低于对照组,而Ⅲ组高于对照组,与其余各组差异显著。
3 讨论
3.1芦苇腐解的影响因素
挺水植物腐解速率的影响因素有很多,如温度[6]、植物残体理化性质[8、10、11]、沉积物性质[12]以及微生物群体[13]等。其中,植物残体理化性质对腐解速率有较大影响。本研究中,芦苇是2015年秋冬季节枯萎后未倒伏的植株,这些芦苇残体在野外暴露长达5个月左右,其TN和TP含量仅为0.02 mg/g和0.35 mg/g,而同一地点采集的新鲜芦苇植株,TN和TP含量为:茎(2.53 mg/g和0.33 mg/g);叶(26.33 mg/g和1.87 mg/g)。由此可见,芦苇残体大部分N、P在雨水冲刷下重新进入到了环境中。芦苇残体N、P初始含量的不同,使其腐解过程中N、P的变化趋势与他人的研究有所不同。曹勋等[6]的研究表明,芦苇残体在48 d内TN含量由15.01 mg/g下降到14.26 mg/g,而曹培培等[5]的研究则发现,芦苇残体在60 d内TN含量不降反升,由14.82 mg/g上升到17.41 mg/g。我们的数据显示,植物残体TN含量也表现为不降反升,而且该现象尤为明显,微生物的固氮作用可能是最主要的原因[14-15]。杨继松等[16]对三江平原沼泽湿地枯落物腐解过程的研究表明,N含量越低的枯落物其固定N的能力越强,且枯落物N含量的变化趋势与微生物的营养需求相关。此外,Ⅰ和Ⅱ组TN浓度与腐解速率和水质参数无显著线性相关性,Ⅲ组TN浓度与腐解速率呈显著正相关(p<0.01),与水体NH4+-N浓度也显著正相关(p<0.05)。可见,枯落物在水体中生物量密度达到一定程度后对水质NH4+-N浓度的影响是明显的。
温达志等[17]的研究发现,植物体内的P极易被淋溶而损失,这是因为P主要以磷酸根离子或化合物的形式存在于植物体内。许多研究也表明,植物枯落物腐解过程中释放磷的速率非常快[6、8、18]。本研究发现,虽然枯萎植株体内TP含量已经很低,但依然在腐解前期失去了大部分P。后期植物残体TP的变化趋势呈现上升和下降交替状态,可能是由于P相关微生物的活动造成的[19]。
有研究表明,植物体内有机氮浓度较高时易分解,且C/N比越高腐解越慢[10],木质素含量越高腐解越慢[11]。唐金艳等[8]的研究表明,不同生物量密度间植物干重损失率差异不显著,而不同植物处理间差异显著。本研究以芦苇枯落物为研究对象,各处理组的差别在于生物量密度,结果显示腐解速率仅在第6 d和12 d存在显著差异,其余时间段不存在显著差异。由此可见,芦苇残体的腐解速率受生物量密度的影响较小。此外,在三个生物量密度处理组中,Ⅰ和Ⅱ组的腐解速率与植物理化参数不存在显著的线性相关性;Ⅲ组的腐解速率与植物体内TN呈显著正相关(p<0.01)。
3.2芦苇腐解对水质的影响
生物量密度不同对水体产生的影响也不相同[8]。三个处理组和对照组pH变化趋势相似,但各自变化范围因生物量密度不同而有所差异,在实验前期,生物量密度越大,pH下降的幅度也越大,并且在第6 d和12 d,pH值与生物量密度显著负相关,且Ⅰ、Ⅱ、Ⅲ和对照组之间差异显著。这是因为:①硝化过程消耗了大部分碱度;②随着DO的消耗,水体呈缺氧或厌氧状态,有机质厌氧分解产生有机酸;③植物残体在分解过程中,会产生CO2,这些原因与生物量密度均有着密切关系。此外,有研究表明[20-21],适量的植物残体不会引起水质恶化。本研究中,虽然在实验前期Ⅰ和Ⅱ组水体NH4+-N浓度超过了对照组,但是随着植物残体的腐解,在个别时段,水体NH4+-N浓度反而低于对照组(图4(a)),而Ⅲ组由于生物量密度较大,其水体NH4+-N浓度始终大于对照组(图4(a))。可见,在水体中保留一定生物量密度的植物残体,可在一定程度上促进水体氮循环,减轻水体氮负荷,这一结论在之前的研究中也得到印证[6、8]。
水体中正磷酸盐的主要存在形态是HPO42-和H2PO4-,在中性偏碱性环境下易于金属离子结合,并最终进入沉积物。线性相关性分析表明,Ⅰ组pH和DO浓度与水体TP成负相关但不显著(p>0.05),而Ⅱ和Ⅲ组pH和DO浓度与水体TP呈显著负相关(p<0.05)。pH和DO浓度的降低,有利于沉积物中P向水体中迁移,而随着pH和DO浓度的回升,水体中P逐渐向底泥中迁移,这里P的迁移转化涉及复杂的生物化学过程[22]。
水体中NH4+-N、NO3--N和NO2--N三者之间的转换主要是通过硝化作用、反硝化作用以及厌氧氨氧化作用来完成的,这个过程由微生物主导。实验初期水体NH4+-N浓度的上升可能是由于沉积物中有机氮的分解引起的。而NO3--N浓度在实验初期的下降则是由于水体呈厌氧或缺氧状态,发生了反硝化作用,线性相关性分析表明,Ⅰ和Ⅱ组NO3--N与DO浓度呈负相关但不显著(p>0.05),Ⅲ组NO3--N与DO浓度呈显著负相关(p<0.05)。对于Ⅰ、Ⅱ和Ⅲ组在试验后期,NO2--N浓度的突然增加,可能与氨氧化细菌的活性有关[23],但具体反应机制有待进一步研究。
4 结论
(1)Ⅰ、Ⅱ和Ⅲ组腐解速率仅在第6 d和12 d存在显著差异,前12 d腐解速率较快,随后进入缓慢腐解期。实验结束时,植物残体失重率分别为19.83%、20.53%和22.71%。数据表明,在春季时,大量枯萎植株倒伏在水中后,会造成水质恶化。建议在秋冬季芦苇枯萎后及时收割,避免其体内大部分N、P在雨水的冲刷下重新进入到水体环境,从而造成水质动荡。
(2)植物腐解对水质的影响主要表现在初期阶段,生物量密度对水质的影响较大,随着生物量密度的增加,DO浓度在长时间内处于较低水平,pH降幅也越大,营养盐的浓度也越大。但在水体中保留一定生物量密度的植物残体,可在一定程度上促进水体氮循环,减轻水体氮负荷。
(3)芦苇残体腐解对水体中各营养盐的存在形态有一定影响,并在植物-水-沉积物三者间迁移转化,这一过程主要由微生物主导,具体反应机制有待进一步研究。
[1]颜昌宙,许秋瑾,赵景柱,等.五里湖生态重建影响因素及其对策探讨[J].环境科学研究,2004,17(3):44-47.
[2]Masifwa W F,Okello W,Ochieng H,et al.Phosphorus release from decomposing water hyacinth and effects of decomposition on water quality[J].2004.
[3]王丽敏,尚士友,吴利斌,等.草型湖泊(乌梁素海)氮循环转化规律的研究[J].环境与可持续发展,2004(1):16-18.
[4]卢少勇,张彭义,余刚,等.茭草、芦苇与水葫芦的污染物释放规律[J].中国环境科学,2005,25(5):554-557.
[5]曹培培,刘茂松,唐金艳,等.几种水生植物腐解过程的比较研究[J].生态学报,2014,34(14):3848-3858.
[6]曹勋,韩睿明,章婷曦,等.冬季水生植物分解过程及其对水质的影响研究[J].农业环境科学学报,2015(2):361-369.
[7]张来甲,叶春,李春华,等.沉水植物腐解对水体水质的影响[J].环境科学研究,2013,26(2):145-151.
[8]唐金艳,曹培培,徐驰,等.水生植物腐烂分解对水质的影响[D].南京大学,2013.
[9]Olson J S.Energy Storage and the Balance of Producers and Decomposers in Ecological Systems[J].Ecology,1963,44(2):322-331.
[10]Taylor B R.Nitrogen and Lignin Content as Predictors of Litter Decay Rates:A Microcosm Test[J].Ecology,1989,70(1):97-104.
[11]Berg B,Staaf H.Decomposition Rate and Chemical Changes of Scots Pine Needle Litter.II.Influence of Chemical Composition[J].Ecological Bulletins,1980,32(32):363-372.
[12]周林飞,关秀婷,王铁良.几种水生植物对湿地底泥中营养物质含量变化的影响[J].水土保持学报,2016,30(1):278-284.
[13]李倩,田翠翠,肖邦定.黑藻根际对沉积物中氨氧化细菌和古菌的影响[J].环境工程学报,2014,8(10):4209-4214.
[14]Gessner M O.Breakdown and nutrient dynamics of submerged Phragmites shoots in the littoral zone of a temperate hardwater lake[J].Aquatic Botany,2000,66(1):9-20.
[15]Hernes P J,Benner R,Cowie G L,et al.Tannin diagenesis in mangrove leaves from a tropical estuary:a novel molecular approach[J].Geochimica Et Cosmochimica Acta,2001,65(18):3109-3122.
[16]杨继松,刘景双,于君宝,等.三江平原沼泽湿地枯落物分解及其营养动态[J].生态学报,2006,26(5):1297-1302.
[17]温达志,魏平,张佑昌,等.鼎湖山南亚热带森林细根分解干物质损失和元素动态[J].生态学杂志,1998(2):1-6.
[18]李燕,王丽卿,张瑞雷.淀山湖沉水植物死亡分解过程中营养物质的释放[J].环境污染与防治,2008,30(2):45-48.
[19]Ozalp M,Conner W H,Lockaby B G.Above-ground productivity and litter decomposition in a tidal freshwater forested wetland on Bull Island,SC,USA[J].Forest Ecology & Management,2007,245(1):31-43.
[20]潘慧云,徐小花,高士祥.沉水植物衰亡过程中营养盐的释放过程及规律[J].环境科学研究,2008,21(1):64-68.
[21]杨文斌,王国祥,王刚.菹草衰亡腐烂对水质持续性影响试验研究[J].安全与环境学报,2010,10(2):90-92.
[22]陈永川,汤利.沉积物-水体界面氮磷的迁移转化规律研究进展[J].云南农业大学学报,2005,20(4):527-533.
[23]刘彪.仿生植物附着氨氧化微生物群落结构及其对环境因子的响应研究[D].镇江:江苏大学,2014.
Decomposition of Phragmites australis and its influence on water quality of Baigui Lake wetland
LIU Biao,YANG Xiao-yu,SUN Hua-peng
(SchoolofMunicipalandEnvironmentalEngineering,HenanUniversityofUrbanConstruction,Pingdingshan467036,China)
An indoor experiment was carried out to study the decomposition process of Phragmites australis,typical emergent plant in Baigui Lake wetland,in spring after lodging in water and subsequent influence on water quality.Three different biomass densities,2,4 and 8 g/L,were set and marked asⅠ,Ⅱ and Ⅲ group,respectively.At the end of experiment,the weight loss of Ⅰ,Ⅱ and Ⅲ group was 19.83%,20.53% and 22.71%,respectively.Among the three groups,the decomposition rate has some differences,but its trend was similar.During the decomposition process,the dynamics of TN and TP concentration of plant residues showed the same variation trend among the Ⅰ,Ⅱ and Ⅲ groups.At the end of experiment,the value of TN was 4.32,3.88 and 4.35 mg/g,respectively,and the value of TP was 0.21,0.22 and 0.20 mg/g,respectively.And all of these showed no significant difference.The different effects on water quality due to different biomass density of plant residues.Initially,the plant residues released a lot of N and P nutrients into the water,a large difference was observed in water quality among the Ⅰ,Ⅱ, Ⅲ and control group.And the differences were disappeared at the end of the experiment.Especially,the existence of moderate plant residues could effectively promote the N cycles in water and decrease the water N load.
emergent plant;Phragmites australis;decomposition;nutrient;water quality.
2016-06-17
国家自然科学基金项目(51509083)
刘彪(1981—),男,河南平顶山人,博士研究生,讲师。
1674-7046(2016)05-0061-07
10.14140/j.cnki.hncjxb.2016.05.011
X524
A

