牙体充填材料表面粗糙度对常见口腔链球菌黏附力的影响
郑赛男 蒋丽 张雷 郝丽英 叶露 李伟
口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
牙体充填材料表面粗糙度对常见口腔链球菌黏附力的影响
郑赛男 蒋丽 张雷 郝丽英 叶露 李伟
口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
目的 采用原子力显微镜(AFM)检测常见口腔链球菌属与不同表面粗糙度的光固化复合树脂及玻璃离子水门汀(GIC)之间的黏附力。方法 将光固化复合树脂和GIC样本表面梯度抛光,根据最终表面粗糙度不同分为300、200、100和10 nm组,使用AFM观察其表面形貌。采用先锋菌(血链球菌、缓症链球菌)和致龋菌(变异链球菌、表兄链球菌)制作细菌改性探针,通过AFM获得力—距曲线测量细菌与树脂和GIC样本表面的黏附力。对材料表面粗糙度测量值进行方差分析,细菌黏附力进行Kruskal-Wallis非参数检验,同时采用Dunn’s进行组间两两比较,并对表面粗糙度与细菌黏附力进行相关性分析。结果 随材料表面粗糙度增加,细菌的黏附力增大,4种细菌的黏附力均在300 nm的材料表面达到最大值;在10和300 nm组的GIC表面,变异链球菌的黏附力由0.578 nN增加到2.876 nN。4种细菌在树脂表面的黏附力略大于GIC,先锋菌的黏附力略大于致龋菌,组间差异均在200和300 nm组时较明显。结论 材料表面粗糙度对细菌黏附力的影响较大,二者有明显的相关性;GIC对细菌的黏附性较复合树脂低;材料表面粗糙度对致龋菌的影响小于先锋菌。
原子力显微镜; 黏附力; 充填材料; 表面粗糙度; 口腔链球菌属
龋病是在以细菌为主的多因素作用下,牙体硬组织发生慢性进行性破坏的疾病[1]。龋病经充填治疗后,细菌在牙体和充填材料交界处滞留,易引起微渗漏,发生继发龋,是导致龋病治疗失败的主要原因之一[2]。菌斑生物膜是继发龋的始动因素,细菌对牙齿和充填材料表面的黏附是菌斑生物膜形成的关键步骤。材料表面的物理特性,如粗糙度、表面电荷和疏水性等均能影响细菌的定植和黏附,其中粗糙度对细菌黏附的影响最大。近年来,人们对菌斑生物膜的形成研究较多,但对细菌黏附的初始阶段和充填材料的黏附机制研究较少。原子力显微镜(atomic force microscope,AFM)因具有原子级的分辨率已被广泛用于测量材料表面的原子级形貌,通过力—距曲线分析能够直接定量获得微生物与材料表面之间及微生物之间的相互作用力,灵敏度高,可重复性好,是一种理想的探测细菌与生物材料之间基本相互作用力的方法。目前AFM已用于口腔细菌黏附力的研究,但利用AFM定量研究致龋菌对充填材料表面黏附定植的力学机制还较少。
本实验采用AFM观察不同粗糙度的复合树脂和玻璃离子水门汀(glass ionomer cement,GIC)表面的微观形貌;并选取与龋坏密切相关的先锋菌(血链球菌、缓症链球菌)和致龋菌(变异链球菌、表兄链球菌)各两种,通过黏附缓冲液模拟口内环境,利用AFM原位测量细菌对材料表面的黏附力,考察细菌在两种材料表面黏附力的差异,比较先锋菌和致龋菌对不同材料表面黏附力的大小。通过分析细菌对充填材料表面黏附的微观力学机制,为临床牙体充填材料表面形貌的处理和材料的选择提供理论依据,对减少口腔细菌的黏附和预防继发龋提供指导意义。
1 材料和方法
1.1 样本的制备
采用模具将Z250型光固化复合树脂(3M公司,美国)和IX型GIC(而至富士公司,日本)均制备成直径1 cm、厚2 mm的圆片形试件,调磨使其上下平行,随机分为4组,每组3个试件。在抛光机(Strue-Ts公司,丹麦)上用250、1 000、2 000、3 000目耐水砂纸(勇士公司,德国)在流水冷却下由粗到细将试件进行梯度打磨,形成表面粗糙度最终为300、200、100和10 nm的表面。打磨结束后,去离子水冲洗30 s,超声清洗10 min,自然干燥,采用SPM-9600 型AFM(岛津公司,日本)测量两种材料的表面粗糙度Ra值,测量条件为:相位模式、扫描频率1 Hz,扫描面积20 μm×20 μm。每个样本按单纯随机法选取3个位点观察材料的表面形貌,得到图像后使用AFM内置的VectorScan 3. 31测量分析软件构建样本表面三维模型,应用Surface组件分析材料表面的Ra值,超声清洗10 min后,自然干燥,备用。
1.2 细菌培养和悬液制备
将血链球菌ATCC 10556、缓症链球菌ATCC 700610、变异链球菌ATCC 25175以及表兄链球菌ATCC 33478分别加入10 mL脑心浸液肉汤培养基(OXOID公司,英国)中,37 ℃下兼性厌氧(70% N2+20%CO2+10%H2)环境中,增菌培养12 h,离心(1 500 g,15 min)后收集细菌沉淀团块,PBS洗2次以去除残余培养基,最后加入1 mL PBS重悬,以利于增加细菌与探针的静电作用。在冰水浴中以8 W功率超声振荡3次,每次10 s,利用超声分散细菌团块并断裂链状结构,形成细菌悬液。
1.3 细菌探针的制备
本实验采用AFM无尖探针,型号为CSC37/tipless/ Cr-Au(μ-Masch公司,爱沙尼亚)。光学显微镜下检查探针表面是否有碎屑等杂质,合格后在紫外线下消毒5 min,将探针固定在自制显微操作仪上,将探针的悬臂梁尖端2/3没入0.01%聚左旋赖氨酸(Sigma-Aldrich公司,英国)中3 min,使得探针表面带正电荷,取出自然干燥2 min,然后浸入刚制备的细菌悬液中5 min,将细菌固定在悬臂梁上,制备好的探针立即用于测量黏附力。
1.4 力—距曲线的测量
将制备好的细菌探针加载于AFM的探针架上,并将待测样本用防水胶带固定于液体池底部,AFM测量条件为:室温,黏附缓冲液中,接触模式、扫描频率1 Hz,扫描范围2 μm×2 μm,触发器阈值1 V。在试件材料的表面随机选取3个位点,每次测量100次,非同日培养的细菌重复2次。根据扫描电子显微镜(scanning electron microscope,SEM)图片及曲线抖动情况判断细菌脱落程度,收集所有的有效数据,根据虎克定律F=Ksp×D(F为细菌与材料表面的黏附力;Ksp为AFM探针的弹性系数,可通过热力学法算出;D为AFM探针的弹性形变),将悬臂梁的弹性形变(nm)换算为黏附力(nN)。
1.5 统计分析
采用SigmaPlot 12.5统计软件进行统计分析。因为材料表面粗糙度为正态分布,故统计推断采用方差分析(ANOVA),统计描述采用平均值±标准差;而黏附力数据属于偏态分布,故统计推断采用Kruskal-Wallis非参数检验,并利用Dunn’s进行组间两两比较,统计描述采用中位数和四分位数;对材料表面粗糙度与细菌黏附力进行相关性分析;检验水准为双侧α=0.05。
2 结果
2.1 材料的表面形貌
不同粗糙度的复合树脂和GIC的AFM表面形貌图见图1。根据Surface组件分析得到的材料表面Ra值见表1,据Ra值将每种材料样本分为4个梯度,即10、100、200和300 nm,经统计学分析,每组样本之间Ra值的差异均有统计学意义(P<0.01)。由图1可见,两种材料在粗糙度为10和100 nm时,样本表面较平滑,有轻微的划痕和小的裂缝;200和300 nm时,样本表面的划痕和裂缝明显,甚至有孔洞样结构,表面粗糙度明显增加。

图 1 复合树脂和GIC的表面形貌图 AFM × 750 000Fig 1 Surface topography images of GIC and composite resin AFM × 750 000
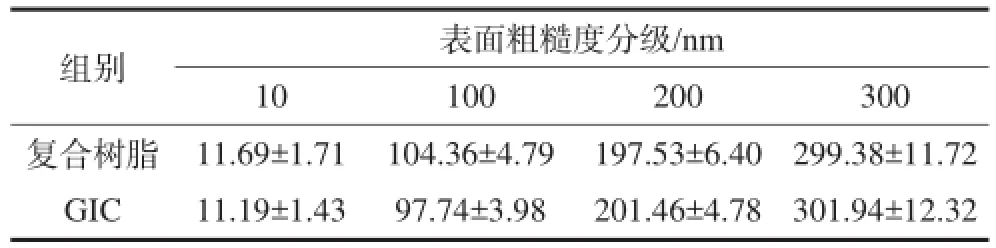
表 1 不同表面粗糙度的复合树脂和GIC的Ra值Tab 1 Ra values of different roughness of composite resin and GIC ?
2.2 细菌黏附力
血链球菌在树脂表面的力—距曲线见图2。从细菌的后退曲线(图2蓝线所示)可明显看出4种不同表面粗糙度对该菌力—距曲线的影响。在黏附力测量过程中,被覆细菌的探针不断接近材料表面,在距离表面200 nm时受到排斥力并呈指数增加(图2红线所示)。当探针离开材料表面时,由于细菌与材料表面具有黏附力,使得探针离开时悬臂梁向样本表面弯曲,探针必须离开一定距离后,细菌与样本表面才能分离,细菌与材料间的黏附结合键断裂,此时悬臂梁弹性形变达最大值,即最大黏附力主峰值;然后随探针远离材料表面,出现很多小的黏附力副峰,即为典型的细菌黏附力—距曲线。
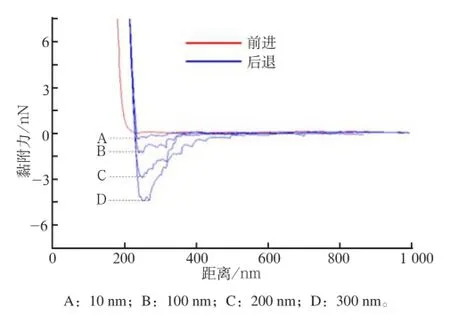
图 2 血链球菌在不同粗糙度树脂表面的力—距曲线Fig 2 Example of force-distance curve between Streptococcus sanguis and composite resin surface with different roughness
细菌黏附力的定量分析结果见图3,统计结果表明,4种细菌对充填材料表面的黏附力均表现出相似的趋势,随着表面粗糙度的增加,细菌在材料表面的黏附力均有增加。在树脂表面,血链球菌的黏附力由1.051 nN增加到4.295 nN,变异链球菌由0.336 nN增加到4.026 nN;在GIC表面,变异链球菌的黏附力由0.578 nN增加到2.876 nN。就同种材料而言,先锋菌的黏附力略大于致龋菌,统计结果表明,在200、300 nm两种粗糙度下,先锋菌和致龋菌的黏附力差异明显(P<0.05),在10、100 nm时差异较小(P>0.05)。对比两种材料表面的细菌黏附力,在200、300 nm时,4种细菌在树脂表面的黏附力大于GIC(P<0.05),粗糙度较小时黏附力的差异较小或无明显差异。统计分析表明,除了缓症链球菌在两种材料表面和表兄链球菌在树脂表面的黏附力与材料表面粗糙度相关性无统计学意义之外(P>0.05),其余细菌的黏附力与材料表面粗糙度都有明显的线性关系(P<0.05),其中表兄链球菌黏附力与GIC表面粗糙度的线性相关关系见图4。
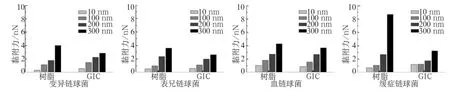
图 3 4种细菌在不同粗糙度复合树脂和GIC表面的黏附力Fig 3 Adhesion forces of four bacteria on composite resin and GIC surface with different roughness
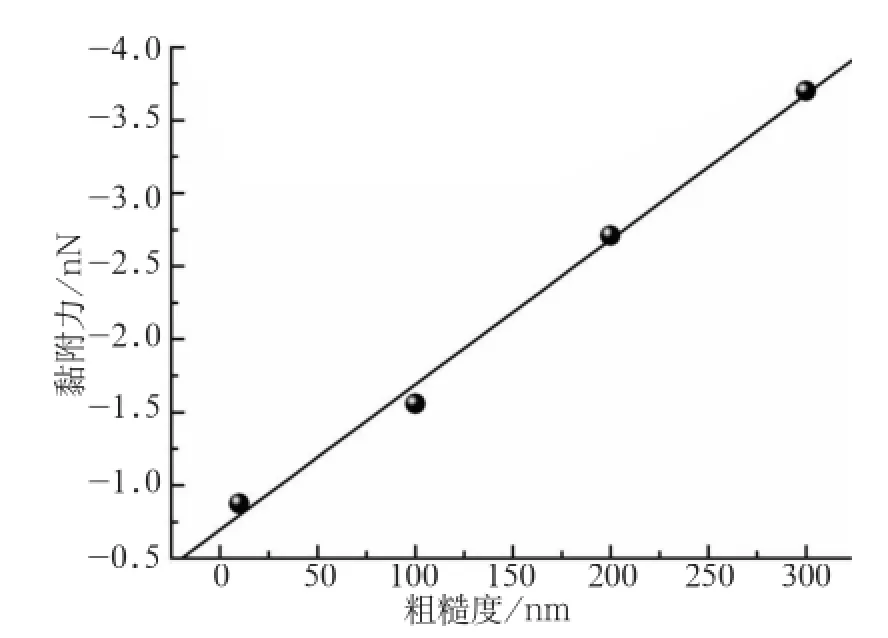
图 4 表兄链球菌黏附力与GIC表面粗糙度呈线性相关Fig 4 Linear correlation between Streptococcus sobrinus and GIC surface with different roughness
3 讨论
3.1 AFM用于测量细菌黏附力的优势
分析材料表面细菌的黏附量是研究细菌对材料表面黏附的传统方法,包括细菌计数、SEM和荧光显微镜检测等,但这些方法受外界影响因素较多,准确性较差,且仅限于对材料表面细菌的定量和定性检测,并未涉及细菌的黏附行为和微观力学机制。1986年Binnig等[3]发明了AFM,可用于检测材料表面的原子级形貌、分子间及分子内作用力,并能测量材料表面纳米机械性质,如表面力、黏附能和黏弹性等。本实验采用AFM测量细菌对材料表面的黏附力有以下优势。1)分组明确。利用AFM采集到的样本表面图像为表面的三维数据,可构建三维立体图像,精确分析材料表面的粗糙度,本实验通过材料表面Ra值将样本进行严格分组,确保组间的差异性和实验的精确性;用SEM和表面轮廓仪等传统方法观察材料表面形貌时会损坏样本表面,而AFM进行表面形貌观察时,对样本表面毫无损坏,具有较大的优势。2)灵敏度高。AFM用于检测细菌黏附力时灵敏度高达pN(pN=10-12N)数量级,测量范围很大(10 pN到106pN),可在原子级尺度上直接检测微生物对材料表面的黏附力[4]。本实验主要利用AFM测量多个细菌与材料表面之间的黏附力,黏附力均在10 nN以内,除此之外,AFM还可用于测量单细胞与材料表面的黏附力及细菌间的黏附力,将细菌黏附机制的研究推进到了分子生物水平。3)数据精确度高。本实验先将细菌固定在探针表面,探针表面的细菌与材料相接触,AFM将探针表面细菌与材料表面接触时悬臂梁的弹性形变转化为力—距曲线,通过分析力—距曲线能够计算出微生物与固体材料表面之间以及微生物之间的作用力[5]。4)可实现原位测量。通过调节黏附缓冲液的成分、温度和pH值,可以最大程度地模拟生物自然生长环境,实现原位测量,并且探针的作用力不会破坏细菌表面结构。
3.2 材料表面粗糙度对细菌黏附的影响
粗糙的表面能够促进细菌的黏附,粗糙度对黏附力的影响大于材料表面能和疏水性。在本实验中,4种细菌都表现出了相似的趋势,细菌对两种材料表面的黏附力均与粗糙度呈正相关,材料表面粗糙度对致龋菌的影响小于先锋菌。Mei等[6]实验结果表明,细菌对材料表面的黏附力随材料粗糙度的增加而相应变大;Taylor等[7]的研究也发现,粗糙度轻微增加就会引起细菌黏附力大幅度变大。在黏附力测量过程中,探针对细菌表面施加了垂直向下的压力,柔软的细菌表面会发生形变,形变的部分会陷入表面轮廓中,使细菌的有效接触面积明显增大,细菌表面黏附分子的接触位点明显增加,黏附力相应增加。粗糙表面的表面积及容积会显著增加,故能为细菌提供更大的黏附面积,同时,粗糙表面凹陷深度的增加也能够为细菌提供庇护作用,为细菌的生存提供空间,从而促进表面细菌的黏附。细菌更容易黏附在凹痕与菌细胞直径相近的材料表面。Verran 等[8]实验结果表明,当样本表面的凹痕比菌细胞大时,细菌的黏附力反而减少,这可能是由于探针的形变有限,当凹痕垂直高度过大时,部分细菌不能接触到,就不能提供更大的有效接触面积。故在某些实验中会出现一个粗糙度阈值(Ra=200 nm),当材料表面粗糙度超过阈值时,由于材料表面的有效接触面积变小,细菌的黏附力反而会下降。Wang 等[9]利用磷酸将釉质处理成不同的粗糙度表面,实验结果表明在200 nm时细菌对釉质的黏附力达到最大值,在300 nm时细菌的黏附力反而下降。Quirynen 等[10]的实验发现,钛表面也存在该阈值,当钛表面的粗糙度超过这一阈值时,细菌的黏附力不再继续增加。本实验未出现阈值,可能与材料表面的划痕直径并未超过细菌直径有关。与此相反,也有实验[11]发现材料表面粗糙度必须大于200 nm才会对细菌的黏附和定植造成重要影响;当材料表面粗糙度低于200 nm时,细菌的黏附量不会明显减少[12],这可能是因为粗糙度较大的表面凸起能够明显减小表面液体流动产生的水平剪切力,可以形成有利于生物膜生长的静态水力学环境,帮助细菌抵抗外界的清除力量,促进生物膜在粗糙表面快速生长和成熟。
3.3 先锋菌和致龋菌黏附力的差异
本实验选取了先锋菌和致龋菌各两种,总体来说,对两种材料而言,先锋菌的黏附力要大于致龋菌,特别是在200 nm和300 nm时差异更加明显,Wang等[9]的实验也表明先锋菌在各种材料表面的黏附力均要大于致龋菌。牙菌斑生物膜的形成是十分复杂的动态过程,大致可分为3个阶段:获得性薄膜的形成、细菌的黏附和聚集及菌斑的成熟。先锋菌最先定植在牙体和材料表面,致龋菌不直接黏附在牙体和材料表面,而是通过与已经定植在表面的先锋菌发生共聚,形成分层结构,继而发育为成熟的生物膜,故表面粗糙度对致龋菌的影响小于先锋菌。细菌对牙面和材料表面的黏附是菌斑生物膜形成的关键步骤,本实验中的4种细菌在菌斑生物膜的形成过程中都有重要作用。先锋菌表面大量的黏附素能与牙面和材料表面唾液薄膜中的受体结合,并为后续致龋菌的黏附提供受体,有利于菌斑生物膜的生长[13],因此,先锋菌必须要有更强的黏附力,才能抵抗口腔内各种剪切力,使得后续细菌能牢固黏附在牙面和材料表面,在菌斑生物膜的形成过程中起到重要的桥梁作用。致龋菌与先锋菌产生共聚后,能够分泌某些代谢物,使得先锋菌数量减少,成为菌斑生物膜中的主要细菌,致龋菌通过代谢作用能产生多种酸性物质,导致周围环境pH值降低,促进龋病的发生[14]。
3.4 复合树脂和GIC表面细菌黏附力的差异
在本实验中,口腔细菌对树脂的黏附力略大于GIC,在粗糙度较大的时候差异较明显。研究[15]发现,GIC表面的变异链球菌生物膜量明显小于树脂表面,GIC能抑制细菌的生长和菌斑生物膜的形成。复合树脂和GIC是临床上常用的窝洞充填材料,同时,继发龋是引起充填失败的主要原因之一。GIC是一种具有抗菌作用的充填材料,与牙本质-牙髓复合体有良好的生物相容性,其抗菌性主要来源于起始pH值较低和材料中氟的持续释放,氟能够促进牙体再矿化,并能在酸性环境中抑制致龋菌酸性代谢物的产生,影响致龋菌的代谢和生长[15]。此外,GIC还能与牙本质和釉质进行化学黏附和离子交换[16],这些行为都能减少口腔细菌的黏附。本实验选用的富士IX型GIC中还含有锶元素,该元素能促进牙体组织再矿化,与氟具有协同抗菌作用[17]。目前,商业化的树脂主要是由疏水性的基质和填料组成,含有微量(例如亲水性的聚氧化乙烯)或者不含抗菌成分,因此商业化树脂都没有抗菌性能。当树脂固化不完全时,其中的二甲基丙烯酸乙二醇酯和二甲基丙烯酸三甘醇酯还能促进细菌的生长,如溶血性链球菌、表兄链球菌和乳酸杆菌[18]。葡糖基转移酶(glucosyltransferase,GTF)在细菌代谢中有重要作用,能将蔗糖转化为葡聚糖,促进细菌的黏附[19]。树脂能提高细菌GTF的活性,三甘醇在生物膜形成过程中能调节GTF的表达。因此,有研究者试图通过抗菌材料改性获得生物性能和机械性能双优的材料。如Saku等[16]通过在普通树脂中添加预烧结的玻璃离子微颗粒,使得树脂具有释放氟的功能,与普通树脂相比,这种改良树脂在体内外实验的抗菌性能均较好。
本实验结果表明,牙体充填材料表面粗糙度是影响口腔细菌黏附定植的一个重要因素。为了减少细菌的黏附量和生物膜的形成,降低继发龋的发生,临床充填体应做到尽可能地抛光;GIC的抗菌性能优于树脂,可用于指导牙体充填材料的改性。此外,人体口腔环境复杂,唾液[6]、温度和pH值等都会影响细菌的黏附及生物膜的形成,因此,需要进一步考虑生理环境对口腔细菌和充填材料之间黏附的影响,从而更好地控制细菌的黏附和继发龋的发生。
[1] 樊明文. 牙体牙髓病学[M]. 4版. 北京: 人民卫生出版社, 2012:3-10.
Fan MW. Operative dentistry and endodontics[M]. 4th ed. Beijing: People’s Medical Publishing House, 2012:3-10.
[2] Melo MA, Cheng L, Weir MD, et al. Novel dental adhesive containing antibacterial agents and calcium phosphate nanoparticles[J]. J Biomed Mater Res Part B Appl Biomater, 2013, 101(4):620-629.
[3] Binnig G, Quate CF, Gerber C. Atomic force microscope [J]. Phys Rev Lett, 1986, 56(9):930-933.
[4] Helenius J, Heisenberg CP, Gaub HE, et al. Single-cell force spectroscopy[J]. J Cell Sci, 2008, 121(11):1785-1791.
[5] Busscher HJ, Geertsema-Doornbusch GI, van der Mei HC. Adhesion to silicone rubber of yeasts and bacteria isolated from voice prostheses: influence of salivary conditioning films[J]. J Biomed Mater Res, 1997, 34(2):201-209.
[6] Mei L, Busscher HJ, van der Mei HC, et al. Influence of surface roughness on streptococcal adhesion forces to composite resins[J]. Dent Mater, 2011, 27(8):770-778.
[7] Taylor RL, Verran J, Lees GC, et al. The influence of substratum topography on bacterial adhesion to polymethyl methacrylate[J]. J Mater Sci Mater Med, 1998, 9(1):17-22.
[8] Verran J, Whitehead KA. Assessment of organic materials and microbial components on hygienic surfaces[J]. Food Bioprod Process, 2006, 84(4):260-264.
[9] Wang C, Zhao Y, Zheng S, et al. Effect of enamel morphology on nanoscale adhesion forces of streptococcal bacteria: an AFM study[J]. Scanning, 2015, 37(5):313-321.
[10] Quirynen M, Bollen CM, Papaioannou W, et al. The influence of titanium abutment surface roughness on plaque accumulation and gingivitis: short-term observations[J]. Int J Oral Maxillofac Implants, 1996, 11(2):169-178.
[11] Tang H, Cao T, Liang X, et al. Influence of silicone surface roughness and hydrophobicity on adhesion and colonization of Staphylococcus epidermidis[J]. J Biomed Mater Res A, 2009, 88(2):454-463.
[12] Bollen CM, Lambrechts P, Quirynen M. Comparison of surface roughness of oral hard materials to the threshold surface roughness for bacterial plaque retention: a review of the literature[J]. Dent Mater, 1997, 13(4):258-269.
[13] Okahashi N, Nakata M, Terao Y, et al. Pili of oral Streptococcus sanguinis bind to salivary amylase and promote the biofilm formation[J]. Microb Pathog, 2011, 50(3/4):148-154.
[14] 于世凤. 口腔组织病理学[M]. 7版. 北京: 人民卫生出版社, 2014:160-164.
Yu SF. Oral histopathology[M]. 7th ed. Beijing: People’s Medical Publishing House, 2014:160-164.
[15] Nakajo K, Imazato S, Takahashi Y, et al. Fluoride released from glass-ionomer cement is responsible to inhibit the acid production of caries-related oral streptococci[J]. Dent Mater, 2009, 25(6):703-708.
[16] Saku S, Kotake H, Scougall-Vilchis RJ, et al. Antibacterial activity of composite resin with glass-ionomer filler particles [J]. Dent Mater J, 2010, 29(2):193-198.
[17] Krishnan V, Bhatia A, Varma H. Development, characterization and comparison of two strontium doped nano hydroxyapatite molecules for enamel repair/regeneration[J]. Dent Mater, 2016, 32(5):646-659.
[18] Wang Z, Shen Y, Haapasalo M. Dental materials with antibiofilm properties[J]. Dent Mater, 2014, 30(2):e1-e16.
[19] Gregoire S, Xiao J, Silva BB, et al. Role of glucosyltransferase B in interactions of Candida albicans with Streptococcus mutans and with an experimental pellicle on hydroxyapatite surfaces[J]. Appl Environ Microbiol, 2011, 77(18): 6357-6367.
(本文编辑 吴爱华)
Influence of surface roughness on oral streptococcal adhesion forces to dental filling materials
Zheng Sainan, Jiang Li, Zhang Lei, Hao Liying, Ye Lu, Li Wei.
(State Key Laboratory of Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Supported by: National Natural Science Foundation of China (31200720); The Ph.D. Programs Foundation of Ministry of Education of China (20120181120009); Sichuan Science and Technology Project (2016FZ0069). Correspondence: Li Wei, E-mail: leewei@scu.edu.cn.
Objective This study is to determine the common oral streptococcal adhesion forces by using composite resin and glass ionomer cement (GIC) with different degrees of surface roughness via atomic force microscopy (AFM) analysis. The influence of surface roughness on bacterial adhesion force is also discussed. Methods Polishing and grinding were applied to obtain 300, 200, 100, and 10 nm surfaces of light-cured composite resin and GIC samples. Surface topography was assessed by AFM analysis. Initial colonizers (Streptococcus sanguinis and Streptococcus mitis) and cariogenic bacterial strains (Streptococcus mutans and Streptococcus sobrinus) were used to obtain bacteria-modified AFM probes. The force-distance curves were also measured by AFM analysis to determine the adhesion forces of bacteria on the surfaces of the composite resin and GIC. Material surface roughness was analyzed using ANOVA, and adhesion forces were subjected to nonparametric analysis (Kruskal-Wallis test). Comparison among groups was performed by Dunn’s test. Material surface roughness and bacterial adhesion forces were subjected to correlation analysis. Results Bacterial adhesion forces increased with increasing material roughness. The adhesion forces of the four bacterial species reached the maximum on the material surface of 300 nm. The adhesion force of Streptococcus mutans increased from 0.578 nN to 2.876 nN on GIC surfaces with 10 and 300 nm roughness. The adhesion forces of the four species on the surface of the composite resin were stronger than that of GIC. The initial colonizers exhibited stronger adhesionforces to different materials than the cariogenic strains. Intergroup differences were evident on the 200 and 300 nm material surfaces. Conclusion The surface roughness of the material significantly affected the bacterial adhesion forces, and a significant linear correlation existed between both factors. The bacterial adhesion forces of the GIC were lower than that of the composite resin. Furthermore, surface roughness exhibited less influence on the cariogenic strains than that on the initial colonizers.
atomic force microscope; adhesion force; filling material; surface roughness; oral streptococcal
R 780.2
A [doi] 10.7518/hxkq.2016.05.003
2016-03-05;
2016-06-13
国家自然科学基金(31200720);教育部博士学科点新教师基金(20120181120009);四川省科技计划项目(2016FZ0069)
郑赛男,硕士,E-mail:zhsnmail@163.com
李伟,教授,博士,E-mail:leewei@scu.edu.cn

