脾络氨酸激酶-核因子κB 调控口腔癌相关巨噬细胞中癌痛相关环氧化酶2的机制研究
林洁王淼吉阳刘乐高攀李春洁
1.口腔疾病研究国家重点实验室 华西口腔医院口腔麻醉科(四川大学);2.头颈肿瘤外科,成都 610041
脾络氨酸激酶-核因子κB 调控口腔癌相关巨噬细胞中癌痛相关环氧化酶2的机制研究
林洁1王淼1吉阳1刘乐1高攀2李春洁2
1.口腔疾病研究国家重点实验室 华西口腔医院口腔麻醉科(四川大学);2.头颈肿瘤外科,成都 610041
目的 通过体外原代巨噬细胞诱导以及分子生物学的方法,探究口腔癌相关巨噬细胞环氧化酶2(COX-2)上调的机制。方法 构建小鼠原代巨噬细胞,使用Cal27条件培养基(CM)刺激诱导形成口腔癌相关巨噬细胞,使用免疫荧光检测原代巨噬细胞的纯度。使用小分子抑制剂分别抑制脾络氨酸激酶(Syk)及核因子κB(NFκB)通路。使用实时定量聚合酶链反应(PCR)、Western blot检测COX-2及信号通路相关蛋白的变化。结果 所诱导的原代巨噬细胞均特异性表达CD68蛋白。Cal27 CM刺激能够显著提高COX-2的表达(P<0.001);抑制Syk的磷酸化即能够进一步抑制NFκB-P65的磷酸化,从而导致COX-2的表达显著降低(P<0.01);而抑制NFκB-P65的磷酸化不能抑制Syk的磷酸化但可以显著降低COX-2的表达(P<0.01)。结论 Syk-NFκB信号通路导致COX-2在口腔癌相关的巨噬细胞中高表达,靶定该信号通路可能是控制口腔癌相关癌痛的新方向。
癌痛; 口腔癌; 环氧化酶2; 巨噬细胞
对于口腔癌患者来说,癌痛是常见的临床症状,其主要原因是由于口腔处于身体浅表且感觉灵敏,加之口腔是重要的功能性部位,因此,早期且剧烈的癌性疼痛难以避免[1]。传统的观点认为,癌痛发生的主要因素在于肿瘤细胞释放的细胞因子、生长因子中包含有疼痛介质进而引起疼痛,肿瘤生长、侵袭导致局部区域压迫性的疼痛,肿瘤侵犯神经或阻塞神经滋养血管导致神经性疼痛。近些年来,随着肿瘤微环境理论以及恶性肿瘤诱导正常间质细胞恶性演进理论的提出,研究者们认识到,不仅仅是肿瘤细胞,肿瘤间质中的其他细胞,特别是炎症细胞是导致口腔癌相关癌性疼痛的重要组成部分[2]。
肿瘤相关的巨噬细胞是口腔癌微环境中的主要炎性细胞,其环氧化酶2(cyclooxygenase-2, COX-2)在肿瘤微环境中高表达并且介导了大量巨噬细胞疼痛因子的分泌[3]。COX-2的表达是巨噬细胞促炎能力的表现,而巨噬细胞参与炎症主要受到核因子κB (nuclear factor κB, NFκB)、脾络氨酸激酶(spleen tyrosine kinase,Syk)等信号通路的调节[4]。因此,本文拟通过体外原代巨噬细胞诱导以及分子生物学的方法,探究NFκB及Syk信号通路与口腔癌相关巨噬细胞COX-2上调的关系及机制,进而寻找口腔癌相关癌痛控制的新途径。
1 材料和方法
1.1 试剂和仪器
DMEM/F12培养基、胎牛血清(fetal bovine serum,FBS)、10×PBS、胰蛋白酶(Gibco公司,美国),重组小鼠巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)(PeproTech公司,美国),40 μm细胞滤网(BD公司,美国),兔抗鼠COX-2抗体(Santa Cruz公司,美国),异硫氰酸荧光素(fluorescein isothiocyanate,FITC)直标兔抗鼠CD68抗体(Biolegend公司,美国),鼠抗鼠磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)抗体(Millipore公司,美国),鼠抗鼠Syk抗体、兔抗鼠磷酸化Syk抗体(Abcam公司,美国),鼠抗鼠p65抗体、兔抗鼠磷酸化p65抗体(Cell Signalling公司,美国),IRDey800直标羊抗兔IgG、IRDey800直标兔抗鼠IgG、IRDey800直标驴抗羊IgG(Rockland公司,美国),Bay11-7082、白皮杉醇(piceatannol,PIC)(上海Selleck公司),预染蛋白质相对分子质量标准液(Invitrogen公司,美国)。PureLink®RNA小量试剂盒(Life technologies公司,日本),逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒(TAKARA公司,日本),Sybrgreen(Biorad公司,美国),聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜(PALL公司,美国),细胞爬片器(Millipore公司,美国),Odyssey双色红外激光成像系统(LICOR公司,美国),Steri-Cycle 37 ℃ CO2培养箱(Thermo Scientific公司,美国),CFX96实时定量聚合酶链反应(polymerase chain reaction,PCR)检测系统(Biorad公司,美国)。
1.2 细胞培养及鉴定
人舌癌Cal27细胞株由四川大学口腔疾病研究国家重点实验室提供。使用含10%FBS的DMEM/F12培养基进行培养。提取Cal27条件培养基(conditional medium,CM)时,在细胞铺满80%时采用无血清的DMEM/F12培养基培养24 h后收集上清。
原代巨噬细胞的培养:麻醉下消毒C57BL/6J小鼠,取双侧股骨及胫骨,用消毒眼科剪剪开长骨两端关节,使用PBS液反复冲洗骨髓腔,使用40 μm滤网过滤。离心收集骨髓细胞,加入9 mL蒸馏水,吹打20 s去除红细胞,再加入1 mL 10×PBS液,再次使用40 μm滤网过滤,离心收集骨髓细胞,予50 ng·mL-1M-CSF加入含10%FBS的DMEM/F12培养基中培养,4 d后传代,继续予50 ng·mL-1M-CSF培养3 d,传代后即可使用。
传代后的巨噬细胞按照每孔8×105个铺6孔板,贴壁后饥饿24 h,然后分别加入1∶1 000二甲基亚砜(dimethyl sulfoxide,DMSO)、0.5 μmol·L-1NFκB抑制剂Bay11-7082(DMSO溶解)或25 μmol·L-1Syk小分子抑制剂PIC(DMSO溶解)刺激1 h,再予10% Cal27上清或正常培养基刺激,24 h后收集细胞蛋白;或者于1、3、6、12、24 h后收集mRNA。或者予正常培养基、5%、10%、20%、50%Cal27上清刺激,于6 h后收集mRNA。
1.3 免疫荧光染色
将第3代巨噬细胞按照每孔5×104个的密度加入细胞爬片器中,待贴壁后予10%Cal27上清或正常培养基刺激,刺激24 h后,取出细胞爬片,予丙酮固定1 min,PBS洗净后予5%牛血清白蛋白(bovine serum albumin,BSA)封闭1 h,然后加入FITC直标兔抗鼠CD68抗体(1∶100),常温孵育1 h,PBS清洗,DAPI染核后封片。
1.4 实时定量PCR
按PureLink®RNA小量试剂盒提取细胞mRNA,分光光度法测定RNA浓度后调平RNA浓度,按逆转录说明书将mRNA逆转录为cDNA。使用CFX96实时定量PCR检测系统检测mRNA的表达量。引物由日本Life technologies公司合成。COX-2上游引物序列:5’-GCCCAGCACTTCACGCATCAG-3’;下游引物序列:5’-AGACCAGGCACCAGACCAAAGACC-3’;GAPDH上游引物序列:5’-TGCTGAGTATGTCGTGGAGTCTA-3’;下游引物序列:5’-AGTGGGAGTTGCTGTTGAAATC-3’。用各组mRNA与GAPDH的Ct值的差值表示各组mRNA的相对表达量。
1.5 Western blot
将蛋白样品及预染蛋白质相对分子质量标准液分别上样到十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)胶加样孔后,使用60 V低电压恒压电泳,待蛋白相对分子质量标准液分离开后即更换为120 V高电压恒压电泳,待溴酚蓝到达胶的底端处停止电泳。使用Bio-Rad的标准湿式转膜装置,设定转膜电压为120 V,转膜时间为90 min,将蛋白转移到PVDF膜上。用10%BSA/TBST溶液封闭1 h,然后加入靶蛋白一抗(比例1∶1 000),4 ℃孵育过夜;TBST洗膜3次后,加入相应二抗常温孵育1 h;TBST洗膜3次后扫膜。使用ImageJ软件进行定量分析,以GAPDH作为内参。
1.6 统计学分析
使用GraphPad Prism 5(GraphPad Software公司,美国)进行单因素及多因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 原代巨噬细胞体外培养的鉴定及口腔癌相关巨噬细胞的形态观察
使用巨噬细胞特异的CD68标记原代巨噬细胞并进行免疫荧光染色,结果显示,使用M-CSF培养的原代巨噬细胞纯度高,且均特异性表达CD68。Cal27上清刺激24 h后,巨噬细胞变为长梭形,符合肿瘤相关巨噬细胞的形态特征[5](图1)。
2.2 Cal27 CM刺激原代巨噬细胞上调COX-2的检测2.2.1 时间依赖试验结果 使用10%Cal27 CM刺激原代巨噬细胞后巨噬细胞COX-2 mRNA表达不断上调,于6 h后达到高峰。3、6、12 h时,COX-2 mRNA较对照组相比明显上调(P<0.001)(图2)。
2.2.2 剂量依赖试验结果 10%~50%Cal27 CM均能够明显提高COX-2 mRNA的表达(P<0.001),且10%、20%、50%的浓度之间并无显著差异(图3),故后续研究均采用10%Cal27 CM进行。
2.3 Syk-NFκB信号通路参与调控COX-2的表达
使用PIC以及Bay11-7082分别作用于口腔癌相关巨噬细胞,使用Western blot检测其对COX-2的表达影响,结果显示,PIC和NFκB抑制剂均能够显著降低COX-2的表达(P<0.01)(图4)。
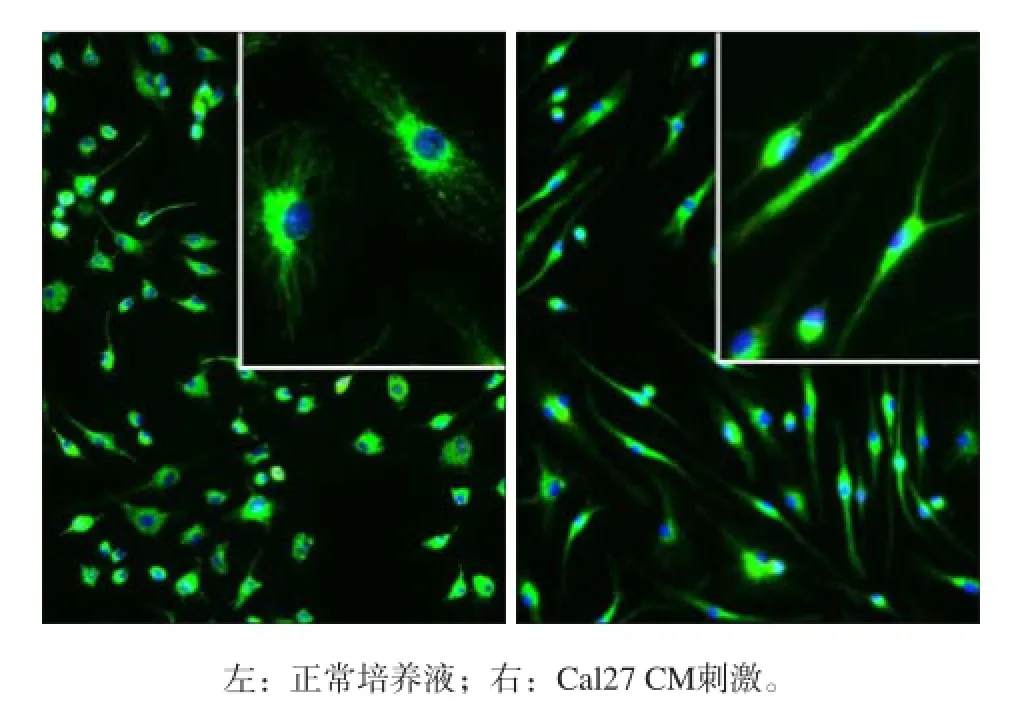
图 1 FITC-CD68免疫荧光染色检验原代巨噬细胞纯度 免疫荧光显微镜 × 200Fig 1 Purity of primarily cultured macrophage detected by FITC- CD68 immunofluorescent staining immunofluorescence microscope × 200
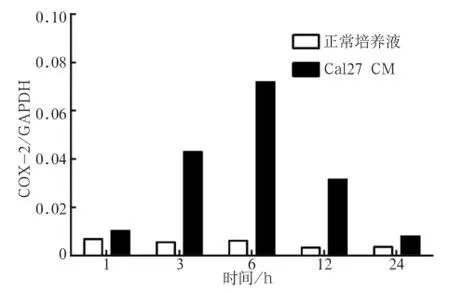
图 2 Cal27 CM刺激后COX-2 mRNA的表达变化Fig 2 COX-2 mRNA expression after Cal27 CM stimulation
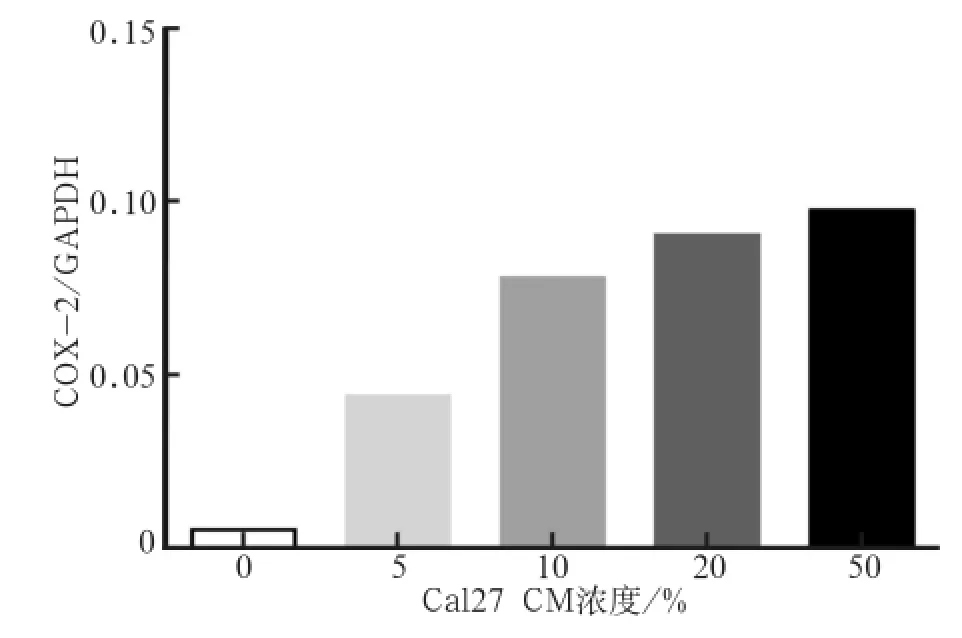
图 3 不同浓度Cal27 CM刺激后COX-2 mRNA的表达变化Fig 3 COX-2 mRNA expression after different concentration Cal27 CM stimulation
Western blot结果显示,使用PIC能够显著减少Syk的磷酸化进而达到抑制Syk信号通路的作用,同时,Syk信号通路的抑制能够减少P65总蛋白以及磷酸化的P65。而Bay11-7082仅能够通过抑制pP65而对pSyk及Syk无显著作用。由此可见,在口腔癌微环境中,口腔癌相关巨噬细胞通过Syk磷酸化激活NFκB,进而导致COX-2表达上调。
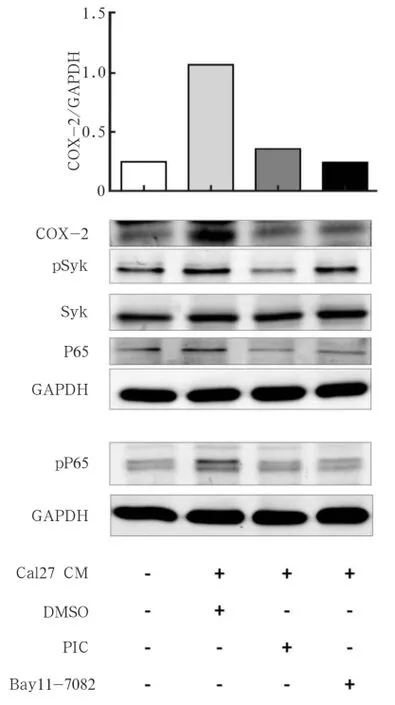
图 4 Syk及NFκB抑制剂处理后COX-2及信号通路相关蛋白的变化Fig 4 Changes of COX-2 and pathway related proteins after Syk and NFκB inhibitor stimulation
3 讨论
口腔癌引发的癌痛严重影响患者口腔功能,同时,使其生存质量明显下降。虽然目前针对癌痛已有规范化的“三阶梯治疗”原则[6];然而,目前的治疗方法对口腔癌相关癌痛的控制仍然不够理想,并且各阶梯治疗方法均会给患者带来明显的不良反应[7]。因而,寻找口腔癌相关癌痛的新的治疗方式势在必行,而寻找有效治疗方式的前提则是需要明确口腔癌相关癌痛的发生机制。
癌痛的发生发展机制仍不十分清楚,尤其在口腔癌领域,对癌痛的研究仍处于起步阶段[8]。从目前的研究热点来说,分别靶定恶性肿瘤细胞以及肿瘤微环境导致的癌痛从而寻找新的治疗方式是目前研究的重点。肿瘤细胞通过间质细胞构建肿瘤微环境,进而导致肿瘤压迫或侵犯神经,分泌疼痛因子,导致癌痛。而肿瘤本身对疼痛因子分泌较晚,而且,相对于间质细胞来说,分泌量也比较小,因此,肿瘤微环境中大量的疼痛因子主要来自于间质细胞,特别是炎症细胞[9]。巨噬细胞是肿瘤微环境中主要的炎症细胞之一,由于其在促进肿瘤发生发展过程中有重要的功能,因此,又名肿瘤相关巨噬细胞[10]。这些巨噬细胞是免疫-神经交互作用中十分重要的一环,因而其对于疼痛的作用也受到了学者的关注[11]。
早前的研究[12]表明,疼痛小鼠模型中的巨噬细胞被选择性清除后,疼痛的进展明显延缓。这说明巨噬细胞是疼痛发生和发展的必要因素。进一步的研究[13]显示,巨噬细胞分泌的前列腺素2(prostaglandin E2,PGE2)是疼痛发生和发展过程中的重要因素,当巨噬细胞COX-2基因被选择性敲除后,其分泌的PGE2、肿瘤坏死因子α和白细胞介素(interleukin,IL)1β等疼痛介质明显下降,疼痛小鼠模型的检测结果表明,巨噬细胞分泌的PGE2与疼痛显著相关。虽然目前大量研究[14]显示,巨噬细胞分泌的IL-18等对促进癌痛具有一定作用,然而,目前经体内外研究及临床研究共同证实的仅有COX-2及其下游细胞因子。
巨噬细胞中的COX-2是催化花生四烯酸加氧形成PGE2的主要环节。目前控制癌痛的第一阶梯治疗即是通过COX抑制剂抑制COX-2功能,进而减少PGE2的产生以控制疼痛。然而,第一阶梯治疗往往带来较大不良反应,因而,寻找新的途径抑制COX-2是癌痛控制的新途径[15]。
COX-2在肿瘤相关巨噬细胞中的高表达早已有报告,其不仅维持肿瘤相关巨噬细胞表型同时与巨噬细胞来源的疼痛因子的产生密切相关[16];然而,COX-2高表达的机制尚不十分清楚[17]。尤其是在口腔癌的研究中,尚无报告涉及口腔癌相关巨噬细胞COX-2的表达机制。
本研究通过使用小分子抑制剂对Syk及NFκB进行抑制,并通过实时定量PCR和Western blot等方式检测巨噬细胞COX-2的表达,结果发现,抑制Syk的磷酸化即能够进一步抑制NFκB-P65的磷酸化,从而导致COX-2的表达明显降低;而抑制NFκB-P65的磷酸化不能抑制Syk的磷酸化但可以降低COX-2的表达。由此可见,在口腔癌微环境中,巨噬细胞通过上调Syk的磷酸化从而激活NFκB信号通路进而导致COX-2表达上调。
Syk及NFκB信号通路参与调控人体多种重要的功能,其在癌症研究中有十分重要的地位,Syk信号通路的激活能够显著提升肿瘤的侵袭及转移能力[17];NFκB的激活也与肿瘤进展密切相关[18]。而在肿瘤微环境中,Syk-NFκB构成的信号通路与癌痛密切相关,它们不仅调节COX-2的表达,同时与疼痛因子的表达及分泌密切相关;Syk一般与膜上的Fc受体结合,激活后被磷酸化,通过与CAD9结合后导致NFκB的激活并入核,从而引起下游变化;简单抑制NFκB往往会引起较大副作用,因此,靶定Syk信号通路进而抑制其引发的NFκB的激活能够取得更好的效果。因此,一些Syk抑制剂已被考虑运用到临床恶性肿瘤的治疗中[19]。目前,临床上已出现靶向控制Syk信号通路激活以抑制其他疾病相关疼痛的药物[20],因此,该通路可能为癌痛控制提供新的方向。下一步的研究需要明确引发口腔癌相关巨噬细胞COX-2上调的整个信号通路的具体情况,如明确胞外配体、包膜受体以及胞内信号传导的具体方式,为临床控制肿瘤相关巨噬细胞引发的癌痛提供更多的选择。
综上所述,本研究显示,Syk-NFκB信号通路导致COX-2在口腔癌相关的巨噬细胞中高表达,靶定该信号通路可能是控制口腔癌相关癌痛的新方向。
[1] Reyes-Gibby CC, Anderson KO, Merriman KW, et al. Survival patterns in squamous cell carcinoma of the head and neck: pain as an independent prognostic factor for survival [J]. J Pain, 2014, 15(10):1015-1022.
[2] Schmidt BL, Hamamoto DT, Simone DA, et al. Mechanism of cancer pain[J]. Mol Interv, 2010, 10(3):164-178.
[3] Mantyh PW, Clohisy DR, Koltzenburg M, et al. Molecular mechanisms of cancer pain[J]. Nat Rev Cancer, 2002, 2(3): 201-209.
[4] Yamasaki S, Ishikawa E, Sakuma M, et al. Mincle is an ITAM-coupled activating receptor that senses damaged cells[J]. Nat Immunol, 2008, 9(10):1179-1188.
[5] Su S, Liu Q, Chen J, et al. A positive feedback loop between mesenchymal-like cancer cells and macrophages is essential to breast cancer metastasis[J]. Cancer Cell, 2014, 25(5):605-620.
[6] Kaasa S. Is cancer pain control improved by a simple WHO pain analgesic ladder approach combined with tumor-directed treatment[J]. J Clin Oncol, 2016, 34(5):399-400.
[7] Viet CT, Dang D, Ye Y, et al. Demethylating drugs as novel analgesics for cancer pain[J]. Clin Cancer Res, 2014, 20(18): 4882-4893.
[8] Connelly ST, Schmidt BL. Evaluation of pain in patients with oral squamous cell carcinoma[J]. J Pain, 2004, 5(9):505-510.
[9] Cools-Lartigue JJ, Lewandowski E, Chernin TS, et al. The expression of prostaglandin E2 (PGE2) and interleukin 6 (IL-6) in macrophage and uveal melanoma conditioned media [J]. Invest Ophthalmol Vis Sci, 2003, 44(13):1560.
[10] Noy R, Pollard JW. Tumor-associated macrophages: from mechanisms to therapy[J]. Immunity, 2014, 41(1):49-61.
[11] Ristoiu V. Contribution of macrophages to peripheral neuropathic pain pathogenesis[J]. Life Sci, 2013, 93(23):870-881.
[12] Mert T, Gunay I, Ocal I, et al. Macrophage depletion delays progression of neuropathic pain in diabetic animals[J]. Naunyn Schmiedebergs Arch Pharmacol, 2009, 379(5):445-452.
[13] Chen L. Macrophage prostaglandin E2 mediates inflammatory pain in peripheral tissues[J]. J Pain, 2013,14(4):S72.
[14] Yang Y, Li H, Li TT, et al. Delayed activation of spinal microglia contributes to the maintenance of bone cancer pain in female Wistar rats via P2X7 receptor and IL-18[J]. J Neurosci, 2015, 35(20):7950-7963.
[15] Epstein JB, Thariat J, Bensadoun RJ, et al. Oral complications of cancer and cancer therapy: from cancer treatment to survivorship[J]. CA Cancer J Clin, 2012, 62(6):400-422.
[16] Nakanishi Y, Nakatsuji M, Seno H, et al. COX-2 inhibition alters the phenotype of tumor-associated macrophages from M2 to M1 in ApcMin/+ mouse polyps[J]. Carcinogenesis, 2011, 32(9):1333-1339.
[17] Luangdilok S, Box C, Patterson L, et al. Syk tyrosine kinase is linked to cell motility and progression in squamous cell carcinomas of the head and neck[J]. Cancer Res, 2007, 67 (16):7907-7916.
[18] Nagel S, Ehrentraut S, Meyer C, et al. NFkB is activated by multiple mechanisms in hairy cell leukemia[J]. Genes Chromosomes Cancer, 2015, 54(7):418-432.
[19] Borge M, Remes Lenicov F, Nannini PR, et al. The expression of sphingosine-1 phosphate receptor-1 in chronic lymphocytic leukemia cells is impaired by tumor microenvironmental signals and enhanced by piceatannol and R406[J]. J Immunol, 2014, 193(6):3165-3174.
[20] Weinblatt ME, Kavanaugh A, Genovese MC, et al. Effects of fostamatinib (R788), an oral spleen tyrosine kinase inhibitor, on health-related quality of life in patients with active rheumatoid arthritis: analyses of patient-reported outcomes from a randomized, double-blind, placebo-controlled trial [J]. J Rheumatol, 2013, 40(4):369-378.
(本文编辑 杜冰)
In vitro investigation on the mechanism of cyclooxygenase-2 upregulation induced by spleen tyrosine kinase-nuclear factor κB signaling in cancer pain caused by oral cancer-associated macrophage
InLin Jie1, Wang Miao1, Ji Yang1, Liu Le1, Gao Pan2, Li Chunjie2.
(1. State Key Laboratory of Oral Diseases, Dept. of Dental Anesthesia, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China; 2. State Key Laboratory of Oral Diseases, Dept. of Head and Neck Oncology, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Supported by: Scientific Research Foundation for Young Teachers of Sichuan University (2014SCU11032); Scientific Research Foundation for Young Investigators of West China Hospital of Stomatology, Sichuan University (2015-06). Correspondence: Li Chunjie, E-mail: lichunjie@scu.edu.cn.
Objective This study explores the mechanism of cyclooxygenase-2 (COX-2) upregulation in oral cancers associated with macrophage by using molecular biology techniques and primary culture of murine macrophage. Methods Murine macrophage was induced by macrophage colony-stimulating factor (M-CSF) and Cal27 conditional medium (CM). Purity of the macrophage was detected through CD68 immunofluorescence staining. Inhibitors of spleen tyrosine kinase (Syk) and nuclear factor κB (NFκB) were used to inhibit these pathways. In addition, real-time polymerase chain reaction and Western blot analysis were used to detect alterations in COX-2 and pathway-related proteins. Results All of the induced cells specifically expressed CD68. Cal27 CM could significantly induce COX-2 expression (P<0.001). Moreover, inhibition of Syk pathway attenuated NFκB-P65 phosphorylation and reduced COX-2 expression (P<0.01), and inhibition of NFκB pathway exerted no effects on Syk phosphorylation but significantly inhibited COX-2 upregulation (P<0.01). Conclusion Syk-NFκB is responsible for COX-2 overexpression in oral cancer associated with macrophages. Targeting this pathway is possibly a new approach to control oral cancer-related pain.
cancer pain; mouth neoplasm; cyclooxygenase-2; macrophage
R 739.8
A [doi] 10.7518/hxkq.2016.05.004
2016-03-16;
2016-07-12
2014年四川大学青年教师科研启动基金(2014SCU1103-2);2015年四川大学华西口腔医院青年科学研究基金(2015-06)
林洁,主治医师,硕士,E-mail:514541402@qq.com
李春洁,副教授,博士,E-mail:lichunjie@scu.edu.cn

