南方红豆杉根际解有机磷细菌的鉴定及其解磷特性和促生作用研究
晋婷婷,任嘉红,刘瑞祥
(长治学院 生物科学与技术系,山西长治 046011)
南方红豆杉根际解有机磷细菌的鉴定及其解磷特性和促生作用研究
晋婷婷,任嘉红*,刘瑞祥
(长治学院 生物科学与技术系,山西长治 046011)
以分离自南方红豆杉根际的1株解有机磷细菌JYD-4为研究对象,对其进行分类鉴定;采用钼锑抗比色法研究JYD-4菌种在不同碳源、氮源和pH条件下的解有机磷能力;提取JYD-4菌株磷酸酯酶,测定在不同温度和pH作用下的磷酸酯酶活性;采用温室盆栽试验研究JYD-4菌株对南方红豆杉实生苗的促生长作用。结果表明:(1)分离自南方红豆杉根际的解有机磷细菌JYD-4为嗜麦寡养单胞菌(Stenotrophomonasmaltophilia)。(2)菌株JYD-4在卵黄固体培养基上产生的解磷圈与菌落直径比为2.01,在液体培养基中的解磷量为72.38 mg/L。(3)菌株JYD-4解磷最适碳源为葡萄糖,最适氮源为牛肉膏,最适pH 7.0。(4)菌株JYD-4产生的磷酸酯酶主要为胞内酶,该酶在20℃~65 ℃温度范围均能发挥较高酶活性,但仅能在pH 9.0条件下产生较高酶活性。(5)菌株JYD-4接种能够明显提高南方红豆杉实生苗的苗高、地径和生物量。研究表明,嗜麦寡养单胞菌JYD-4是一株高效解有机磷细菌,主要分泌碱性磷酸酯酶,对南方红豆杉具有明显的促生长作用;该研究为南方红豆杉微生物肥料的开发提供了优良的菌种资源,为该菌种的进一步开发应用提供了理论依据。
解有机磷细菌;南方红豆杉;嗜麦寡养单胞菌;解磷特性;磷酸酯酶;促生效果
南方红豆杉(Taxuschinensisvar.mairei)属红豆杉科(Taxaceae)红豆杉属(Taxus)植物,是集观赏、材用、药用为一身的珍稀植物树种,为国家一级重点保护野生植物[1]。南方红豆杉为新生代第一纪孑遗植物,由于该树种可提取新型抗癌药物紫杉醇而倍受世人关注。然而,由于红豆杉植株在自然条件下生长缓慢,植株体内紫杉醇含量极低,导致中国红豆杉属植物野生资源遭到了严重破坏,有的地方甚至濒临灭绝。因此,如何保护、开发和利用红豆杉资源,实现紫杉醇产业的可持续发展,已成为亟需解决的重要课题。
磷是植物生长发育的重要物质基础,是植物体内核酸及多种酶、辅酶、ATP等的重要组成成分。植物体需要的磷主要是从土壤中获得,但中国耕地土壤中95%以上的磷为无效形式,植物很难直接吸收利用。因此,提高植物对土壤中难溶性磷的吸收对于提高植物生物量至关重要。大量研究表明,土壤与植物根际存在大量微生物,能够将植物难以吸收利用的磷转化为可吸收利用的形态,称为解磷菌或溶磷菌(phosphate-solubilizing microbiology),其按照分解底物的不同又可分为溶无机磷微生物和解有机磷微生物[2]。其中,能够专一性分解有机磷化合物的细菌称为解有机磷细菌。它们通过分泌有机磷降解酶[3-4],将土壤中有机磷化合物转化为植物能够吸收利用的可溶性磷,增加植物对磷元素的吸收,从而促进植物的生长,该过程也被称为有机磷的矿化作用。1935年,前苏联学者蒙金娜从土壤中分离到1株能够分解核酸和卵磷脂的巨大芽孢杆菌,并于1947年大量生产使用,接种后明显提高了土壤中有效磷含量。此后,国内外相关学者先后从小麦[5-6]、水稻、西红柿、月季、玉米、白桦树[7]、黑麦草、白三叶草、燕麦、黄羽扇豆[6]以及葡萄[8-9]等植物根际分离得到了多株解有机磷细菌,包括假单胞菌(Pseudomonassp.)、芽孢杆菌(Bacillussp.)、不动杆菌(Acinetobactersp.)、寡养单胞菌(Stenotrophomonassp.)、肠杆菌(Enterobactersp.)、根瘤菌(Rhizobiumsp.)、节杆菌(Arthrobactersp.)、土壤杆菌(Agrobacteriumsp.)等。前期研究发现,解磷菌主要通过产生磷酸酯酶对有机磷化合物进行降解[10]。
目前,对解磷菌的研究和应用主要集中在农作物上,在林业上的研究还相对较少,对珍稀树种南方红豆杉根际解磷菌的研究更是少见。因此,为了提高南方红豆杉的生长繁殖能力,本研究以1株分离自南方红豆杉根际土壤中的高效解有机磷细菌为对象,对其进行菌种鉴定、解磷特性分析和解磷机制初探。同时,探讨了该菌种在温室条件下对南方红豆杉实生苗生长的影响。旨在为该解磷菌在南方红豆杉生物肥料上的开发应用提供理论参考。
1 材料和方法
1.1实验材料
菌株JYD-4分离自山西省长治市太行山大峡谷南方红豆杉根际土壤中,该菌种现已保藏于中国典型培养物保藏中心(保藏编号M2012264)。南方红豆杉(Taxuschinensisvar.mairei)为1年生盆栽实生苗,栽培于山西省长治市林业局苗圃大棚内。
培养基包括:(1)牛肉膏蛋白胨培养基:配方为牛肉膏3 g/L、蛋白胨10 g/L、NaCl 5 g/L,pH 7.2~7.4。(2)卵黄固体培养基:配方为牛肉膏3 g/L、蛋白胨10 g/L、NaCl 5 g/L、琼脂粉15~18 g/L,pH 7.0,灭菌,培养基温度降至50 ℃左右时,每50 mL中加入3~4 mL新鲜蛋黄液,混匀,倒平板。(3)蒙金娜培养基:组成为葡萄糖10 g/L,(NH4)2SO40.5 g/L,NaCl 0.3 g/L,KCl 0.3 g/L,MgSO4·7H2O 0.3 g/L,FeSO4·7H2O 0.03 g/L,MnSO4·4H2O 0.03 g/L,卵磷脂0.4 g/L,CaCO35 g/L,pH 7.0。(4)PDA培养基:马铃薯去皮后切成小块,称取200 g,加水煮烂,用纱布过滤,加入葡萄糖20 g,琼脂粉15~20 g,继续加热搅拌混匀,稍冷却后再补足水分至1 000 mL,分装,灭菌。
1.2菌株形态、生理生化特性分析及分子鉴定
对菌株JYD-4进行平板划线,分离单菌落,观察菌落形态特征(菌落大小、颜色、透明度、表面光滑程度、边缘整齐程度等)。菌体的革兰氏染色参见《微生物学实验》教材[11],通过光学显微镜观察菌体形态。菌体的氧化酶反应、KOH、吲哚试验、明胶液化、硝酸还原、产氨和硫化氢试验等生化特性鉴定参见《常见细菌系统鉴定手册》[12]。基因组DNA的提取参见Chen等[13]方法。使用16S rDNA扩增通用引物(27F 5′-AGAGTTTGATCCTGGCTCAG-3′;1492R 5′-GGTTACCTTGTTACGACTT-3′)扩增16S rDNA序列。PCR扩增条件为:95 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min ,30个循环后,72 ℃延伸10 min。1.5%琼脂糖凝胶电泳检测PCR产物后,使用天根普通DNA产物纯化试剂盒进行纯化。PCR纯化产物连接至pMD19-T(Takara)载体上,转入大肠杆菌DH5α。筛选阳性克隆,送至北京华大基因进行测序。16S rDNA 序列测定后与GenBank数据做相似度分析。取相似度较高的菌株的16S rDNA序列,利用CLUSTALW软件[14]进行比对,利用MEGA 6.0[15]软件构建系统发育树。
1.3菌株解磷能力测定
1.3.1平板解磷能力将菌株单菌落接种于卵黄培养基平板上,30 ℃培养3 d后,测量解磷圈与菌落直径,并计算解磷圈与菌落直径之比。
1.3.2液体解磷能力将菌株单菌落接种于牛肉膏蛋白胨培养基中,30 ℃培养2 d后,10 000 r/min离心1 min,无菌水重悬菌体沉淀。实验组取1 mL菌悬液接种于含50 mL蒙金娜培养基的100 mL三角瓶中,对照组接种1 mL灭菌菌悬液。30 ℃、180 r/min振荡培养。分别取培养至1~7 d的培养液,4 ℃、10 000 r/min离心10 min,取上清,使用钼锑抗比色法测定上清液中可溶性磷含量[16]。以实验组和对照组中可溶性磷含量的差值作为受试菌株的解磷量,其单位为mg/L。本部分以及之后的解磷能力测定均设置3个重复。
1.3.3不同碳源下解磷能力以(NH4)2SO4为氮源,分别用葡萄糖、蔗糖、果糖、半乳糖、甘油和可溶性淀粉作为碳源(各碳源浓度均为10 g/L),测定解磷量。
1.3.4不同氮源下解磷能力以葡萄糖为碳源,分别用(NH4)2SO4、NH4Cl、NaNO3、KNO3、尿素和牛肉膏作为氮源(各氮源浓度均为0.5 g/L),测定解磷量。
1.3.5不同初始pH值下解磷能力以葡萄糖为碳源,(NH4)2SO4为氮源,分别调节蒙金娜培养基pH至6.5、7.0、7.5、8.0、8.5、9.0和9.5,将菌株JYD-4分别接种至不同pH蒙金娜培养基中,测定解磷量。
1.4磷酸酯酶活性测定
1.4.1磷酸酯酶的提取和活性测定取蒙金娜培养基中培养5 d的菌液,6 000 r/min下离心10 min,上清(S1)置于4 ℃保存;使用10 mL 10 mmol/L Tris-HCl(pH 8.0)重悬沉淀(P1),6 000 r/min下离心10 min,10 mmol/L Tris-HCl(pH 8.0)洗涤2 次,上清(S2)4 ℃保存;使用10 mL 25%蔗糖溶液重悬沉淀,于25 ℃条件下振荡10 min,10 000 r/min离心10 min,上清(S3)4 ℃保存;使用10 mL预冷双蒸水重悬沉淀,置于冰水浴中振荡10 min,10 000 r/min离心10 min,上清(S4)4 ℃保存;10 mL 50 mmol/L Tris-HCl重悬沉淀后,超声破碎细胞,10 000 r/min离心10 min,4 ℃保存上清(S5)。合并S1、S2 和 S3作为胞外提取液,S4为细胞周质提取液,S5为胞内提取液。各取2 mL上述酶液,沸水浴1 h,即为失活酶液,作为空白对照使用。磷酸酯酶活性测定方法参见文献[17]。磷酸酯酶活性的测定设置3个重复,下同。
1.4.2不同温度下磷酸酯酶活性分别控制酶促反应温度为20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃,测定不同温度下磷酸酯酶活性。
1.4.3不同pH下磷酸酯酶活性分别用pH 6.0、6.5、7.0、7.5、8.0的0.2 mol/L Na2HPO4-柠檬酸缓冲液和pH 9.0、9.5 的0.05 mol/L甘氨酸-NaOH缓冲液设置酶促反应体系中不同pH 环境。测定pH值分别为6.0、6.5、7.0、7.5、8.0、9.0和9.5环境下磷酸酯酶活性。
1.5菌株JYD-4对南方红豆杉接种效应
用接种环挑取少量菌体接种于含有50 mL 牛肉膏蛋白胨液体培养基的100 mL三角瓶中,30 ℃、200 r/min振荡培养48 h。取上述菌液离心(4 ℃,6 000 r/min,5 min),无菌生理盐水洗涤菌体3次,调节菌悬液浓度至1012cfu/L制成菌剂。将上述菌剂接种至一年生南方红豆杉,对照组接种等量无菌生理盐水,接种量为每株5 mL。红豆杉苗培养基质为泥炭、珍珠岩和沙按 3∶1∶1体积比混合而成,每盆装1.5 kg。基质中速效氮、速效磷和速效钾含量分别为35.0、7.0和25.4 mg/kg。接种后实生苗置于温室中,使用遮阳网控制光照,适时浇水。接种1年后分别测量实验组和对照组苗高和地径。植株烘干后测其干重进行生物量分析。
1.6数据分析
本研究所有实验均设置3个重复。实验数据使用Excel和SPSS 13. 0统计软件进行方差分析和多重比较。
2 结果与分析
2.1菌株JYD-4形态观察、生理生化特性分析及16S rDNA分析鉴定
菌株JYD-4在牛肉膏蛋白胨培养基平板上,菌落较小,半透明,乳黄色,圆形、边缘整齐;菌落表面光滑,有光泽,中央有突起(图1,A)。显微镜观察,菌体呈短杆状,大小约0.23~0.33 μm×0.34~1.40 μm (图1,B)。菌体革兰氏染色阴性,无芽孢,极生多鞭毛。JYD-4为好氧菌,氧化酶反应、KOH、吲哚试验、明胶液化、硝酸还原、产氨和硫化氢试验均为阳性。对该菌株的16S rDNA序列进行扩增后测序(图2,A),与GenBank数据库中的序列进行比对,构建系统发育树。结果显示(图2,B),菌株JYD-4与嗜麦寡养单胞菌(Stenotrophomonasmaltophilia)位于同一分支,与S.maltophilia16S rDNA序列相似度为99%,结合生理生化特性,初步确定菌株JYD-4为嗜麦寡养单胞菌(Stenotrophomonasmaltophilia)。其16S rDNA序列(1 508 bp)已上传至GenBank数据库,登录号为KU942526。
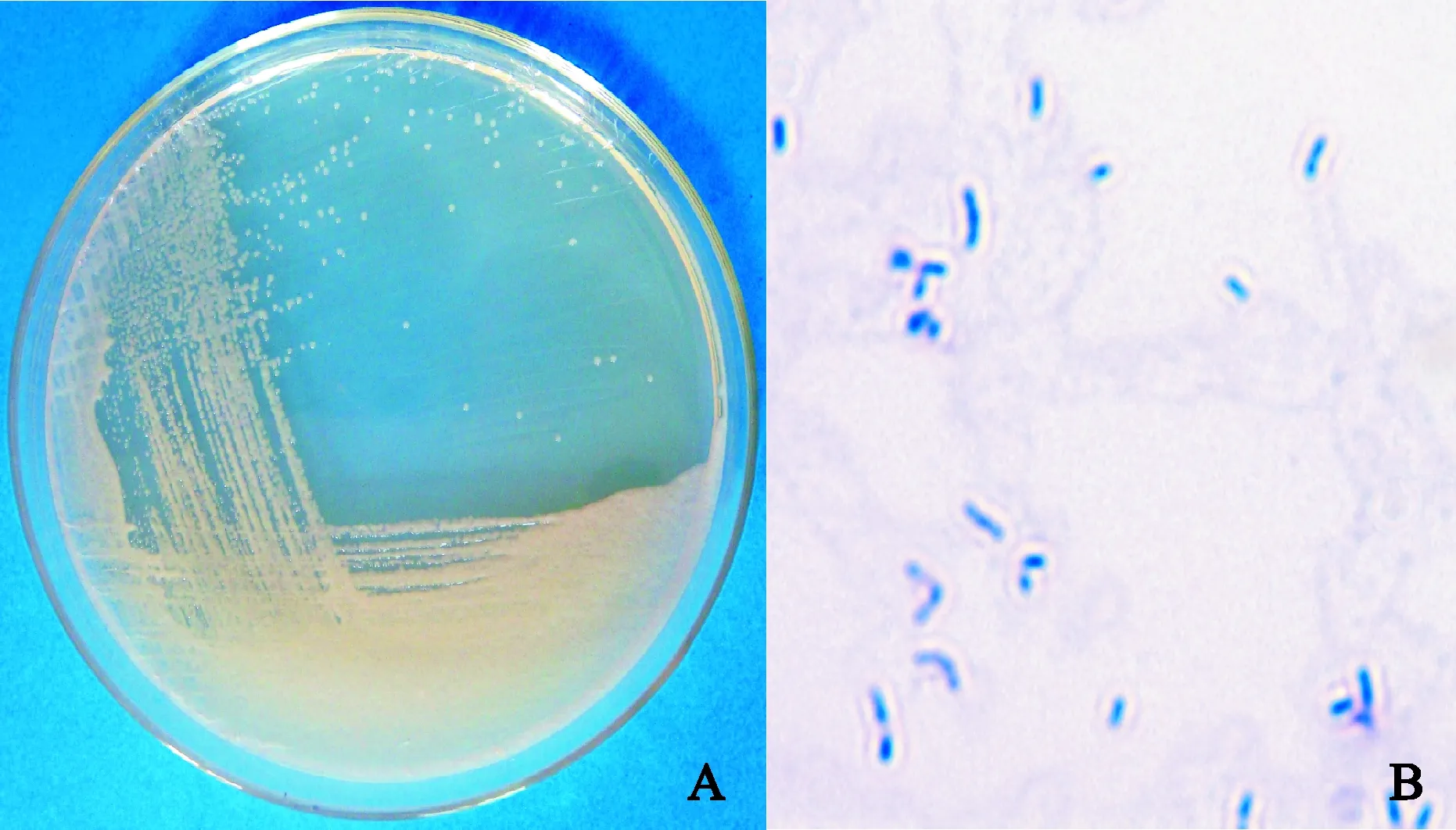
A.菌落形态;B.菌体形态(结晶紫染色,放大倍数1 000)图1 菌株JYD-4的菌落和菌体形态A. Colony morphology; B. Cell morphology (stained by crystal violet, magnification: 1 000)Fig.1 Colony morphology and cell morphology of strain JYD-4
2.2菌株JYD-4的解磷能力及解磷特性
2.2.1解磷能力如图3所示,S.maltophiliaJYD-4在卵黄平板上培养后,可产生明显不透明的解磷圈。解磷圈直径为32.18 mm,菌落直径为15.98 mm,解磷圈与菌落直径比为2.01。该结果表明,JYD-4菌株对卵磷脂具有较强的降解能力。
同时,将S.maltophiliaJYD-4接种至蒙金娜液体培养基,从培养第1天开始,每天定时取样测定培养液中可溶性磷含量,计算解磷量。结果(图4)显示,随着培养时间的延长,S.maltophiliaJYD-4的解磷量逐渐升高;当培养至第5天时,解磷量达到最高值(72.38 mg/L),此后随着培养时间的继续延长,菌株JYD-4逐渐出现解磷量降低的趋势。由此推测,在培养初期,菌株JYD-4生长代谢能力旺盛,不断分解培养基中卵磷脂,解磷量逐渐增长;随着培养基中的营养物质逐渐消耗,导致菌体分解代谢能力降低,从而使培养基中可溶性磷含量缓慢下降

图3 S. maltophilia JYD-4产生的解磷圈Fig.3 Phosphate-solubilizing zone produced by S. maltophilia JYD-4

图2 菌株JYD-4 16S rDNA序列扩增(A)和系统发育树(B)Fig.2 Amplification profile of 16S rDNA (A) and phylogenetic tree (B) of strain JYD-4
。
2.2.2不同碳源下解磷量菌株JYD-4在含有不同氮源的蒙金娜液体培养基中培养5 d后,呈现出不同的解磷能力,且碳源间差异显著(图5,A)。其中,以葡萄糖作为碳源时,菌株JYD-4解磷能力最强(72.12 mg/L),显著高于其它碳源;当以果糖、半乳糖和甘油分别作为碳源时,菌株JYD-4解磷量基本相当,分别为64.93、60.40和58.84 mg/L;当使用蔗糖和淀粉作为碳源时,菌株JYD-4解磷量最低,仅分别为40.50 和 36.74 mg/L。

图中不同字母表示差异显著(P<0.05);下同图4 菌株JYD-4在不同培养时间的解磷量Bars with different letters are significantly different (P<0.05);The same as belowFig.4 Phosphate solubilization capacity of strain JYD-4 in different culture periods
2.2.3不同氮源下解磷量将菌株JYD-4接种于含有不同氮源的蒙金娜液体培养基中培养5 d后,其也呈现出不同的解磷能力,且氮源间差异显著(图5,B)。其中,菌株JYD-4解磷量在以牛肉膏作为氮源时最高(75.54 mg/L),以(NH4)2SO4为氮源时次之(68.94 mg/L),且两者显著高于其余氮源处理,这可能是由于牛肉膏营养成分丰富,在充当氮源的同时,也会提供碳源物质,有利于菌株生长并提高其降解有机磷能力;当分别以尿素和KNO3作为氮源时,JYD-4解磷量分别为53.88和52.53 mg/L,两者差异不显著;当以NH4Cl作为氮源时,对应的JYD-4解磷量为49.21 mg/L,略低于KNO3处理;当以NaNO3作为氮源时,菌株JYD-4解磷量最低(46.29 mg/L),并显著低于除NH4Cl外的其它氮源。以上结果说明,在本试验的几种氮源中,以牛肉膏蛋白胨作为氮源时,最有利于菌株JYD-4发挥解磷能力。
2.2.4不同初始pH下解磷量由图5,C可知,菌株JYD-4在pH 7.0的培养基中解磷量最高(74.61 mg/L),并显著高于其它pH条件下的解磷量;在实验设定的其它pH条件下,菌株JYD-4解磷量相差不大。其中,培养基初始pH值6.5、8.0和8.5处理对应的JYD-4解磷量分别为59.07 、61.92 和58.05 mg/L,它们之间没有显著性差异;在初始pH分别为7.5、9.0和9.5的培养基中,菌株JYD-4解磷量相对较低,分别为54.15 、52.20 和52.62 mg/L,它们之间也没有显著性差异。上述结果表明,菌株JYD-4在培养基初始pH为7.0的培养条件下可以发挥最高解磷能力。

C1.葡萄糖;C2.蔗糖;C3.果糖;C4.半乳糖;C5.甘油;C6.淀粉;N1.硫酸铵;N2.氯化铵;N3.硝酸钠;N4.硝酸钾;N5.尿素;N6.牛肉膏图5 不同碳源(A)、氮源(B)和pH(C)对菌株JYD-4解磷量的影响C1. Glucose; C2. Sucrose; C3. Fructose; C4. Galactose; C5. Glycerol; C6. Starch; N1. Ammonia sulfate; N2. Ammonia chloride; N3. Sodium nitrate; N4. Potassium nitrate; N5. Urea; N6. Beef extractFig.5 Effect of different C sources(A),N sources(B) and pH(C) on phosphate solubilization capacity of strain JYD-4
2.3菌株JYD-4磷酸酯酶活性分析
一般认为,微生物对有机磷的分解是通过分泌磷酸酯酶而实现的。为此,对菌株JYD-4的磷酸酯酶进行了定域分析,并分别考察了不同温度、不同pH对磷酸酯酶活性的影响。
2.3.1不同区域磷酸酯酶活性分别对菌株JYD-4的胞外、周质空间和胞内磷酸酯酶进行提取,并进行酶活测定。结果显示(图6),胞外和周质空间磷酸酯酶活性分别为8.75 和8.01 U/mL,而胞内磷酸酯酶活性高达167.48 U/mL,是胞外和周质空间的约20倍。该结果说明菌株JYD-4产生的磷酸酯酶主要存在于胞内。
2.3.2不同温度下磷酸酯酶活性分别测定菌株JYD-4在不同温度条件下的胞内磷酸酯酶活性。结果(图7,A)表明,在实验设定的温度范围内(20 ℃~65 ℃),菌株JYD-4胞内磷酸酯酶活性随温度增加呈“先减小后增大”的趋势,并在35 ℃和40 ℃时酶活性最低(分别为105.31和101.63 U/mL),且显著低于其余温度处理。在其余设定温度条件下,菌株JYD-4磷酸酯酶活性较为稳定,酶活性最高值(60 ℃对应酶活165.51 U/mL)和最低值(55 ℃对应酶活136.76 U/mL)之间仅相差28.75 U/mL。该结果说明菌株JYD-4的磷酸酯酶具有较广的温度适应范围,在高温条件下仍具有一定的应用潜力。

图6 S. maltophilia JYD-4磷酸酯酶定域分析Fig.6 Phosphatase localization of S. maltophilia JYD-4

图7 不同温度(A)和pH (B)对磷酸酯酶活性的影响Fig.7 Effect of different temperatures (A) and pH (B) on phosphatase activity
2.3.3不同pH下磷酸酯酶活性如图7,B所示,当pH低于9.0时,菌株JYD-4胞内磷酸酯酶活性极低,均在10 U/mL以下;当pH值达到9.0时,磷酸酯酶活性急剧上升并达到最大值(164.53 U/mL);随着pH值的继续升高,酶活性随之迅速下降,在pH 9.5条件下降为85.16 U/mL,仅为pH 9.0条件下酶活性的一半。该结果表明,菌株JYD-4磷酸酯酶活性的发挥对pH条件要求较为严格,在pH 9.0左右条件下酶活性最高,暗示了菌株JYD-4产生的有可能为碱性磷酸酯酶。
2.4菌株JYD-4对南方红豆杉的生长促进作用
将JYD-4菌剂接种至南方红豆杉根际1年后,植株长势明显高于对照组(图8)。其中,菌株JYD-4接种处理后的南方红豆杉实生苗的苗高、地径和生物量分别比对照组提高了43.39%、24.11%和29.25%,且接种处理组的苗高还显著高于对照组(表1)。该结果说明,菌株JYD-4接种能够明显促进南方红豆杉实生苗的生长。

图8 S. maltophilia 菌株JYD-4对南方红豆杉的促生长作用Fig.8 Growth-promoting effects of S. maltophilia strain JYD-4 on T. chinensis var. mairei表1 S. maltophilia 菌株JYD-4对南方红豆杉的促生作用Table 1 Growth-promoting effects of S. maltophiliaJYD-4 on T. chinensis var. mairei

指标Index处理TreatmentJYD-4CK苗高Seedlingheight/cm41.77±4.30a29.13±6.45b地径Grounddiameter/mm6.95±0.28a5.60±0.21a生物量Biomass/g12.33±0.99a9.54±0.90a
注: 同行数据后不同字母表示对照与处理间存在差异显著性(P≤0.05)
Note: Date with different letters in the same row indicate significantly difference between treatments and control at 0.05 level.
3 讨 论
解磷微生物在土壤磷素循环过程中担任着重要的角色。以微生物为基础开发的各种微生物肥料已经在农林业生产中得到广泛应用,该类肥料具有肥效高、本身无毒、不污染环境、成本低、节约能源等特点,是化学肥料的最有效替代品。目前,国内外对磷细菌的研究大多集中于无机磷溶磷菌[18-20]。在土壤中,有机磷化物约占土壤总磷量的1/3~1/2。对有机磷降解菌的分离及应用,将有助于最大化提高土壤磷利用率。本研究中分离得到的有机磷降解菌S.maltophiliaJYD-4,在本实验条件下其解磷量可高达75.54 mg/L 。栾丽英[8]和马雪蕾[9]分别从葡萄根际分离得到解有机磷细菌,其最高解磷量分别为62.29 mg/L和52.02 mg/L;冯月红[5]和朱颖[21]分别从小麦和三叶草根际分离得到解磷菌对卵磷脂的解磷量分别为44.00 mg/L和58.42 mg/L。和上述菌种相比,本研究分离得到的嗜麦寡养单胞菌(Stenotrophomonasmaltophilia)JYD-4菌株是一株有机磷高效降解菌。
生存环境的改变会影响到解磷菌的解磷能力,因此,本研究进一步探究了不同培养条件对菌株JYD-4解磷能力的影响。当以葡萄糖作为碳源时,菌株JYD-4解磷量明显高于其它碳源;当培养基中添加牛肉膏作为氮源时,菌株JYD-4解磷量也明显升高,解磷能力也优于其他氮源。推测认为添加营养成分丰富的牛肉膏,既有利于菌株JYD-4生长,也有利于该菌株对卵磷脂的高效降解。在研究不同碳源、氮源和pH对菌株JYD-4解磷能力的影响过程中发现,即使是同样的培养条件(葡萄糖为碳源,(NH4)2SO4为氮源,pH 7.0),在不同批次的实验过程中菌株JYD-4的解磷量会在68.94~74.61 mg/L范围内波动。分析可能是由于菌种生理活性在不同批次实验中的差异造成的。RMN等[22]的研究也发现在菌株的纯化过程中部分解磷菌会失去解磷能力。在研究培养基初始pH值对菌株JYD-4解磷量的影响过程中,虽然菌株JYD-4在pH 7.0环境下具有最高解磷量,但在其它pH值环境下,菌株JYD-4依然能发挥52.20~61.92 mg/L的解磷量,该解磷量并不低于其它已报道有机磷降解菌。这说明S.maltophiliaJYD-4可以在pH 6.5~9.5范围内发挥稳定的解磷能力,该菌株不仅可以在中性土壤环境中发挥解磷效果,促进植物生长,还可作为微生物肥料用菌作用于偏酸和偏碱土壤环境中生长的植物。
截止到目前为止,尽管有很多学者对植物根际的磷细菌展开了大量研究,但不同来源的磷细菌对不同植物的促生效果也不同。一般而言,从植物根际分离得到的解/溶磷菌对该种植物具有更强的促生效果,而且该菌种的引入也不会破坏植物根际原有的微生态平衡。在研究前期,本研究组从南方红豆杉根际分离得到了4株溶无机磷细菌,该菌种具有高效溶磷能力同时能够促进南方红豆杉实生苗的生长[23]。在此基础上,本研究又从南方红豆杉根际分离得到解有机磷细菌S.maltophiliaJYD-4菌株。该菌种具有高效解有机磷能力,对南方红豆杉实生苗生长具有明显促进作用。因此,本研究分离得到的S.maltophiliaJYD-4是一株集高效解磷和促生能力为一体的微生物菌种,该菌株为南方红豆杉微生物肥料的开发提供了优良的菌种资源,对于南方红豆杉珍稀树种的人工繁殖和资源保护具有重要意义。
关于细菌对有机磷的降解机制,目前普遍认为是通过产生磷酸酯酶(又称有机磷降解酶,organophosphorus acid hydrolase)对有机磷进行降解[24-25]。本研究对S.maltophiliaJYD-4的胞外、周质空间和胞内磷酸酯酶分别进行了粗提取和酶活性测定。结果发现,胞内磷酸酯酶活性远远高于胞外和周质空间;该酶对温度要求非常宽泛,在高达65 ℃温度条件下依然能保持较高酶活,但其对pH条件要求极为严格,仅能在pH 9.0条件下产生较高酶活性,该结果暗示了菌株JYD-4产生的磷酸酯酶有可能为碱性磷酸酯酶。而此前很多研究普遍认为解磷菌主要通过产生酸性磷酸酯酶来分解有机磷[25-26]。
目前,已有多株有机磷降解菌的磷酸酯酶编码基因被克隆,包括假单胞菌(Pseudomonassp.)[27-28]、黄杆菌(Flavobacteriumsp.)[29-30]、类单胞菌(Alteromonassp.)[31]、节杆菌(Arthrobactersp.)[32]、邻单胞菌(Plesiomonassp.)[33]、土壤杆菌(Agrobacteriumradiobacter)[34]和紫色杆菌(Chromobacteriumviolaceum)[35]等。根据目前已报道的磷酸酯酶的编码基因序列,设计了多对引物,尝试对S.maltophiliaJYD-4磷酸酯酶编码基因进行扩增。非常遗憾的是,目前并未扩增得到S.maltophiliaJYD-4的磷酸酯酶编码基因。推测,存在于不同菌种中的磷酸酯酶编码基因可能存在多样性,菌株JYD-4的磷酸酯酶编码基因与目前已知的相关基因序列差异较大,结合菌株JYD-4产生碱性磷酸酯酶的推测,分析菌株JYD-4产生的磷酸酯酶在有机磷降解特性等方面可能存在独特之处。在今后的工作中仍然会尝试多种方法获取S.maltophiliaJYD-4的磷酸酯酶编码基因,从而更深入地了解微生物菌种对有机磷的降解机制。
[1]王亚飞, 王强, 阮晓, 等. 红豆杉属植物资源的研究现状与开发利用对策[J]. 林业科学, 2012,48(5): 116-125.
WANG Y F, WANG Q, RUAN X,etal. Research Status and Utilization Strategies of Rare Medicinal Plants inTaxus[J].ScientiaSilvaeSinicae, 2012,48(5): 116-125.
[2]RODRIGUEZ H, FRAGA R. Phosphate solubilizing bacteria and their role in plant growth promotion[J].BiotechnologyAdvances, 1999,17(4-5): 319-339.
[3]TARAFDAR J C, CLAASSEN N. Organic phosphorus compounds as a phosphorus source for higher plants through the activity of phosphatases produced by plant roots and microorganisms[J].BiologyandFertilityofSoils, 1987,5(4): 308-312.
[4]ABD-ALLA M H. Phosphatases and the utilization of organic phosphorus byRhizobiumleguminosarumbiovarviceae[J].LettersinAppliedMicrobiology, 1994,18(5): 294-296.
[5]冯月红. 苜蓿和小麦根际高效解磷细菌筛选及其溶磷效果的初步研究[D]. 兰州: 甘肃农业大学, 2003.
[6]JORQUERA M A, HERNANDEZ M T, RENGEL Z,etal. Isolation of culturable phosphobacteria with both phytate-mineralization and phosphate-solubilization activity from the rhizosphere of plants grown in a volcanic soil[J].BiologyandFertilityofSoils,2008,44(8): 1 025-1 034.
[7]李繁, 涂然, 陈三凤. 7株解有机磷细菌的分离和鉴定[J]. 农业生物技术学报, 2006.14(4): 600-605.
LI F, TU R, CHEN S F. Isolation and identification of seven phosphate-solubilizing bacteria[J].JournalofAgriculturalBiotechnology, 2006,14(4): 600-605.
[8]栾丽英. 葡萄根际高效溶有机磷细菌的筛选及其溶磷特性初步研究[D]. 陕西杨凌: 西北农林科技大学, 2009.
[9]马雪蕾. 新疆塔里木盆地葡萄根际溶磷细菌的筛选和鉴定[D]. 陕西杨凌: 西北农林科技大学, 2015.
[10]RODRIGUEZ H, FRAGA R, GONZALEZ T,etal. Genetics of phosphate solubilization and its potential applications for improving plant growth-promoting bacteria[J].PlantandSoil, 2006,287: 15-21.
[11]沈萍, 陈向东. 微生物学实验(第4版)[M]. 北京: 高等教育出版社, 2007: 81-84.
[12]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 353-398.
[13]CHEN Y P, REKHA P D, ARUN A B,etal. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J].AppliedSoilEcology, 2006,34(1): 33-41.
[14]LARKIN M A, BLACKSHIELDS G, BROWN N P,etal. Clustal W and Clustal X version 2.0[J].Bioinformatics, 2007,23(21): 2 947-2 948.
[15]LEWIS P O, KUMAR S, TAMURA K,etal. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0[J].MolecularBiologyandEvolution, 2013,30(12):2 725-2 729.
[16]WATANABE F S, OLSEN S R. Test of an ascorbic acid method for determining phosphorus in water and NaHCO3extracts from soil[J].SoilScienceSocietyofAmericaJournal, 1965,29(6):677-678.
[17]贾开志. 久效磷降解菌的分离、鉴定及降解酶基因的克隆[D]. 南京: 南京农业大学, 2006.
[18]OTEINO N, LALLY R D, KIWANUKA S,etal. Plant growth promotion induced by phosphate solubilizing endophyticPseudomonasisolates[J].FrontiersinMicrobiology, 2015,6: 745.
[19]BAKHAHANDEH E, RAHIMIAN H, PIRDASHTI H,etal. Evaluation of phosphate-solubilizing bacteria on the growth and grain yield of rice (OryzasativaL.) cropped in northern Iran[J].JournalofAppliedMicrobiology, 2015,119(5): 1 371-1 382.
[20]GHOSH R, BARMAN S, MUKHERJEE R,etal. Role of phosphate solubilizingBurkholderiaspp. for successful colonization and growth promotion ofLycopodiumcernuumL. (Lycopodiaceae) in lateritic belt of Birbhum district of West Bengal, India[J].MicrobiologicalResearch, 2016,183: 80-91.
[21]朱颖. 三叶草根际溶磷菌特性及其促生效果研究[D]. 兰州: 甘肃农业大学, 2009.
[22]RMN K. Phosphate-solubilizing bacteria and fungi in various cultivated and virgin Alberta soils[J].CanadianJournalofSoilScience, 1983.63(4): 671-678.
[23]任嘉红, 刘辉, 吴晓蕙, 等. 南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果[J]. 微生物学报, 2012,52(3): 295-303.
REN J H, LIU H, WU X H,etal. Screening, identification, and promoting effect of phosphate-solubilizing bacteria in rhizosphere ofTaxuschinensisvar.mairei[J].ActaMicrobiologicaSinica, 2012,52(3): 295-303.
[24]GREAVES M P, WEBLEY D M. A study of the breakdown of organic phosphates by micro-organisms from the root region of certain pasture grasses[J].JournalofAppliedBacteriology, 1965,28(3): 454-465.
[25]ABD-ALLA, M H. Use of organic phosphorus byRhizobiumleguminosarumbiovar viceae phosphatases[J].BiologyandFertilityofSoils, 1994,18(3): 216-218.
[26]FOX T R, COMERFORD N B. Rhizosphere phosphatase activity and phosphatase hydrolyzable organic phosphorus in two forested spodosols[J].SoilBiologyandBiochemistry, 1992,24(6): 579-583.
[27]CHAUDHRY G R, ALI A N, WHEELER W B. Isolation of a methyl parathion-degradingPseudomonassp. that possesses DNA homologous to theopdgene from aFlavobacteriumsp.[J].AppliedandEnvironmentalMicrobiology, 1988,54(2): 288-293.
[28]邓敏捷, 伍宁丰, 梁果义, 等. 一种新的有机磷降解酶基因ophc2的克隆与表达[J]. 科学通报, 2004,49(11): 1 068-1 072.
DENG M J, WU N F, LIANG G Y,etal. Cloning and expression ofophc2, a new kind of organophosphorus degradation enzyme gene[J].ChineseScienceBulletin, 2004,49(11): 1 068-1 072.
[29]MULBRY W W, KARNS J S. Parathion hydrolase specified by the Flavobacteriumopdgene: relationship between the gene and protein[J].JournalofBacteriology, 1989,171(12): 6 740-6 746.
[30]SIDDAVATTAM D, KHAJAMOHIGGIN S, MANAVATHI B,etal. Transposon-like organization of the plasmid-borne organophosphate degradation (opd) gene cluster found inFlavobacteriumsp[J].AppliedandEnvironmentalMicrobiology, 2003,69(5): 2 533-2 539.
[31]CHENG T C, HARVEY S P, CHEN G L. Cloning and expression of a gene encoding a bacterial enzyme for decontamination of organophosphorus nerve agents and nucleotide sequence of the enzyme[J].AppliedandEnvironmentalMicrobiology, 1996,62(5): 1 636-1 641.
[32]OHSHIRO K, KAKUTA T, NIKAIDOU N,etal. Molecular cloning and nucleotide sequencing of organophosphorus insecticide hydrolase gene fromArthrobactersp. strain B-5[J].JournalofBioscienceandBioengineering, 1999,87(4): 531-534.
[33]CUI Z L, LI S P, FU G P. Isolation of methyl parathion-degrading strain M6 and cloning of the methyl parathion hydrolase gene[J].AppliedandEnvironmentalMicrobiology, 2001,67(10): 4 922-4 925.
[34]HORNE I, SUTHERLAND T D, HARCOURT R L,etal. Identification of anopd(organophosphate degradation) gene in anAgrobacteriumisolate[J].AppliedandEnvironmentalMicrobiology, 2002,68(7): 3 371-3 376.
[35]The complete genome sequence ofChromobacteriumviolaceumreveals remarkable and exploitable bacterial adaptability[J].ProceedingsoftheNationalAcademyofSciences, 2003,100(20): 11 660-11 665.
(编辑:裴阿卫)
Identification, Characterization and Growth-promoting Effects of an Organophosphate-solubilizing Bacterium fromTaxuschinensisvar.maireiRhizosphere
JIN Tingting, REN Jiahong*, LIU Ruixiang
(Department of Biological Science and Technology, Changzhi College, Changzhi, Shanxi 046011, China)
We isolated and identified an organophosphate-solubilizing bacterium JYD-4 from the rhizosphere ofTaxuschinensisvar.mairei. Molybdenum-antimony anti-spectrophotometric method was applied to investigate the effects of carbon sources, nitrogen sources and pH environments on organophosphate solubilization capacity. We also detected the effects of temperatures and pH on the phosphatase enzyme activity produced by strain JYD-4. The inoculation test in potted seedlings was carried out under the greenhouse. The results showed that: (1) strain JYD-4 was identified asStenotrophomonasmaltophilia. (2) The ratio of organophosphate-solubilizing circle diameter to colony diameter was 2.01. Organophosphate-dissolving ability in liquid medium was 72.38 mg/L. (3) Glucose and beef extract were identified as the optimal carbon source and nitrogen source for organophosphate-solubilizing. The optimal pH was 7.0. (4) Phosphatase produced byS.maltophiliaJYD-4 mainly located in the cell. The phosphatase could maintain stable activity in a wide temperature range (20-65 ℃), only conferred high activity at pH 9.0. (5)S.maltophiliaJYD-4 was able to improve the seedling height, ground diameter and biomass of the seedlings ofT.chinensisvar.mairei. The results showed thatS.maltophiliaJYD-4 is a highly effective organophosphate-solubilizing bacterium. It could significantly promote the growth ofTaxuschinensisvar.mairei. Results in this paper provide excellent strain for the development of microbial fertilizer ofT.chinensisvar.mairei, and provide theory evidences for the application ofS.maltophiliaJYD-4.
Organophosphate-solubilizing bacterium;Taxuschinensisvar.mairei;Stenotrophomonasmaltophilia; Phosphate-solubilizing characteristics; Phosphatase, Growth-promoting effects
1000-4025(2016)09-1819-09doi:10.7606/j.issn.1000-4025.2016.09.1819
2016-05-28;修改稿收到日期:2016-09-01
国家自然科学基金(31100471);山西省重点学科建设项目
晋婷婷(1987-),女,博士,讲师,主要从事资源微生物研究。E-mail:jintingi@163.com
任嘉红,博士,教授,硕士生导师,主要从事森林微生物研究。E-mail:renjiahong@163.com
Q93-331; Q939.99
A

