基于神经生物电原理治疗原发性痛经的作用机制研究*
李盈洁 饶莹 曾茜 胡析 王一枝 易学良 牛英杰 张晓△
(1.成都医学院基础医学实验教学中心,四川 成都 610500;2.云南省蒙自市人民医院,云南 蒙自 661100)
论著
基于神经生物电原理治疗原发性痛经的作用机制研究*
李盈洁1饶莹2曾茜1胡析1王一枝1易学良1牛英杰1张晓1△
(1.成都医学院基础医学实验教学中心,四川 成都610500;2.云南省蒙自市人民医院,云南 蒙自661100)
目的:探究神经生物电刺激对原发性痛经(Primary dysmenorrhea,PD)大鼠P物质(Substance P,SP)的表达变化的影响。方法:将SD大鼠随机分为非模型对照组、模型对照组和实验组3组。实验组给予股部皮下注射已烯雌酚,每天一次,连续10 d,第1天0.8 mg·只-1,第2-9天0.4 mg·只-1,第10天0.8 mg·只-1;第11天腹腔注射缩宫素2 U ·只-1;对实验组大鼠进行神经生物电刺激干预,并在1 h、3 h和7 h后采用扭体评分进行运动评价。模型对照组只注射与实验组相同剂量的已烯雌酚与缩宫素,不进行神经生物电刺激干预,其余操作不变。非模型对照组不注射已烯雌酚与缩宫素,不进行神经生物电刺激干预,其余操作不变。免疫组织化学技术检测各组大鼠脊髓后角中SP的定位及表达变化,采用免疫荧光技术探究SP与脑源性神经营养因子(Brain derived neurotrophic factor,BDNF)在脊髓后角的共定位情况。结果:扭体评分显示实验组大鼠运动增加幅度明显小于模型对照组(P<0.05)。SP主要分布于脊髓后角Ⅱ板层,所有时间点实验组SP表达均低于模型对照组,在3 h表达差异最大(P<0.05)。免疫荧光双标技术显示SP和BDNF在脊髓后角共表达。结论:神经生物电刺激能抑制SP的表达,影响原发性痛经,其机制可能与SP及BDNF共同作用有关。
原发性痛经;神经生物电刺激;P物质;脑源性神经营养因子
原发性痛经(Primary dysmenorrhea,PD)是指非盆腔器质性病变引起的痛经。西医对PD的治疗强调使用止痛剂、镇静剂及前列腺素抑制剂等,不良反应多,手术治疗也有一定得疗效,但因为其具有一定的局限性,所以手术治疗不易被患者接受[1-2]。因PD的高发病率及治疗棘手,给女性的身心健康和工作学习带来了严重的影响。因此,探索减轻痛经患者的腹痛程度、缓解痛经症状及提高痛经患者的生活质量越来越受到重视。目前已有大量研究表明,神经生物电刺激具有镇痛和延缓疼痛的效果[3-5]。因具有无创伤、易操作、患者易接受等优点,所以我们选择采用神经生物电刺激的方法探讨治疗PD的方法。
神经生物电刺激是治疗PD的一种方法。神经电刺激主要是利用特定参数的电流,对神经根及其分支进行刺激,进而干预痛觉反射的神经通路。
P物质(Substance P,SP)是一种与疼痛密切相关的物质,在中枢神经系统中分布广泛[6-13],它既能传递伤害性信息,也有镇痛作用[8-9]。P物质与神经系统及其他递质相互作用、相互配合而发挥作用,其作用机制十分复杂[8,11]。另外,也有研究表明调节伤害性信息的重要物质还有脑源性神经营养因子(Brain derived neurotrophic factor,BDNF),它在痛觉中枢敏化的发生、发展与维护中发挥作用[14]。
虽然有大量证据表明SP与BDNF参与了疼痛信号的传递,但是在原发性痛经中神经电刺激对SP与BDNF有什么影响还不清楚,SP与BDNF对原发性痛经的作用机制还有待研究。因此,本实验采用免疫组织化学技术的方法,探究神经生物电刺激后SP在脊髓后角的表达变化及定位;通过免疫荧光双标技术,研究SP和BDNF的定位表达,探讨神经生物电刺激治疗PD的作用机制,对于探索非药物治疗PD的方法,具有十分重要的临床意义。
1 材料与方法
1.1动物模型制备
1.1.1动物与分组
清洁级健康成年SD雌性大鼠54只,体重220±20 g,由华西实验动物中心提供。将大鼠随机分为非模型对照组、模型对照组和实验组,每组又各分为1 h、3 h 、7 h组,每组各6只。
1.1.2动物模型制备
动物随机分组经2天适应后开始造模,实验组股部皮下注射已烯雌酚,每天一次,连续10 d,第1天0.8 mg·只-1,第2-9天0.4 mg·只-1,第10天0.8 mg·只-1;第11天腹腔注射缩宫素2 U ·只-1;对实验组大鼠进行神经生物电刺激干预,并对大鼠进行扭体评分。模型对照组只注射与实验组相同剂量的已烯雌酚与缩宫素,不进行神经生物电刺激干预,其余操作不变。非模型对照组不注射已烯雌酚与缩宫素,不进行神经生物电刺激干预,其余操作不变。
1.1.3神经生物电刺激
术后用SDZ-IV型电刺激仪对实验组大鼠进行神经生物压电刺激干预,参数设置:疏密波脉冲电流,电流强度为2 mA,频率2 Hz,刺激6次,时间30 min。电极经皮肤及皮下组织,于大鼠第12胸椎棘突下后正中线右侧旁开约2 cm,接正极;后正中线右侧旁开约10 cm处接负极。
1.1.4动物扭体评分[15]
观察注射缩宫素后大鼠每分钟扭体反应,根据行为学评分标准,将扭体行为分为4个等级。0级:正常姿势(手爪平放盒底或正常探查行为);1级:身体向左或右偏斜;2级:后肢伸展,后爪背屈,躯体伸展伴频繁地盆骨侧向旋转;3级:腹部肌肉收缩,伴躯体伸展和后肢伸展。每20 min记录扭体次数。以每分钟行为学分数=[0级(次数)×0(分)+1级(次数)×1(分)+2级(次数)×2(分)+3级(次数)×3(分)] ·(分钟数/20)-1作为指标。
1.2免疫组织化学技术
1.2.1取材灌注
在电刺激后的第1 h、3 h、7 h,分别对大鼠进行灌注取材。大鼠过量麻醉后开胸暴露心脏,用眼科剪剪开心尖,将灌注针头经左心室插入到主动脉,快速灌入200 ml 生理盐水,至右心耳膨胀时剪开右心耳使大鼠体内血液完全排出。之后持续缓慢滴注300 ml的4%多聚甲醛固定液。灌注固定后取出脊髓组织(胸10至腰2),取出标本置于4%多聚甲醛中后固定,于4℃保存备用。
1.2.2免疫组织化学技术
脊髓标本经4%多聚甲醛固定48 h后,用切片机制作厚度为5 μm的石蜡切片,置于60℃的烤箱30 min,常规二甲苯脱蜡,各级酒精至水化,3%甲醇双氧水溶液浸泡10 min,高压锅加热修复5 min,3%H2O2室温孵育10 min,羊血清37℃孵育30 min。加一抗(BDNF,Rb,1:100;SP,Ms,1:200),置入4℃过夜。SP-9001试剂B液与C液均孵育15 min,DAB-H2O2显色液,PBS终止并冲洗,苏木素复染,盐酸酒精分色,自来水返蓝,梯度酒精逐级脱水,二甲苯透明,中性树脂封片。一抗与二抗均购自于中杉金桥生物技术公司。用于荧光免疫组化的石蜡切片在高压修复10 min后,羊血清孵育30 min,加入一抗过夜后,荧光二抗(cy3,anti-Rb,1:200,Jackson;488,anti-Ms,1:100,中杉金桥)37℃孵育2 h,漂洗后用DAPI甘油封片,镜检。
每组选取连续切片中相同序数的3张代表切片,在高倍镜下计数脊髓视野免疫阳性细胞并记录阳性细胞的平均灰度值,取5个视野细胞数总和及5个视野灰度值的平均值。运用正置荧光显微镜(Olympus BX41,Japan)及Motic光学显微镜采集图像进行观察分析。
1.3统计学分析
2 结果
2.1痛经模型制备
本实验通过扭体反应来评价大鼠的痛经程度。扭体实验结果表明,模型对照组在1 h,3 h,7 h的评分均高于非模型对照组且都具有统计学意义(P<0.05),上述实验结果表明本实验动物模型制备成功。1 h时模型对照组的评分略高于实验组,无统计学意义(P>0.05);3 h时模型对照组评分明显高于实验组(P<0.05),在所测时间点评分差异达到最大值;7 h时模型对照组评分也明显高于实验组(P<0.05),见表1。
表1 大鼠扭体反应结果统计表±S,n=6)
注:与模型对照组相比,*P<0.05。
2.2免疫酶组化及免疫荧光组化
2.2.1SP在脊髓后角的表达变化
本实验通过免疫酶组化实验来反映SP在脊髓后角的定位表达,结果显示SP免疫反应阳性物质呈棕色、纤维状,主要分布于脊髓后角Ⅰ板层和Ⅱ板层,且在实验组与模型对照组的不同时间段均有表达。与非模型对照组相比(图1-a,b,c),模型对照组SP免疫阳性物质表达均增加,1 h的表达量较低,3 h达到峰值,到7 h有所下降(图1-d,e,f),且均具有统计学意义(P<0.05);与模型对照组相比,实验组SP免疫阳性物质的表达量在1 h表达较低,在3 h时表达量达到峰值,7 h有所下降(图1-g,h,i),并且在1 h、3 h、7 h时的表达量均明显小于模型对照组,且均有统计学意义(P<0.05)。SP在脊髓后角的表达结果见图1、图2。
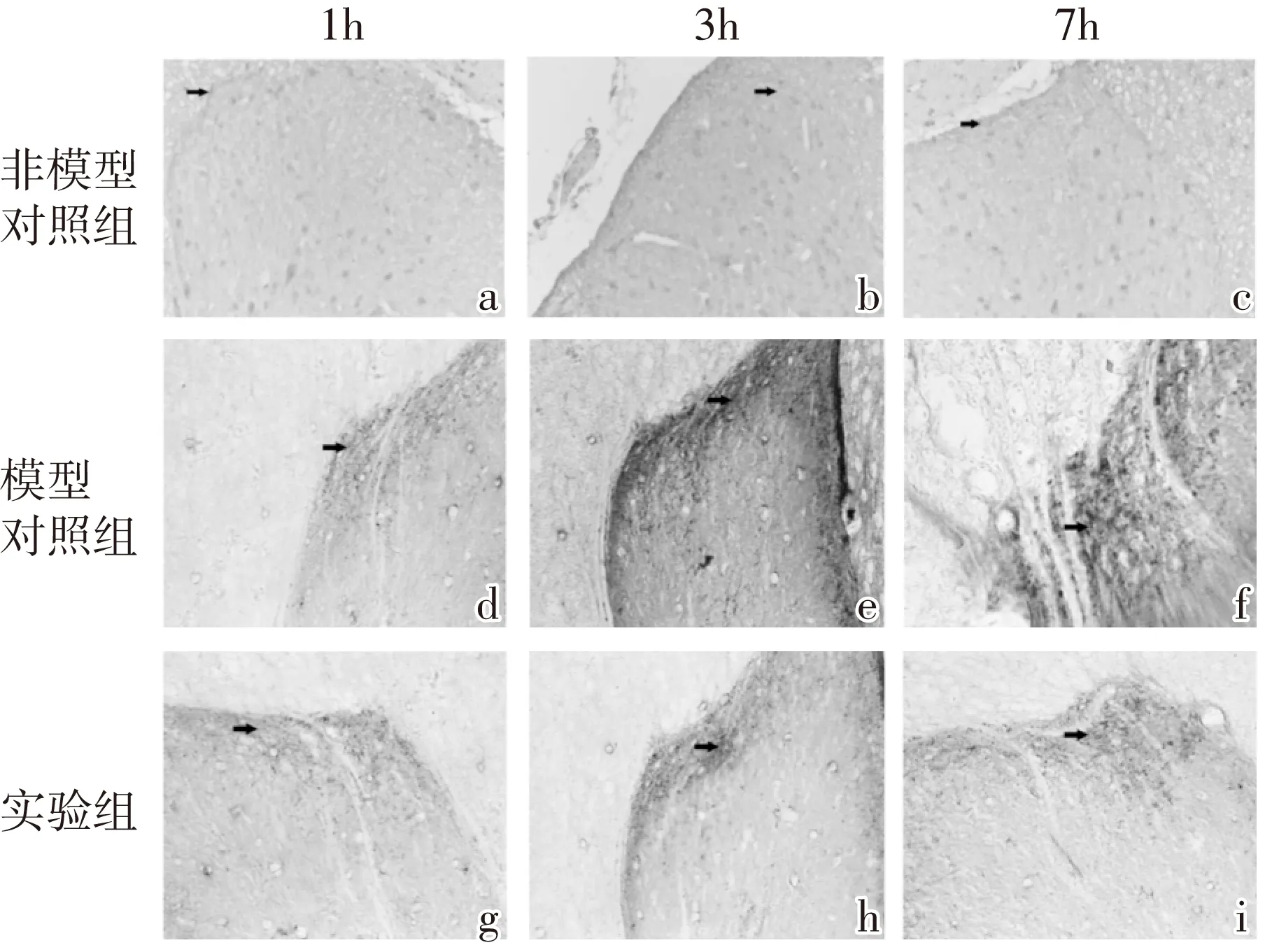
图1 脊髓后角SP的表达情况(IHC,400X)
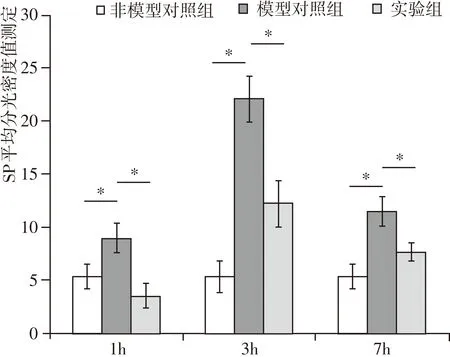
图2 脊髓后角SP表达变化统计图(IHC,400X)注:与模型对照组相比,*P<0.05。
2.2.2SP与BDNF在脊髓后角共表达
本实验用免疫荧光双标技术显示,SP与BDNF在脊髓后角Ⅱ板层共定位表达。染色为红色的为BDNF的定位,绿色的为SP的定位,蓝色的染出细胞核,显示黄褐色与蓝色的图片为BDNF、SP及细胞核的共定位表达,如图3。
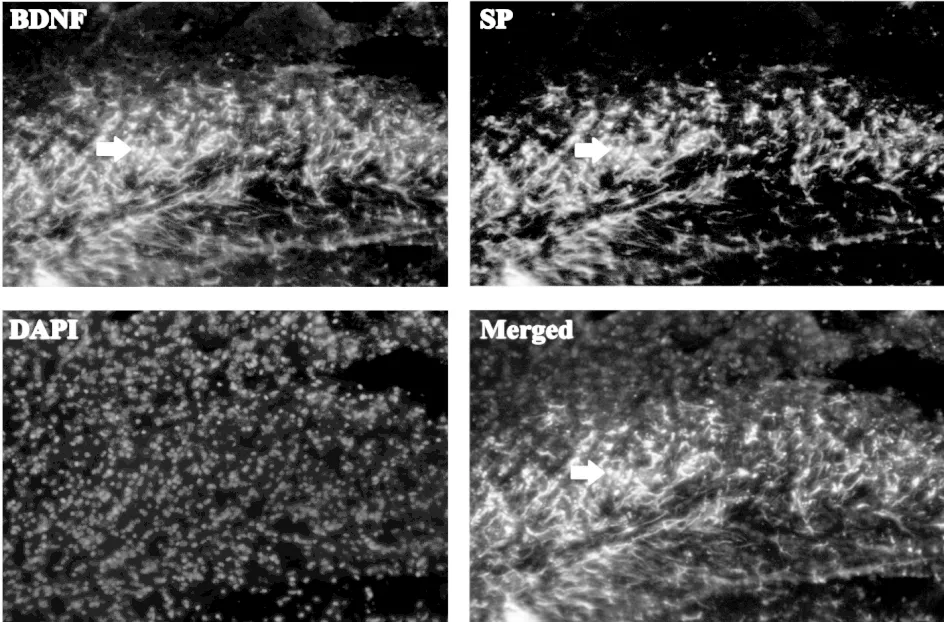
图3 SP和BDNF免疫荧光双标结果(IF,200X)
3 讨论
原发性痛经是女性常见的给身心健康和工作学习带来严重的影响的疾病,目前还没有比较好的治疗方法。神经生物电刺激对缓解痛经有一定的疗效,因此,本实验探讨神经生物电刺激对原发性痛经的影响,实验结果显示神经生物电刺激过后,大鼠原发性痛经症状减轻,脊髓后角的SP明显较少,BDNF在脊髓后角与SP共定位表达。
3.1神经电刺激通过抑制SP的表达来缓解痛经。
大量研究表明,疼痛的信号主要是由各种神经递质传递,SP是传导伤害性疼痛的一种兴奋性递质,它在传入神经的突触释放,产生致痛作用[16-18]。在多种慢性疼痛中,SP作为疼痛递质通过感觉神经传入纤维向上传递至脊髓中枢, 参与疼痛在脊髓中枢的传导和调制[19]。因此,痛觉传导通路上的SP的释放加重PD的重要原因。临床观察表明神经电刺激能够缓解疼痛,但是其作用机制不清楚。
本实验用免疫组织化学和免疫荧光的技术观察SP在脊髓后角的表达变化,以探讨神经生物电疗法治疗痛经的作用机制。结果显示,SP免疫反应阳性物质呈棕色、纤维状,在脊髓后角Ⅰ板层和Ⅱ板层分布,与其他的研究结果相同[20]。另外,本实验结果还表明与模型对照组相比SP免疫反应阳性物质在神经生物电刺激后在脊髓后角的表达减少,实验结果提示神经电刺激能够减少SP的表达,缓解痛经的疼痛传导。其作用机制是神经生物电刺激产生的疼痛刺激可作为一种神经生物电信号,通过脊髓细纤维(Aβ类神经纤维和C纤维)传导,激活脊髓后角的神经细胞,兴奋后角胶状质细胞,使其释放神经递质,抑制神经细胞传导,不再传递另一个疼痛冲动的刺激信号,出现镇痛作用。Chen YW等人的研究也表明,对术后的大鼠进行神经生物电刺激,会减少SP在脊髓的释放,抑制异常性疼痛[21]。用高频经皮电神经刺激抑制SP在大鼠背根神经节表达,减弱手术后的疼痛[22],上述的研究支持我们的实验结果。所以,本实验研究结果提示神经生物电刺激通过减少SP的表达,在脊髓减少伤害性信息传递,缓解痛经。
3.2BDNF可能与SP的共同作用来影响痛经。
本实验研究结果显示,SP与BDNF在脊髓后角的共表达,提示着BDNF可能与SP的共同作用,增强痛经的疼痛程度。
研究表明,在痛信号产生的初始阶段,活化的小胶质细胞形态结构发生明显变化,释放细胞因子,如BDNF、TNF-α和SP等[23]。因此,在神经病理性疼痛下,脊髓活化的小胶质细胞BDNF的表达增加,与神经病理性疼痛的发生密切相关。本实验用免疫荧光双标技术显示,SP与BDNF共同在脊髓后角2板层表达,提示BDNF与SP共同作用,增强痛经的疼痛程度。因此,BDNF与SP在脊髓强化痛信号的产生和传递中都发挥作用。Chen FX等人的研究表明,BDNF会通过增强SP的兴奋性来加速肠道蠕动[24],说明两者在调节生命活动的过程中有联系,支持我们的实验结果。
综上所述,神经生物电刺激后,SP表达减少,表明神经生物电刺激具有减轻大鼠原发性痛经的疼痛的作用。BDNF可能与SP共同作用来影响痛经,但是其作用机制还有待进一步研究。
1连伟清,王唯迪,徐梅,等. 原发性痛经发病机制及治疗的研究进展[J]. 国际妇产科学杂志, 2012, 39(1): 29-31+39.
2华永庆,洪敏,朱荃. 原发性痛经研究进展[J]. 南京中医药大学学报, 2003, 19(1): 62-64.
3王亮,冯珍. 神经电刺激的临床应用及机制研究进展[J]. 中国康复医学杂志, 2013, 28(8): 775-778.
4向军,常鹏飞,刘坤. 神经电刺激治疗慢性疼痛研究进展[J]. 中国疼痛医学杂志, 2008, 14(2): 105-108.
5陈良良,沈爱学,方剑乔,等. 经皮神经电刺激对癌痛患者的镇痛作用及其机理研究[A]. 中华中医药学会, 2005, 20(增刊): 237-239.
6Massari VJ, Tizabi Y, Park CH, et al. Distribution and origin of bombesin, substance P and somatostatin in cat spinal cord. [J]. Peptides, 1983, 4(5): 673-681.
7Goto T, Kido MA, Yamaza T, et al. Substance P and substance Preceptors in bone and gingival tissues[J]. Med Electron Microsc, 2001, 34(2): 77-85.
8Jang JH, Nam TS, Pail KS, et al. Involvement of peripherally released substance P and calcitonin gene-related peptide in mediating mechanical hyperalgesia in a traumatic neuropathy model of the rat[J]. Neurosci Lett, 2004, 360(3): 129-132.
9Li YS, Wang JX, Jia MM, et al. Dragon′s blood inhibits chronic inflammstory and Neuropathic pain responses by blocking the synthesis and release of substance P in rats[J]. J Pharmacol Sci, 2012, 118(1): 43-54.
10Wong BJ, Minson CT. Altered thermal hyperaemia in human skin by prior desensitization of neurokinin-1 receptors[J]. Exp Physiol, 2011, 96(6): 599-609.
11Mukda S, Moller M, Ebadi M, et al. The modulatory effect of substance P on rat pineal norepinephrine release and melatonin secretion[J]. Neurosci Lett, 2009, 461(3): 258-261.
12Makeham JM, Goodchild AK, Pilowsky PM. NK1 receptor activation in rat rostral ventrolateral medulla selectively attenuates somato-sympathetic reflex while antagonism attenuates sympathetic chemoreflex[J]. Am J Physiol Regul Integr Comp Physiol, 2008, 288(6): R1707-1715.
13Theoharides TC, Zhang B, Kempuraj D, et al. IL-33augment substance P-induced VEGF secretion from human mast cdlls and is increased in psoriatic skin[J]. Proc Natl Acad Sci U S A, 2010, 107(9): 4448-4453.
14Duric V, McCarson KE. Effects of analgesic or antidepressant drugs on pain-or stress-evoked hippocampal and spinal neurokinin-1 receptor and brain-derived neurotrophic factor gene expression in the rat[J]. J Pharmacol Exp Ther, 2006, 319(3): 1235-1243.
15Schmauss C, Yaksh TL. In vivo studies on spinal opiate receptor systems mediating antinociception. II. Pharmacological profiles suggesting a differential association of mu, delta and kappa receptors with visceral chemical and cutaneous thermal stimuli in the rat[J]. J Pharmacol Exp Ther, 1984, 228(1): 1-12.
16周跃,刘正津,廖雄宏,等. 脊神经节损伤时P物质和血管活性肠肽改变与神经行为异常的关系[J]. 中国行为医学科学, 2005, 14(2): 165-168.
17Anand P, Bley K. Topical capsaicin for pain management: therapeutic potential and mechanisms of action of the new high-concentration capsaicin 8% patch[J]. Br J Anaesth, 2011, 107(4): 490-502.
18Wajima Z, Hua XY, Yaksh TL. Inhibition of spinal protein kinase C blocks substance P-mediated hyperalgesia[J]. Brain Res, 2000, 877(2): 314-321.
19Henry JL. Future basic science directions into mechanisms of neuropathic pain[J]. J Orofac Pain, 2004, 18(4): 306-310.
20周仲福,汤健. 中枢神经系统中的P物质[J]. 生理科学进展, 1979, 10(4): 297-303.
21Chen YW, Tzeng JI, Lin MF, et al.Transcutaneous electrical nerve stimulation attenuates postsurgical allodynia and suppresses spinal substance P and proinflammatory cytokine release in rats[J]. Phys Ther, 2015, 95(1): 76-85.
22Chen YW, Tzeng JI, Lin MF, et al.High-frequency transcutaneous electrical nerve stimulation attenuates postsurgical pain and inhibits excess substance P in rat dorsal root ganglion[J]. Reg Anesth Pain Med, 2014, 39(4): 322-328.
23Ichikawa H, Sato T, Kano M, et al. Masseteric nerve injury increases expression of brain-derived neurotrophic factor in microglia within the rat mesencephalic trigeminal tract nucleus[J]. Cell Mol Neurobiol, 2011, 31(4): 551-559.
24Chen FX, Yu YB, Yuan XM, et al.Brain-derived neurotrophic factor enhances the contraction of intestinal muscle strips induced by SP and CGRP in mice[J]. Regul Pept, 2012, 178(1-3): 86-94.
Research of the therapy of the primary dysmenorrhea based on the principle of neurobiology electric*
Li Ying-Jie1, Rao Ying2, Zeng Xi1, Hu Xi1, Wang Yi-Zhi1, Yi Xue-Liang1, Niu Ying-Jie1, Zhang Xiao1△
(1.ExperimentalTeaching Center of Basic Medical Science of Chengdu Medical College,Sichuan Chengdu 610500; 2. People′s Hospital of Mengzi City, Yunnan Mengzi 661100)
Objective:To explore the influence of substance P (SP) on rats with primary dysmenorrhea after electric therapy. Methods: SD rats were divided into 3 groups: control group, model group and experimental group. Rats in experimental group were given diethylstilbestrol injection in subcutaneous tissue of femoral region once a day for 10 days. Each rat was given 0.8 mg diethylstilbestrol injection at the first day, 0.4 mg diethylstilbestrol injection from second day to ninth day, 0.8 mg diethylstilbestrol injection on ten day. Each rat was given 2 U oxytocin by intraperitoneal injection on the eleventh day. Rats in the experimental group were given the intervention of neural bioelectricity stimulation and evaluated by the twisting reaction scores in 1 h, 3 h, and 7 h after the intervention. Rats in model group were given the same diethylstilbestrol injection and oxytocin as the rats in experimental group, not the intervention of neural bioelectricity stimulation. The remaming operations in model of group were also the same as that in experimental group. Rats in control group were not given the diethylstilbestrol injection and oxytocin or the intervention of neural bioelectricity stimulation. The remaming operations in model of group were also the same as that in experimental group. In addition, immunohistochemistry was used to observe the distribution and the expression of SP in the posterior horn of the spinal cord. Immunofluorescence was used to detect whether SP and brain derived neurotrophic factor (BDNF) co-expressed in the posterior horn of the spinal cord. Results: Twisting reaction scores in the experimental group were significantly less than that in the model group (P<0.05). Immunohistochemistry results showed that SP was mainly located in the second layer of posterior horn of spinal cord. Positive cells in the experimental group were always less than that in the model group, and the expression at 3 h had the most significantly difference between the two groups (P<0.05). Immunofluorescence indicated that SP and BDNF were co-expressed in the posterior horn of spinal cord. Conclusion: Electric therapy of neurobiology can inhibit the expression of SP and influence the primary dysmenorrhea, which may have some relations to the interaction between SP and BDNF.
Primary dysmenorrhea; Neurobiology electric therapy; Substance P; Brain derived neurotrophic factor
成都医学院大学生创新实验项目(编号:CX201213)
李盈洁,女,成都医学院2014级临床本科在读学生,主要从事脊髓损伤与修复研究,Email:1049667281@qq.com。
张晓,男,教授,主要从事脊髓损伤与修复研究,Email:954073462@qq.com。
2016-4-8)

