碱提麻竹竹秆多糖的相对分子质量测定及单糖组成分析
潘文慧,阮期平*,边清泉
(1.绵阳师范学院生命科学与技术学院,四川绵阳 621000;2.绵阳师范学院化学与化学工程学院,四川绵阳 621000)
碱提麻竹竹秆多糖的相对分子质量测定及单糖组成分析
潘文慧1,阮期平1*,边清泉2
(1.绵阳师范学院生命科学与技术学院,四川绵阳 621000;2.绵阳师范学院化学与化学工程学院,四川绵阳 621000)
[目的]获得更多的竹资源信息。[方法]采用碱法提取麻竹竹秆多糖,提取物用Sevag法去蛋白,95%乙醇醇沉,透析,DEAE-52纤维素柱分离纯化,得到多糖DLP1和DLP2,并对多糖进行了相对分子质量测定及单糖组成分析。[结果]测得多糖DLP1和DLP2的相对分子质量分别为61 500 和1 780 000 u;经气象色谱测定DLP1由岩藻糖、鼠李糖、阿拉伯糖、葡萄糖和半乳糖组成,其质量比为111.25∶17.81∶1∶12.43∶2.43;DLP2由岩藻糖、鼠李糖、阿拉伯糖、葡萄糖、半乳糖和甘露醇组成,其质量比为198.22∶3.27∶9.16∶25.06∶10.96∶1。[结论]该实验为麻竹多糖研究打下基础,为竹资源的深度开发提供科学依据。
麻竹多糖;碱提;相对分子质量;组成分析
我国竹资源极其丰富,竹秆作为竹材的主要原料,长期未得到有效的利用,随着现代社会资源利用率的提高,竹产品的开发近年来成为热点。竹中含有多种活性成分[1-6],如多糖、黄酮、皂苷、矿质元素等,它们可以成为多种产品的原材料。竹多糖有抗氧化、抗癌、降血压、增加机体免疫能力等多种功效[6-11],值得重点关注。目前对竹多糖的研究多集中在提取工艺上[12-17],有关其分离纯化技术、相对分子质量测定及其结构测定的研究报道不多[18-20]。周跃斌等[19]曾采用DEAE-52纤维素柱和Sephadex凝胶柱层析等方法分离纯化了毛竹多糖。姚曦等[20]采用离子色谱法、凝胶色谱法分析了梁山慈竹竹秆多糖组成及分子量分布,结合傅立叶红外光谱、核磁波谱和热稳定性分析探讨了该多糖结构和性质。吴金松[21]采用离子交换柱和凝胶柱分离纯化了大叶麻竹竹笋多糖,并用气象色谱和核磁对其进行结构分析。Qin等[22]采用离子交换柱和分子筛层析分离纯化了玉竹多糖,并用核磁对其进行结构分析。笔者选择报道较少的麻竹为研究对象,对麻竹竹秆多糖进行分离纯化、相对分子质量和单糖组成测定,为麻竹多糖的结构和药理研究提供纯品及技术保障,为麻竹资源的深度开发提供科学依据。
1 材料与方法
1.1仪器、材料与试剂RE-2002型旋转蒸发仪,上海耀裕仪器设备有限公司;FD-1B-50型高速冷冻离心机,上海将来实验设备有限公司;UL trospec 3300 pro型紫外可见分光光度计,Amersham biosciences;DEAE-52纤维素,Wahtman公司;透析袋MD45(截留相对分子质量10 000 u),Spectrum美国光谱;1525型高效凝胶渗透色谱系统,美国Waters公司;GC-14B气相色谱系统,岛津公司;Dextran标准多糖(T10、T60、T120、T500、T1000和T2000),Sigma公司;葡萄糖(Glc)、岩藻糖(Fuc)、半乳糖(Gal)、阿拉伯糖(Ala)、甘露醇(Mnt)、鼠李糖(Rha)、木糖(Xyl)等单糖标准品,中国食品药品检定研究院;水为去离子水,其他试剂均为分析纯。
1.2实验方法
1.2.1粗多糖提取分离。采集绵阳师范学院附近竹园中的麻竹(Dendrocalamuslatiflorus)竹秆,洗净,于恒温鼓风干燥箱中80 ℃烘干,粉碎,过6号筛,得到竹秆细粉。取30 g细粉加入600 mL 0.1 mol/L 的NaOH溶液(料液比1∶20),充入适量N2,于4 ℃摇床上振荡2 h,过滤取滤液,用2 mol/L的 HCl调pH至7。重复2次,合并滤液,浓缩滤液至原体积的1/4。Sevag法去蛋白,重复3次。加入3倍体积95%的乙醇进行醇沉,取沉淀。沉淀物加无水乙醇洗涤2次,冷冻干燥,即得粗多糖(Dendrocalamuslatifloruspolysaccharide,以下简称DLP)。
将碱法提取的DLP用适量蒸馏水溶解,放入预处理后的透析袋(截留相对分子质量10 000 u)中透析3 d。DEAE-52纤维素预处理,湿法装柱,制备成2 cm×20 cm的层析柱。DLP的饱和溶液过滤后,1.0 mL上样,以0.1 mol/L的NaCl 为洗脱剂,流速1 mL/min,每10 min收集一管,苯酚-硫酸法检测。以管号为横坐标,吸光度A为纵坐标,作图。分别收集洗脱信号较大的部分,重复上样,合并相同的出峰部分。再将收集的洗脱信号较大的部分,分别上样再纯化,收集洗脱信号较大的部分,分别旋转蒸发浓缩,得到多糖DLP1和DLP2。
1.2.2多糖的纯度鉴定及相对分子质量的测定。Waters高效凝胶色谱系统,Ultrahydrogel Linear色谱柱(7.8 mm×300.0 mm,8 μm),两柱串联,2410示差检测器,流动相为0.1 mol/L 硝酸钠缓冲液,流速为 0.8 mL/min,柱温30 ℃,2个多糖样品按照它们在提取液中的配比(4∶11)配成溶液,20 μL进样,以电信号MV为纵坐标,时间为横坐标,得到色谱图,观察峰型。Dextran标准多糖(T10、T60、T120、T500、T1000和T2000),按照相同条件进样,以其重均分子量的对数logMw对保留时间,用HPGPC软件进行拟合处理,求标准曲线,对样品进行分子量测定。
1.2.3多糖水解及组成分析。2个安瓿瓶中分别加入5 mg DLP1和DLP2,2 mL 2 moL/L三氟乙酸(TFA),封瓶,120 ℃下高温水解3 h,取出放置待其冷却,除去TFA,分别加入10 mg盐酸羟胺,0.5 mL无水吡啶,振荡溶解,90 ℃水浴反应30 min后,冷却到室温,加入2 mL无水醋酸酐于90 ℃水浴中乙酰化30 min,进行衍生,得到的产物减压蒸干,残渣加入0.5 mL三氯甲烷溶解。取各单糖对照品约2 mg,按上述步骤乙酰化。
日本岛津公司GC-14B型气相色谱仪,氢火焰离子化检测器(FID),HP-5毛细管柱(30 m×0.22 mm,0.25 μm);载气N2流速1.0 mL/min,氢气流速40.0 mL/min,空气流速400.0 mL/min,尾吹流量10.0 mL/min。进样口250 ℃,检测器温度250 ℃,进样量3 μL,程序升温,初始温度为180 ℃,维持1 min后,3 ℃/min升温至250 ℃,250 ℃保持20 min,分流比为20∶1。
2 结果与分析
2.1多糖的分离纯化及相对分子质量测定碱法提取得到DLP 2.733 g,得率为9.11%,比水煮法提取率略高[23]。粗多糖在初次DEAE-52柱上,用0.1 mol/L的NaCl洗脱,主要得到2种多糖,如图1。经DEAE-52纤维素柱再纯化后得到DLP1和DLP2,两者干燥后称重,分别为0.384 4和0.982 1 g。2种多糖经高效凝胶渗透色谱鉴定,其峰形基本对称,为单一的纯品多糖,如图2所示。根据“1.2.2”方法得到标准曲线为logMw=-0.506 4tR+13.508 8(r=0.999 3),相对分子质量测定结果见表1。
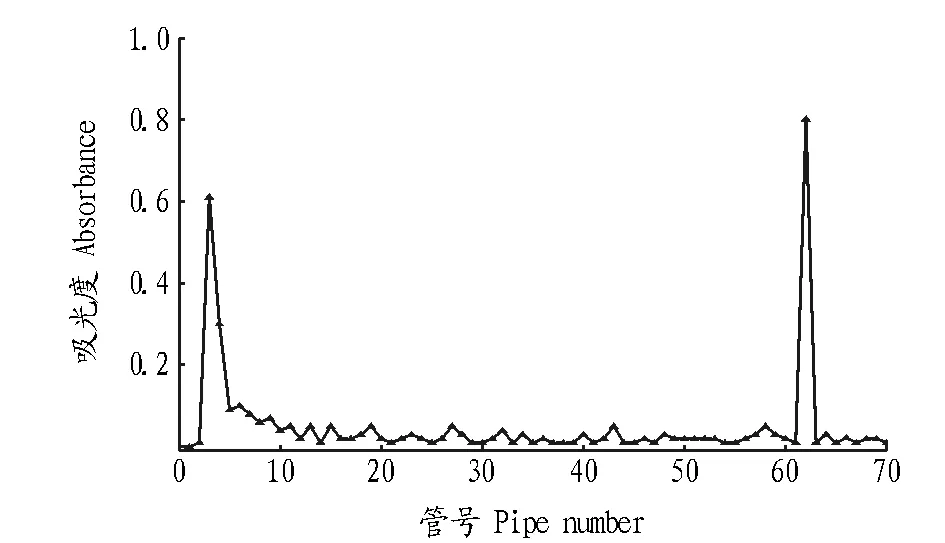
图1 DLP的DEAE-52柱层析洗脱曲线Fig.1 Elution curve of DLP by DEAE-52
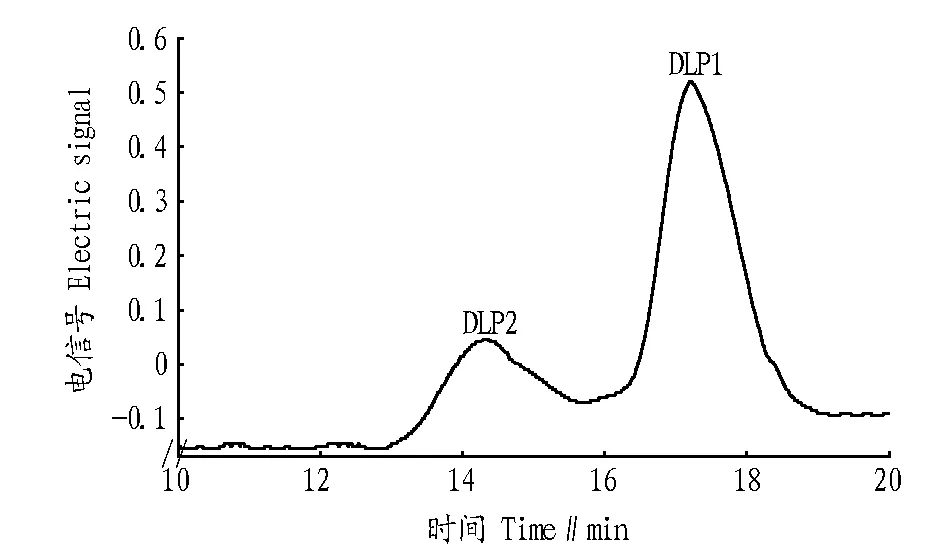
图2 DLP1和DLP2的凝胶色谱图Fig.2 Gel chromatograms of DLP1 and DLP2
2.2多糖的组成成分多糖经酸水解乙酰化后,由气象色谱测定,经样品与混标品图进行对照和峰面积比较,得DLP1由岩藻糖、鼠李糖、阿拉伯糖、葡萄糖和半乳糖组成(图3),其质量比为111.25∶17.81∶1∶12.43∶2.43;DLP2由岩藻糖、鼠李糖、阿拉伯糖、葡萄糖、半乳糖和甘露醇组成(图4),其质量比为198.22∶3.27∶9.16∶25.06∶10.96∶1。

表1 相对分子质量测定结果

图3 DLP1的气象色谱图Fig.3 GC chromatogram of DLP1

图4 DLP2的气象色谱图Fig.4 GC chromatogram of DLP2
3 结论
麻竹竹秆经碱提,透析,醇沉,DEAE-52纤维柱分离纯化后,得到2种多糖DLP1和DLP2,高效凝胶渗透色谱鉴别,均为单一多糖,其相对分子质量分别为61 500和1 780 000 u。经气象色谱分析,2种多糖均由岩藻糖、鼠李糖、阿拉伯糖、葡萄糖和半乳糖等多种单糖组成。竹多糖具有多种的功效,该实验对其分离纯化、相对分子质量测定和单糖组成分析,为资源丰富但利用率低的竹的深入研究和有效开发利用提供重要的依据。
[1] 喻谨,汤锋,岳永德,等.ICP-MS法分析10种箬竹属竹叶中矿质元素质量分数[J].东北林业大学学报,2015,43(2):19-22.
[2] 成聃睿,史正军,刘瑞华,等.龙竹秆材化学成分分析[J].西北林学院学报,2015,30(4):236-239.
[3] 唐国建,杨金梅,丁雨龙,等.空心箭竹化学成分的研究[J].湖北农业科学,2015,54(15):3679-3682.
[4] 孟鑫,谈旭,掌权,等.绿液预处理对毛竹化学成分及酶水解糖化的影响[J].南京林业大学学报,2014,38(4):118-122.
[5] 姚曦,岳永德,汤锋.梁山慈竹挥发油成分的GC/MS分析及抑菌活性评价[J].光谱实验室,2013,30(5):2344-2350.
[6] 姚曦.梁山慈竹(Dendrocalamusfarinosus)竹秆化学成分及生物活性研究[D].北京:中国林业科学研究院,2014:66-71.
[7] 李飞跃,喻国光,陈金珠,等.竹叶主要化学成分分析及其生物活性研究现状[J].江西林业科技,2006(4):34-36.
[8] 任美玲,吕兆林,张柏林.竹叶多糖的研究现状与进展[J].食品工业科技,2012,33(13):383-387.
[9] 冯宇超,王成章,陈文英,等.不同品种竹叶多糖的化学特征及其含量研究[J].林产化学与工业,2009,29(6):81-85.
[10] 黄伟,张志发,杜俊峰,等.箭竹多糖理化分析及对肿瘤抑制作用研究[J].亚太传统医药,2015,11(7):39-41.
[11] 郭磊,管雨晴,李梅云.慈竹竹叶多糖体外抗氧化作用研究[J].食品研究与开发,2013,34(16):9-11.
[12] 张海容,白娟,魏增云,等.超声萃取-响应面法优化淡竹叶多糖提取方法研究[J].化学研究与应用,2013,25(3):303-310.
[13] 任雪峰,吴冬青,林敏,等.响应面分析法优化玉竹多糖提取工艺[J].光谱实验室,2013,30(6):3090-3097.
[14] 李胜华,郁建平.竹叶多糖的提取工艺[J].吉首大学学报(自然科学版),2006, 27(1):118-121.
[15] 周跃斌,王伟,李适,等.竹叶多糖提取条件的优化[J].湖南农业大学学报(自然科学版),2006,32(2):206-209.
[16] 毛燕,王学利.毛竹叶枝多糖提取的对比研究[J].林产化工通讯,2001, 35(2):11-13.
[17] 陈亮,张炜,陈元涛,等.响应曲面法优化黑果枸杞多糖的超声提取工艺[J].食品科技,2015, 40(1): 220-226.
[18] 叶林,张虹.质谱及色谱-质谱联用技术在多糖结构分析中的应用[J].理化检验-化学分册,2010,46(11):1355-1359.
[19] 周跃斌,王 伟,周向荣,等.毛竹竹叶多糖分离与纯化技术研究[J].食品科学,2008,29 (8):156-159.
[20] 姚曦,岳永德,汤锋.梁山慈竹(Dendrocalamusfarinosus)竹秆水溶性多糖的分离提取及结构分析[J].食品工业科技,2015(20):120-123.
[21] 吴金松.大叶麻竹笋多糖的分离纯化和鉴定[D].重庆:西南大学,2015:57-77.
[22] QIN H L,LI Z H,WANG P.A new furostanol glycoside from polygonatum odoratum[J].Chinese chemical letters,2003,14(12):1259-1260.
[23] 刘康莲,冯定坤,贺银菊,等.超声波辅助法提取麻竹叶多糖及其工艺优化[J].食品科技,2014,39(10):238-240.
Determination of Relative Molecular Weight of Polysaccharides Extracting by Alkali Solution from the Pole ofDendrocalamuslatiflorusand Analysis of Their Monosaccharide Composition
PAN Wen-hui1, RAN Qi-ping1*, BIAN Qing-quan2
1. College of Life Science and Biotechnology, Mianyang Teachers’ College, Mianyang, Sichuan 621000; 2. College of Chemistry and Chemical Engineering, Mianyang Teachers’ College, Mianyang, Sichuan 621000)
[Objective] To know more about bamboo.[Method] The polysaccharides in the pole ofD.latifloruswere extracted by alkali solution. The proteins were removed by Sevag agent from extraction. The polysaccharides in extraction were precipitated by alcohol of 95%, and then dialyzed by dialysis bag, separated by DEAE-52 cellulose column. Polysaccharides of DLP1 and DLP2 were obtained, and their relative molecular weights were measured and monosaccharide compositions were analyzed.[Result] The relative molecular weights of polysaccharides DLP1 and DLP2 were detected to be 61 500 and 1 780 000 u. Their monosaccharide composition was determined by gas chromatography. DLP1 was composed of fucose (Fuc), rhamnose (Rha), alabinose (Ala), glucose (Glu) and galactose (Gal) at a quality ratio of 111.25∶17.81∶1∶12.43∶2.43. DLP2 was composed of fucose (Fuc), rhamnose (Rha), alabinose (Ala), glucose (Glu), galactose (Gal) and mannitol (Mnt) at a quality ratio of 198.22∶3.27∶9.16∶25.06∶10.96∶1.[Conclusion] The work laid a good foundation for studying on polysaccharides ofD.latiflorus, and provided scientific basis for further development of bamboo resource.
Polysaccharide inD.latiflorus; Alkali solution extraction; Relative molecular weight; Composition analysis
四川省教育厅自然科学研究项目(13ZB0115);绵阳师范学院项目(MA2010005)。
潘文慧(1975- ),女,湖北黄冈人,讲师,硕士,从事色谱分析工作。
2016-07-14
S 795.5
A
0517-6611(2016)26-0010-03

