基于渗透胁迫的马铃薯试管苗抗旱评价体系的构建
娄 艳,白江平,杨宏羽,高慧娟,张俊莲,王蒂
(1.甘肃省作物遗传改良与种质创新重点实验室/甘肃省干旱生境作物学重点实验室, 甘肃 兰州 730070;2.甘肃农业大学农学院, 甘肃 兰州 730070; 3.甘肃农业大学园艺学院, 甘肃 兰州 730070)
基于渗透胁迫的马铃薯试管苗抗旱评价体系的构建
娄艳1,2,白江平1,2,杨宏羽1,3,高慧娟1,2,张俊莲1,2,王蒂1,2
(1.甘肃省作物遗传改良与种质创新重点实验室/甘肃省干旱生境作物学重点实验室, 甘肃 兰州 730070;2.甘肃农业大学农学院, 甘肃 兰州 730070; 3.甘肃农业大学园艺学院, 甘肃 兰州 730070)
为探明抗旱生理生化机制和筛选抗旱品种,建立科学有效的马铃薯实验室抗旱评价体系,本研究分析了不同浓度PEG (polyethylene glycol6000) 对CIP 397098.12、CIP 391180.6、CIP 391724.1、CIP 392745.7、CIP 392759.1、CIP 393613.2、CIP 397035.26、CIP 302476.108、CIP 304345.102、CIP 304405.47、CIP 391930.1、CIP 391931.1、陇薯3号及Atlantic马铃薯品种试管苗生理生化指标的影响,并利用隶属函数分析方法对供试材料的综合抗旱能力进行了评价。结果表明:随着PEG浓度的增加,马铃薯试管苗的地上部分及根系生长受到严重的抑制,对马铃薯试管苗的根系长度的抑制作用更明显。当PEG浓度为9% 时,14个马铃薯品种间生长指标的差异最大,试管苗株高、根系长度等5个生长指标均显著低于对照,说明9%是用于鉴定不同马铃薯品种试管苗对水分胁迫响应的最适浓度。根据综合抗旱评价值对供试马铃薯材料的抗旱性进行了排序,由强到弱依次为:陇薯3号、CIP 391930.1、CIP 397098.12、CIP 391931.1、CIP 304405.47、CIP 392759.1、CIP 397035.26、CIP 393613.2、CIP 302476.108、CIP 304345.102、CIP 391180.6、Atlantic、CIP 391724.1、CIP 392745.7。
马铃薯;水分胁迫;生理生化指标;隶属函数法
马铃薯根系较浅,对水分亏缺比较敏感[1]。水分亏缺会对植物的生长状况、形态结构与生理生化代谢产生显著影响[2-3],进而影响其生长发育并导致其品质下降,严重时可导致大幅度减产。因此,了解马铃薯种质资源的抗旱机理,评价及鉴定其抗旱性,可为选择、培育耐旱高产的马铃薯种质奠定一定的理论基础。田间试验是鉴定品种抗性,产品品质等的最有效的方法,然而,通过大田室外试验来观察植株在干旱胁迫下的表现特征,进而筛选鉴定不同品种的耐旱性情况不仅费时、费力,还会受环境及观察者个人偏好等的影响而造成一定误差,而试管苗组织培养技术可以在短时间内快速对不同基因型品种在不同生长阶段的逆境承受能力情况进行研究,因此,植物组织培养便成了研究植物耐性机制的有用工具。
Heyser等[4]首次以PEG作为诱导剂和筛选剂筛选出抗旱的烟草细胞系以来,高分子量的聚乙二醇(PEG)(分子量≥6000)常作为一种非穿透渗透剂被广泛用于植物研究领域。大量研究表明:用PEG6000诱导水分胁迫所达到的效果与土壤逐步干旱所造成的效果是相似的,因此,用PEG6000来模拟水分胁迫是可行的[5-6]。邓珍等[7]用PEG8000模拟水分胁迫研究了11个马铃薯品种脱毒试管苗在不同浓度PEG胁迫下生长指标的变化,并利用6个相对指标值,对11个马铃薯品种的干旱敏感性进行了整体聚类分析,崔江慧等[8]通过测定、比较不同浓度PEG6000胁迫下3个高梁品种幼苗中内源抗氧化酶活性变化,对相对抗旱性直接进行了分析、评价。然而,马铃薯的抗旱性是由多种因素综合影响的,通过对其中单一指标的测定或分析很难准确地反映材料的抗性情况,具有一定的片面性。因此,综合各生理生化指标及生长指标评价植物的抗旱性,可以有效地消除因单个指标测定引起的片面性。杨瑰丽等[9-10]利用PEG6000模拟干旱胁迫研究了水稻萌发期8个形态和生理指标的变化,并利用隶属函数分析方法对62份水稻材料抗旱能力进行了综合评价,从62个水稻品种(系)中筛选出了14个高抗旱品种(系)。因此,本研究以14个马铃薯品种试管苗为供试材料,通过PEG6000模拟干旱胁迫,研究了胁迫处理与对照条件下马铃薯试管苗相关生长指标和生理生化指标,并利用隶属函数对供试材料的抗旱能力进行综合评价,从而为建立科学合理的马铃薯实验室抗旱评价体系提供基础。
1 材料与方法
1.1供试材料
试验在2014年10月—2015年1月在甘肃农业大学作物遗传改良与种质创新重点实验室进行,本研究选用12份从国际马铃薯中心(CIP)引进的马铃薯材料和2份甘肃常用马铃薯品种即抗逆性较强的栽培种陇薯3号(L3)和对逆境胁迫较敏感的栽培种大西洋(DXY)脱毒试管苗为试验材料(如表1)。试验共设四个PEG梯度即0(对照)、3%、6%、9%。

表1 14份马铃薯种质材料编号及亲本材料
1.2试验方法
分别配制含有0(m/v)、3%(m/v)、6%(m/v)、9%(m/v)PEG6000的MS固体培养基,待凝固、观察一周后将同一时期转接的长势相对一致的脱毒试管苗为基础苗,在超净工作台上将脱毒试管苗剪成2cm左右的茎段(含2—3个腋芽),接种在分别含有不同PEG的培养基中,每三角瓶接种5~6个茎段,每个品种的不同胁迫处理各接30~40瓶,在25℃、16h/8h昼夜光周期条件下培养40天。
用WinRHIZO2009根系扫描仪进行根系扫描,记录相关数据;用佳能(CANON)EOS 700D单反相机对不同浓度胁迫处理的试管苗进行拍照(附录2),观察、记录其生长状况。超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)光还原法,以单位时间内光还原50%氮蓝四唑(NBT)为1个酶活性单位(U);过氧化物歧化酶(POD)活性的测定采用愈创木酚法,其活性以1g鲜重所含POD在1min内氧化愈创木酚的微克分子数表示;过氧化氢酶(CAT)活性和抗坏血酸过氧化物酶(APX)活性的测定均采用紫外吸收法,分别以每分钟氧化1 μmol H2O2或1 μmol AsA的酶量为1个酶活性单位(U);可溶性蛋白质含量测定采用考马斯亮蓝(G-250)染色法;以鲜重为基础的植株水分含量的测定采用烘干法(Water content,WC),以上测定方法均参照邹奇[11]的植物生理实验指导书并稍作调整,且其中所有酶活性测定均使用U-5100UV型分光光度计。用20 cm的直尺测定株高(Plant height);叶片中叶绿素含量的测定采用浸泡法[12]。
1.3数据处理
数据采用相对值(即耐旱系数[13]K=干旱处理测定值/对照测定值)。试验数据由Excel 2007进行分析处理,所得数据结果运用Origin 8.0进行图形输出,用SPSS19进行方差统计分析及相关性分析。应用模糊数学中的隶属函数进行综合抗旱性评价[9]。
隶属函数计算公式:
(1)
式中,Xj表示第j个指标,Xmax、Xmin分别表示第j指标的最大值和最小值。
权重Wj计算公式:
(2)
式中,Pj表示第j个综合指标的贡献率。
综合抗旱能力(D)的计算公式:
(3)
式中,uj表示第j个综合指标的隶属函数值,Wj表示第j个综合指标的权重。
2 结果与分析
2.1不同浓度PEG对马铃薯试管苗保护酶活性的影响
SOD、POD、CAT、APX等组成植物体内的抗氧化保护酶系统,能及时清除植物体内过剩的活性氧自由基,从而使植物体免受过氧化伤害。随着PEG浓度的增加,14个马铃薯品种中CAT、SOD、POD活性整体呈先上升后下降的趋势(图1A、1B、1C)。
在3%、6% PEG胁迫下品种12的SOD活性增加幅度最小,相比于其他品种,品种L3始终维持较高的SOD活性。除CIP 391930.1外所有品种的SOD均在PEG浓度增加到6% 时达到最大值;POD 测定中CIP 302476.108始终维持较高的POD活性,在3%、6%、9% PEG胁迫下相对于对照依次升高15.24%、11%、0.99%;而CIP 391180.6始终维持较高的CAT活性。APX活性(图1D)变化规律性不是很强,总体变化趋势是先升高后降低,而在CIP 397098.12、CIP 304345.102中APX活性则随胁迫程度的加剧呈持续上升的趋势。
2.2不同浓度PEG对马铃薯试管苗可溶性蛋白含量的影响
可溶性蛋白作为渗透调节物质在植物对逆境胁迫的响应中起着积极的作用。本研究中随着胁迫程度的加剧,部分马铃薯品种试管苗中可溶性蛋白的含量呈现先下降后上升再下降的变化,也有部分呈先上升后下降的趋势(图2)。在3% PEG轻度胁迫下,CIP 392745.7相对于对照增加的量最小,为0.25%,L3相对于对照增加的量最大,为18.09%,而CIP 393613.2却相对于对照下降了24%,是14个供试马铃薯品种中下降幅度最大的。在9% PEG重度水分胁迫下,除CIP 391724.1、CIP 392759.1、CIP 304345.102中可溶性蛋白含量低于对照水平外,其余品种中其含量均维持在高于对照的水平,可使植物细胞的渗透势维持在较低的水平,以增强植物对水分胁迫的抵抗。
2.3不同浓度PEG对马铃薯试管苗叶绿素含量的影响
植物叶片内叶绿素含量的高低通常是反映其光合能力强弱的重要指标之一。随着PEG浓度的增加,马铃薯试管苗其叶片内叶绿素a、叶绿素b及类胡萝卜素含量整体变化并无明显的规律性(图3A、3B、3C)。相对于大部分品种而言,这三种叶绿素含量均随胁迫程度的加强而呈持续下降的趋势,但CIP 304345.102、CIP 304405.47、CIP 391930.1和DXY等四个品种中叶绿素a、叶绿素b及类胡萝卜素含量均呈先下降后升高再下降的趋势。而CIP 391931.1中类胡萝卜素含量呈现升高后下降的趋势。


图1 PEG渗透胁迫对马铃薯试管苗SOD、POD、CAT及APX含量的影响
图2PEG渗透胁迫对马铃薯试管苗可溶性蛋白含量的影响
Fig.2Effects of PEG osmotic stress on soluble protein contents of potato plantlets
2.4不同浓度PEG对马铃薯试管苗生长的影响
马铃薯试管苗受到PEG模拟水分胁迫后,其生长状况因品种、胁迫浓度而异,受到不同程度的影响,随着PEG浓度的不断增加,马铃薯试管苗的地上部分及根系生长受到越来越严重的影响(附录1)。
在不含PEG的正常处理下14个品种各生长指标有较明显的差异,这可能与品种之间遗传基础的不同有关。在3%、6%及9% PEG胁迫下,所有马铃薯品种试管苗的各相对生长指标的平均值,均呈现逐渐下降的趋势。通过方差分析对每个品种在不同浓度PEG胁迫下的生长指标进行了分析(附录1),并对14个不同马铃薯品种在PEG浓度为3%、6%、9%下相对生长指标[14](即处理生长指标与对照生长指标的比值)的平均值大小、标准差及其变异系数进行了计算(表2)。

图3PEG渗透胁迫对马铃薯试管苗叶绿素a、叶绿素b及类胡萝卜素含量的影响
Fig.3Effects of PEG osmotic stress on chlorophyll a, chlorophyll b and carotenoid contents of potato plantlets

表2 不同胁迫条件下各生长指标的比较
在3% PEG胁迫下,14个品种中,除CIP 397035.26的株高与其对照间没有显著差异,CIP 302476.108的根长与根系表面积与其相应对照间差异不显著外,其余各品种的株高、根长、根系体积、根系表面积均与其对照间具有显著差异。然而,在对不同马铃薯品种地上部分组织含水量的分析中发现大部分品种均与其对照间没有显著差异。在9%PEG渗透胁迫下,相对根长、相对根系表面积、相对根系体积及相对含水量的变异系数分别为82.13%、52.46%、37.73%、3.44%,均较大于6%PEG胁迫处理下的变异系数(表2),表明在 PEG为9%的胁迫下,测得的各生长指标值间差异明显,能更好地反映不同马铃薯品种之间的差异。因此,9%PEG是鉴定不同马铃薯品种试管苗对水分胁迫反应的最佳浓度。且在该胁迫下,供试马铃薯材料的平均相对根系长度为7.99%,变异系数为82.13%,是5个生长指标中变化最大的指标,说明马铃薯试管苗的根系长度更易在水分胁迫下受到影响。
2.59% PEG6000胁迫下马铃薯试管苗抗旱性的综合评价
在对9% PEG胁迫下马铃薯试管苗的相关生理生化指标及生长指标进行相关性分析(表3),结果表明,POD活性与根系长度、根系表面积,叶绿素a含量与叶绿素b、类胡萝卜素含量及根系长度与根系表面积间有极显著的相关性(P<0.01),CAT活性与株高,根系体积与根系长度、根系表面积间存在显著的相关性(P<0.05),表明POD活性与根系的生长状况关系密切,CAT活性更偏向于与植株地上部分生长相关,三种叶绿素之间互相影响,根系面积的大小则主要受根系长度影响。
利用SPSS statistic19统计软件对不同马铃薯在9% PEG模拟水分胁迫下的各个抗旱指标进行主成分分析,前五个指标的累计贡献率已达81.78%(表4)。由表5可知,POD、根系长度、根系表面积、根系体积在第一个主成分上有较高的载荷,说明第一主成分能基本反映这几个指标的信息。同理,叶绿素a与叶绿素b、类胡萝卜素在第二个主成分上有较高的载荷,SOD、可溶性蛋白、株高在第三个主成分上有较高的载荷,APX在第四个主成分上有较高的载荷,CAT和地上部分组织含水量在第五个主成分上有较高的载荷,也就是说提取的五个主成分能基本反映13个指标的信息。因此,用前五个主成分代替全部的13个指标,组成新的综合指标对供试马铃薯材料进行抗旱性评价分析,依次命名为(Comprehensive Index, CI)CI1、CI2、CI3、CI4、CI5。利用公式(1),分别计算出14份供试马铃薯材料在五个新的综合指标下的隶属函数值Uj(表6),再由公式(2)计算出个综合指标的权重值Wj(表7),依次为0.311,0.250,0.174,0.137,0.129,最后用公式(3)计算各马铃薯材料的综合抗旱能力值D的大小(表6)。根据D值的大小就可以对不同品种马铃薯试管苗的抗旱能力强弱进行排序。由表6可知,品种L3的D值最大,表明品种L3在9%PEG模拟水分胁迫下抗旱性最强;AS的D值最小,表明AS在9% PEG模拟水分胁迫下抗旱性最弱。14份供试马铃薯材料的抗旱性由强到弱依次为: L3、CIP 391930.1、CIP 397098.12、CIP 391931.1、CIP 304405.47、CIP 392759.1、CIP 397035.26、CIP 393613.2、CIP 302476.108、CIP 304345.102、CIP 391180.6、DXY、CIP 391724.1、CIP 392745.7。
3 讨论与结论
本研究发现,14个马铃薯品种的试管苗在3% PEG轻度水分胁迫下,其CAT、SOD、POD活性均相对于其对照上升,而在6%、9% PEG胁迫下,因品种对水分胁迫的敏感差异,抗性强的品种中CAT、SOD、POD活性仍呈持续的上升趋势,而抗性弱的品种则有下降趋势,这与崔江慧等[8,15-16]研究报道是一致的,而这与贾琼等[17]在PEG模拟水分胁迫试验中指出的马铃薯叶片中SOD活性在轻度水分胁迫下活性下降,而在中、重度水分胁迫下活性有上升趋势的结论并不一致。一方面,可能是由于研究所用马铃薯材料自身特性的差异及其酶活性测定所选组织的不同引起的;另一方面,本研究选取生长相对一致的供试马铃薯试管苗茎段接种在分别含有0%、3%、6%、9% PEG的MS固体培养基上进行培养,并对其生理生化指标的变化进行比较分析,这与李建武等[16]用不同浓度的PEG溶液对培养的长出大量根系的试管苗进行根际水分胁迫及贾琼等分别用15%、20%、25%的PEG溶液浸泡从田间采集的马铃薯叶片24 h,测定相关生理指标的水分胁迫研究方法有较大的差异。另外,本研究在含有不同浓度PEG的MS培养基配制上是通过将准确配制并经过滤灭菌的PEG的标准液与经高温高压灭菌的MS固体培养基,待其降温凝固前迅速按一定的比例进行混合配置而成,然后将配好的培养基置于培养室观察3~5 d,一方面保证其中PEG充分渗透,另一方面也可观察是否有污染发生。这与邓珍等[7]用分别含有PEG8000的1/2MS液体培养基与液体培养基等体积混合,待固体培养基和液体培养基平衡48 h后,把上层液体培养基从培养瓶中倒掉的配制方法相比,既保证了两种液体通过混合阶段的充分震荡和3~5 d的放置观察,使PEG得到充分渗透,同时也避免了后者因从培养瓶中倒掉上层液体培养基而可能引起的PEG误差。大量研究表明一般抗旱性强的品种能始终维持较高的酶活性,且不同程度胁迫前后变化幅度不会太大,说明相比于抗旱性弱的品种,抗旱性强的品种可能具有强的抗氧化保护酶合成和调节系统,能更加有效地清除植物体内的活性氧自由基[3,18]。APX活性在马铃薯试管苗受不同程度PEG胁迫后变化并无明显规律,总体变化趋势是先升高后降低,这与周洁等[19]对苍术幼苗在干旱胁迫下的相关研究中指出的APX活性随着水分胁迫的加剧呈先上升后下降的趋势,且在高浓度胁迫下变化幅度更大的结论一致。
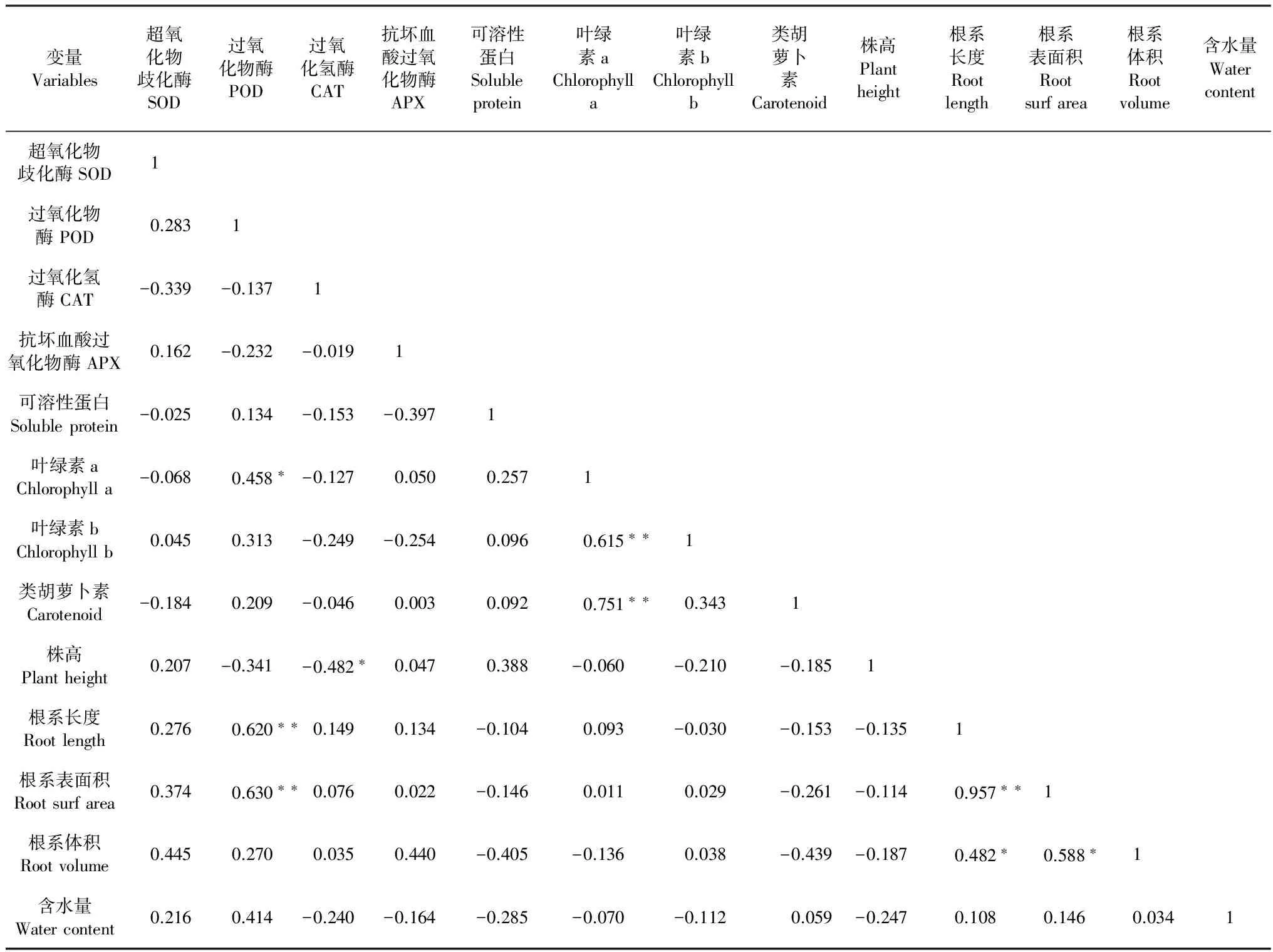
表3 9% PEG胁迫下马铃薯生理生化指标间的相关矩阵
注:“*”、“**”分别表示在0.05、0.01水平的显著相关。

表4 基于9% PEG胁迫下马铃薯各抗旱变量解释的总方差

表5 基于9% PEG胁迫下马铃薯各抗旱变量的成份矩阵

表6 不同马铃薯种质资源在五个综合指标下的隶属函数值及综合评价值D

表7 基于9% PEG胁迫下马铃薯抗旱性指标综合指标CIx的特征值、特征向量及权重
随着胁迫程度的加剧,部分马铃薯品种试管苗中可溶性蛋白的含量呈现先下降后上升再下降的变化,也有部分呈先上升后下降的趋势(图2)。据李妮亚等[20]的研究,在盐、干旱等逆境胁迫下,植物体内正常蛋白质的合成过程会受到抑制,但同时会诱导出一些与逆境胁迫相关的新蛋白质出现或使原有蛋白质的含量明显增加。所以,当马铃薯受到水分胁迫后,其植株体内可溶性蛋白含量的增加,可能是由于在干旱逆境下诱导合成了活性更强、性质稳定的同工酶,也可能是由于新合成的高活性同工酶取代了干旱条件下活性不稳定的酶的结果,而在低浓度胁迫下试管苗中可溶性蛋白含量有所下降可能是由于正常蛋白质合成受到抑制,且新逆境蛋白的诱导产生相对滞后引起的。
随胁迫程度的加强,大部分品种试管苗叶片内叶绿素a、叶绿素b及类胡萝卜素含量均呈持续下降的趋势,这与大量研究报道[21-23]是相符的,而与寿惠霞等[24]在对春大豆苗期干旱胁迫的研究中指出的受到水分胁迫后,大豆幼苗叶片叶绿素含量迅速增加的结论并不一致,这可能是由于水分胁迫加速了植物叶片内叶绿素的分解,同时抑制其合成过程,从而使叶绿素含量有减小造成的;同时,部分品种试管苗叶片内叶绿素a、叶绿素b及类胡萝卜素含量呈先下降后升高再下降的趋势,这与高蕾等[25]的研究结果一致,可能是由于受到水分胁迫后叶片的相对含水率下降,使叶片内的叶绿素含量因发生浓缩而使单位叶面积上叶绿素浓度有升高引起的。14个不同品种马铃薯试管苗的地上部株高、地上部组织含水量及根系的相对生长也随着胁迫浓度的增加均受到严重的影响,且胁迫浓度越大,受影响则越严重,这与前人的研究报道是相一致的[26-27]。
马铃薯的抗旱性是由多种因素综合影响的,其对干旱的胁迫响应也是通过多种指标(如生长指标、形态指标及生理生化指标等)综合反映的,因此,对其中单一指标的测定或分析很难准确地反映材料的抗旱性强弱。利用马铃薯试管苗受水分胁迫前后各生长、生理生化指标的相对值进行的主成分分析、隶属函数统计方法对供试马铃薯材料的抗旱性进行综合评价,可以有效、全面地评价马铃薯种质材料的抗旱性,避免因单一指标测定而造成的片面性[9,28-31]。本研究用五个累计贡献率已达81.78%的主成分来代替全部的13个指标对供试马铃薯材料进行抗旱性评价分析,简便易行。当然,马铃薯的抗旱性是一个综合特征,可以发生在其生长发育的各个阶段,马铃薯不同生育期对水分的需求不同,对水分胁迫的响应机制也有差异,因此,本研究针对于室内马铃薯试管苗筛选的指标是否适于其他生育阶段或大田的生长的鉴定,仍有待进一步的研究和验证。
[1]Gopal J, Iwama K. In vitro screening of potato against water-stress mediated through sorbitol and polyethylene glycol[J]. Plant Cell Reports, 2007,26(5):693-700.
[2]焦志丽,李勇,吕典秋,等.不同程度干旱胁迫对马铃薯幼苗生长和生理特性的影响[J].中国马铃薯,2011,25(6):329-333.
[3]抗艳红,龚学臣,田再民,等.聚乙二醇处理马铃薯脱毒试管苗的生理反应[J].江苏农业科学,2011,39(2):162-164.
[4]Heyser J W, Nabors M W. Osmotic adjustment of tobacco cells and plants to penetrating and non-penetrating solutes[J]. Plant Physiology, 1979,63(5):63-77.
[5]Deblonde P M K, Ledent J F. Ledent.Effects of moderate drought conditions on green leaf number, stem height, leaf length and tuber yield of potato cultivars[J]. European Journal of Agronomy, 2001,14(1):31-41.
[6]Ekanayake I J, Midmore D J. Genotypic variation for root pulling resistance in potato and its relationship with yield under water-deficit stress[J]. Euphytica, 1992,61(1):43-53.
[7]邓珍,徐建飞,段绍光,等.PEG-8000模拟干旱胁迫对11个马铃薯品种的组培苗生长指标的影响[J].华北农学报,2014,29(5):99-106.
[8]崔江慧,李霄,常金华.PEG模拟干旱胁迫对高粱幼苗生理特性的影响[J].中国农学通报,2011,27(9):160-165.
[9]杨瑰丽,杨美娜,李帅良,等.水稻萌芽期抗旱指标筛选与抗旱性综合评价[J].华南农业大学学报,2015,36(2):1-5.
[10]刘华,王峰,李娜,等.隶属函数值法对12个树种抗旱性的综合评价[J].中国农村小康科技,2010,(10):39-41.
[11]邹奇.植物生理实验指导[M].北京:中国农业出版社,2000.
[12]白宝璋,朱广发,陈颖,等.玉米光合色素含量快速测定[J].玉米科学,1994,2(2):77-79.
[13]袁菊红,屠乃美,胡绵好,等.水稻和陆稻品种抗旱性综合评价[J].中国农学通报,2005,21(6):167-170.
[14]王俊娟,叶武威,王德龙,等.PEG胁迫条件下41份陆地棉种质资源萌发特性研究及其抗旱性综合评价[J].植物遗传资源学报,2011,12(6):840-846.
[15]贾学静,董立花,丁春邦,等.干旱胁迫对金心吊兰叶片活性氧及其清除系统的影响[J].草业学报,2013,22(5):248-255.
[16]李建武,王蒂.水分胁迫对马铃薯试管苗抗氧化酶活性的影响[J].北方园艺,2008,(1):7-9.
[17]贾琼,张冬红,蒙美莲,等.PEG6000渗透胁迫对马铃薯生理特性的影响[J].中国马铃薯,2009,23(5):263-267.
[18]李建武,王蒂,雷武生.干旱胁迫对马铃薯叶片膜保护酶系统的影响[J].江苏农业科学,2007,(3):100-103.
[19]周洁,黄璐琦,郭兰萍,等.干旱胁迫下苍术幼苗生理特性变化研究[J].中国中药杂志,2008,33(19):2163-2166.
[20]李妮亚,曹翠玲.干旱对小麦幼苗诱导蛋白表达与某些生理特性的初步探讨[J].西北植物学报,1997,17(2):210-216.
[21]刘玉英,易红华,徐泽.干旱胁迫对不同茶树品种叶绿素含量的影响[J].南方农业,2007,1(1):68-70.
[22]董守坤,赵坤,刘丽君,等.干旱胁迫对春大豆叶绿素含量和根系活力的影响[J].大豆科学,2011,30(6):949-953.
[23]何广礼,忠乃.干旱胁迫对盆栽小黑麦生物学特性及叶绿素含量的影响[J].畜牧与饲料科学,2010,31(10):54-56.
[24]寿惠霞,朱丹华,陈彩霞,等.8个春大豆品种对旱境的反应及抗旱指标初探[J].浙江农业科学,1991,(6):278-281.
[25]高蕾,刘丽君,董守坤,等.干旱胁迫对大豆幼苗叶片生理生化特性的影响[J].东北农业大学学报,2009,40(8):1-4.
[26]王瑾,刘桂茹,杨学举.PEG胁迫下小麦再生植株根系特性与抗旱性的关系[J].麦类作物学报,2006,26(3):117-119.
[27]秦玉芝,陈珏,刘明月,等.聚乙二醇模拟干旱对马铃薯幼苗生长与细胞膜透性的影响[J].湖南农业大学学报(自然科学版),2011,37(6):627-631.
[28]周广生,周竹青.用隶属函数法评价小麦的耐湿性[J].麦类作物学报,2001,21(4):34-37.
[29]栗燕,黎明,袁晓晶,等.干旱胁迫下菊花叶片的生理响应及抗旱性评价[J].石河子大学学报,2011,29(1):30-34.
[30]张朝阳,许桂芳.利用隶属函数法对4种地被植物的耐热性综合评价[J].草业科学,2009,26(2):57-60.
[31]张耿,高洪文,王赞,等.偃麦草属植物苗期耐盐性指标筛选及综合评价[J].草业学报,2007,16(4):55-61.
附录

续附录1 Continue appendix 1

品种浓度PEG株高/cmPlantheight根长/cmRootlength根系表面积/cm2RootsurfArea根系体积/cm3Rootvolume含水率WatercontentCIP393613.2CIP397035.26CIP302476.108CIP304345.102CIP304405.47CIP391930.1CIP391931.1L3DXY0%7.00±0.71a62.56±6.33a8.41±1.19a0.090±0.017a0.89±0.01A3%3.45±0.35b19.18±4.56b2.40±0.14b0.024±0.003b0.87±0.02A6%2.40±0.69c11.70±2.59c1.81±0.33bc0.015±0.001b0.85±0.03A9%2.15±0.21c4.07±2.14d0.73±0.05c0.012±0.005b0.84±0.01A0%5.40±0.26a63.14±9.33a8.88±1.61a0.100±0.022a0.89±0.01A3%5.07±0.25a8.90±1.21b1.37±0.30b0.017±0.006b0.87±0.01B6%3.35±0.21b3.24±0.34b0.67±0.01b0.011±0.001b0.85±0.01C9%2.60±0.28c3.01±0.84b0.55±0.01b0.010±0.001b0.80±0.01D0%7.80±0.72a45.66±3.73a5.81±1.51a0.052±0.002a0.92±0.01A3%5.60±0.57b42.85±3.37a5.11±0.49a0.046±0.003b0.91±0.02B6%3.33±0.65c7.04±0.15b0.93±0.17b0.015±0.004c0.87±0.02AB9%1.40±0.14d1.36±1.04c0.44±0.32b0.010±0.001d0.84±0.02B0%4.10±0.14a38.18±0.01a5.72±0.01a0.067±0.001a0.92±0.01A3%2.80±0.14b15.78±6.39b2.16±1.07b0.024±0.013b0.86±0.01B6%2.25±0.35c1.62±0.13c1.28±0.02c0.014±0.001c0.84±0.01C9%1.80±0.01d1.17±0.01c0.43±0.01d0.012±0.001c0.78±0.01D0%5.37±0.12a93.55±0.72a12.5±0.28a0.133±0.005a0.91±0.02A3%3.65±0.21b31.42±2.75b4.03±0.65b0.041±0.011b0.88±0.01A6%3.40±0.28c22.19±0.01c2.40±0.01c0.020±0.001c0.87±0.01A9%2.45±0.07d10.44±1.34d1.41±0.05d0.016±0.001c0.84±0.01A0%7.70±0.89a36.04±5.22a4.16±0.23a0.038±0.011a0.92±0.01A3%6.30±0.42b16.54±4.49b2.14±0.32b0.022±0.001b0.90±0.02A6%3.30±0.26c10.27±5.62bc1.29±0.59c0.013±0.004b0.89±0.02A9%2.75±0.07c6.70±0.40c0.83±0.06c0.009±0.001c0.89±0.01A0%5.25±0.92a67.21±6.29a8.04±0.81a0.077±0.011a0.89±0.01A3%4.40±0.01b30.23±8.47b4.18±1.12b0.046±0.012b0.88±0.03A6%4.00±0.01b7.14±2.09c0.90±0.11c0.010±0.001c0.87±0.01A9%1.90±0.14c1.97±0.01c0.43±0.01c0.008±0.001c0.82±0.02B0%14.35±0.21a60.93±2.29a7.79±0.85a0.068±0.004a0.92±0.01A3%7.45±0.49b30.69±6.17b3.41±0.11b0.018±0.008b0.90±0.02A6%4.25±0.35c21.78±0.50b2.87±0.07b0.018±0.008b0.90±0.01A9%2.90±0.28d14.98±1.30b1.54±0.25c0.013±0.003b0.83±0.01B0%9.55±0.35a64.24±1.85a7.33±2.64a0.067±0.028a0.92±0.01A3%2.50±0.28b16.27±1.17b2.93±0.09b0.022±0.002b0.89±0.01A6%2.35±0.21bc8.18±0.98c0.91±0.17b0.008±0.001b0.85±0.01B9%1.95±0.35c1.80±0.19c0.35±0.11b0.006±0.003b0.84±0.03B
注:表中所有数据均用三次重复试验的平均值±标准误表示。每个项目中相同大写字母表示同一品种的不同处理在1%水平上无显著差异。每个项目中相同小写字母表示同一品种的不同处理在5%水平上无显著差异。
Note: Data in table are shown as means ± SE of three times. The same capital letters in the same items are no significant difference at 1% level. The same capital letters in the same items are no significant difference at 5% level.

附录2 PEG6000梯度胁迫下马铃薯试管苗生长情况
注:图中0、3、6、9分别代表PEG6000浓度为0%、3%、6%、9%。
Note: Number 0, 3, 6, 9 in figures represent the concentration of PEG6000 0%, 3%, 6%, 9%, respectively.
Establishment of an evaluation system on drought resistance of potato plantlets based on osmotic stress
LOU Yan1,2, BAI Jiang-ping1,2, YANG Hong-yu1,3, GAO Hui-juan1,2, ZHANG Jun-lian1,3, WANG Di1,2
(1.Gansu Key Laboratory of Crop Improvement and Germplasm Enhancement/Gansu Provincial Key Laboratory ofAridlandCropScience,Lanzhou,Gansu730070,China;2.CollegeofAgronomy,GansuAgriculturalUniversity,Lanzhou,Gansu730070,China;3.CollegeofHorticulture,GansuAgriculturalUniversity,Lanzhou,Gansu730070,China)
To explore the physiological and biochemical mechanism of drought resistance and establish an efficient drought-resistant evaluation system on potato plantlets, the effect of the PEG (polyethylene glycol 6000) simulated drought stress on the physiological and biochemical parameters for plantlets of potato varieties including CIP 397098.12, CIP 391180.6, CIP 391724.1, CIP 392745.7, CIP 392759.1, CIP 393613.2, CIP 397035.26, CIP 302476.108, CIP 304345.102, CIP 304405.47, CIP 391930.1, CIP 391931.1, Longshu3 and Atlantic, and the drought-resistant abilities of testing materials were comprehensively evaluated using the method of Subordinate Function Analysis. The results showed that increase of PEG concentration inhibited the growth of potato seedlings, especially the length of root system that was seriously affected. When 9% PEG was applied, five growth indicators of the samples, such as plant height, root length, etc., were significantly lower than those in the control samples. Therefore, 9% PEG6000 was the optimal concentration to simulate water stress for potato seedlings. According to the value of the comprehensive evaluation, drought resistance of these varieties from strong to weak could be ranked as follows: Longshu3>CIP 391930.1>CIP 397098.12>CIP 391931.1>CIP 304405.47>CIP 392759.1>CIP 397035.26>CIP 393613.2>CIP 302476.108>CIP 304345.102>CIP 391180.6>Atlantic>CIP 391724.1>CIP 392745.7.
potato; water stress; physiological and biochemical indicators; subordinate function method
1000-7601(2016)05-0015-12
10.7606/j.issn.1000-7601.2016.05.03
2015-06-08
科技部国际科技合作项目(2014DFG31570);甘肃科技基金(1308RJZA131,1308RJIA005);兰州科技研究项目(2013-4-156)
娄艳(1989—),女,甘肃临夏人,硕士,主要从事马铃薯遗传育种研究。 E-mail:lou-yan0931@163.com。
白江平(并列第一作者),男,甘肃天水人,副教授,硕士生导师,研究方向为作物遗传育种。E-mail:baijp@gsau.edu.cn。
王蒂(1955-),男,陕西长安人,教授,博士生导师,主要从事作物遗传育种研究。 E-mail: wangd@gsau.edu.cn。
S332.1
A

