波尔山羊钩端螺旋体病的诊断
崔占伟,黄建军,黄 真,余连喜
(1.长江大学动物科学学院,湖北 荆州 434025;2.湖北省江陵县畜牧兽医局,湖北 江陵 434101)
波尔山羊钩端螺旋体病的诊断
崔占伟1,黄建军2,黄 真2,余连喜2
(1.长江大学动物科学学院,湖北 荆州 434025;2.湖北省江陵县畜牧兽医局,湖北 江陵 434101)
对某羊场送检的1月龄病羊,进行临床观察、问诊及实验室检测。病羊精神萎靡,眼结膜发黄,尿液呈茶黄色;剖检可见心包和腹腔有大量淡黄色透明积液,血液和腹腔积液涂片镜检,发现疑似钩端螺旋体。以静脉血和腹腔积液中提取的DNA为模板,用钩端螺旋体16S rDNA特异性引物进行PCR检测,均呈核酸阳性,扩增出与阳性对照同等大小的片段,表明病羊为钩端螺旋体感染。
波尔山羊;钩端螺旋体;诊断
钩端螺旋体病又称“外耳病”(Weil′s diseases),是由钩端螺旋体(leptospira interrogans sensu lato,简称钩体)引起的一种在世界各地都广泛流行的人兽共患的自然疫源性传染病[1]。钩端螺旋体可感染包括人在内的多种动物,鼠、兔等啮齿类动物是其主要的传染源。该病最早由外耳(Weil)于1886年首次报道[2],我国关于该病的报道最早见于1937年汤泽光报道的广州3例人“外耳病”[3]。该病对人和动物健康危害较大,尤其在雨水充沛、气候湿润的南方更为严重,是我国重点防治的人畜共患传染病之一[4]。
2015年10月持续的秋雨过后,湖北省某羊场不断出现1月龄左右羔羊死亡现象。临床观察病羔羊精神萎靡,消瘦无力,眼结膜发黄,部分腹泻,尿液呈茶色。剖检可见肝脏出血,心包和腹腔可见大量淡黄色透明积液。采集病羊血液和心包积液涂片,经实验室诊断确诊为羊钩端螺旋体病。
1 材料与方法
1.1 样本及处理 病羊为某波尔山羊羊场送检的1月龄羔羊。剖检前进行临床观察,静脉采血制备涂片,颈静脉抽取抗凝血以备DNA提取。剖检时依据病变情况,按病理学方法进行取材。
1.2 主要试剂与设备 瑞氏—吉姆萨染液,购自北京雷根生物技术有限公司;rTaq酶、dNTP等PCR试剂和DNA Marker为宝生物工程(大连)有限公司产品。DNA提取试剂盒为上海捷瑞生物有限公司产品。阳性对照DNA模板pMDT-lep-16S质粒,为长江大学动物科学学院实验室构建保存。
PCR仪、凝胶成像分析系统为美国伯乐公司产品;生物显微镜为宁波顺宇公司产品;高速离心机为德国Sigma 1-14。
1.3 PCR引物 根据GenBank发表的钩端螺旋体16S rDNA基因序列[5-6],设计1对特异性引物,具体序列,上游引物 F:5′-CGCGTCTTAAACATGCAAG TCAAGC-3′,下游引物 R:5′-CCGGTGTTACCTTGAC TCT-3′,目的片段长度270 bp,引物由武汉擎科创新生物技术有限公司合成。
1.4 问诊与临床诊断 观察送检病羊临床症状,并详细询问畜主羊场相关情况。
1.5 血液和积液涂片制备与镜检 剖检前取适量耳静脉血,按照常规方法制备血液涂片;剖检时取腹腔积液按照常规方法制备积液涂片,自然干燥,瑞氏—吉姆萨染液进行染色,光学显微镜观察。
1.6 DNA提取与PCR诊断 取颈静脉抗凝血或腹水 2 mL,12 000 r/min,离心 10 min,弃上清液,留沉淀,加入试剂盒中的组织细胞裂解液和蛋白酶K,55℃消化30 min,按照DNA提取试剂盒说明书的具体步骤,进行DNA提取,所得DNA在-20℃保存备用。
PCR体系采用25 μL体系进行,具体组成:10×buffer 2.5 μL,25 mmol/L 的 Mg2+1.5 μL,dNTP(2.5 mmol/L,each)2.0 μL, 上游引物 1 μL, 下游引物 1 μL,DNA 模板 1 μL,rTaq 酶 1.25U, 加灭菌去离子水至 25 μL。
循环条件为:预变性94℃3 min;(94℃30 s,56℃ 30 s,72℃ 40 s)×33个循环;72℃终末延伸10 min,4℃低温10 min。PCR产物用1.2%琼脂糖凝胶进行电泳,凝胶成像系统下观察拍照。
2 结果与分析
2.1 羊场状况及羊群临床症状 羊场存栏成年波尔山羊200只,羔羊约30只,以沿河滩涂地放牧为主,2015年10月持续的秋雨之后,第1次出圈放牧之后第7天,死亡1月龄左右羔羊1只,随后发现部分羔羊精神萎靡,四肢无力,尿黄、腹泻,大羊暂未见异常。
2.2 剖检与染色镜检 送检的病羊采血后处死,剖检发现血液稀薄凝固不良,心包和腹腔有大量淡黄色清亮的积液。膀胱潴留尿液呈深茶色,心肌和肝脏上有少量出血点,胆汁稀薄,淡黄色。
耳静脉血液涂片(图1A、1B)和腹腔积液涂片(图1C、1D),瑞氏—吉姆萨染色,均可见大量螺旋体存在,红细胞严重变形,多呈三角形或多边形,仅见少量的正常圆盘状红细胞。
2.3 PCR结果 以静脉血和腹腔积液中提取的DNA为模板,用钩端螺旋体16S rDNA特异性引物进行PCR扩增,结果从血液和腹腔积液提取的DNA中均扩增出与阳性对照同等大小,约270 bp的条带(见图2)。
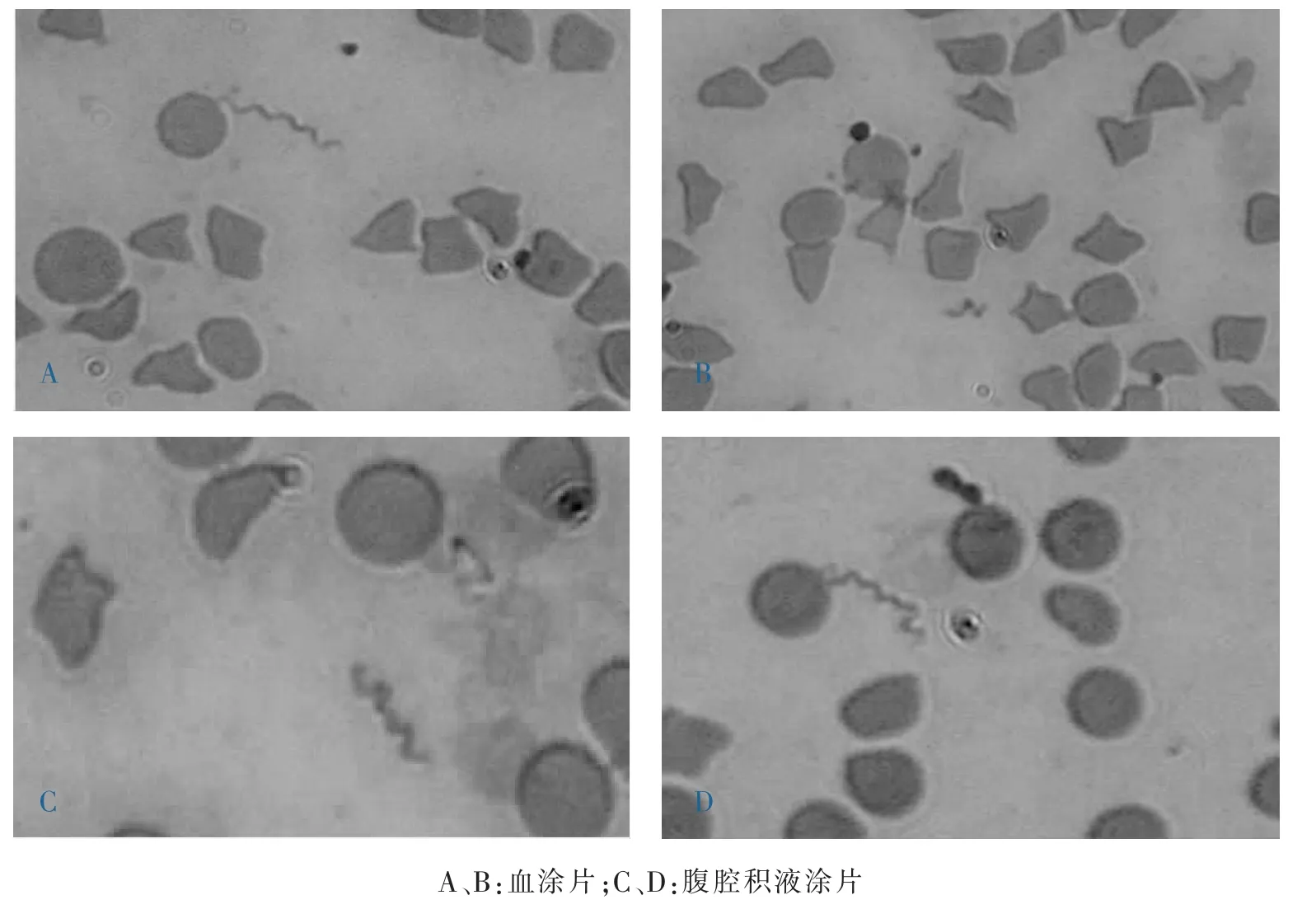
图1 血液和腹腔积液涂片(瑞氏—吉姆萨染色,640×)
3 讨论
钩端螺旋体病是自然疫源性人兽共患传染病,鼠、兔等啮齿类动物是其主要的传染源。该病在我国广泛流行,据报道已有26个省、自治区发现钩端螺旋体病,尤其是湖北、湖南、浙江、福建等省更是高发区[7]。根据统计,我国钩端螺旋钩体病的年平均发病率约为十万分之七,平均死亡率约为1.02%,严重威胁着人民的健康和影响农业生产[8]。该研究通过临床问诊与观察、剖检及实验室涂片镜检和PCR检测,对湖南省某波尔山羊养殖场发病的1月龄波尔山羊进行诊断。检查结果,病羊临床表现消瘦,四肢无力,精神不振。剖检可见心包和腹腔有大量淡黄色透明积液,心肌和肝脏表面可见少量的出血点,胆汁稀薄,淡黄色,肾脏呈土黄色,膀胱积有深茶色尿液。血涂片和腹腔积液涂片均可见大量的螺旋状病原体,用钩端螺旋体16S rDNA特异性引物进行PCR检测,结果呈核酸阳性,确诊为羊钩端螺旋体病。
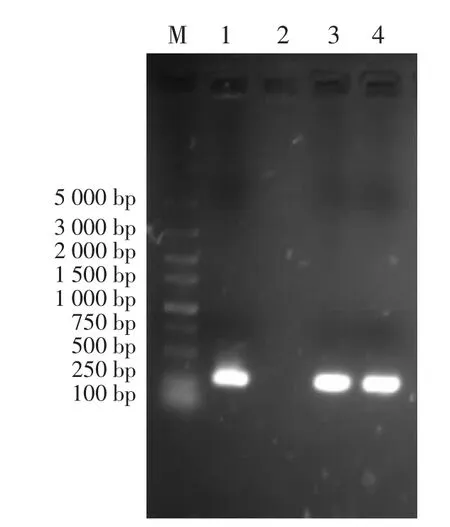
图2 PCR检测结果
钩端螺旋体病的发生常常与环境卫生有着密切的关系,病原往往随啮齿类动物的粪尿排出,污染水源或者畜禽饲料[9-10]。人或动物饮用了被污染的水或者进食了被污染的食物或饲料,便会造成感染。该次羊群发病在10月持续的秋雨之后,分析其原因可能是小羊在放牧时饮用了被钩端螺旋体污染的水,或食用被污染的牧草。10月正是两湖地区的秋收季节,田间果实丰富,老鼠外出活动增加,另外,连续阴雨造成的积水有可能使安家在低洼地方的老鼠不得不向羊群牧地或者羊场、羊舍等高地迁移,因此增加了病原的污染和传播范围,也增加了人畜与病原接触的机会。
[1]贺洁,马永康,杨向东.钩端螺旋体病研究进展[J].医学动物防制,2010,12(26):1110-1113.
[2]时曼华.钩端螺旋体病研究进展与待解决的问题[J].实用预防医学,1999,6(4):241-242.
[3]YE C L,YAN W W,Mc DONOUGH P L,et al.Serodiagnosis of equine leptospirosis by enzyme-linked immunosorbent assay using four recombinant protein markers[J].Clin Vaccine Immunol.2014, 21(4):478-483.
[4]张连英,丁朋晓,杨正久,等.钩端螺旋体外膜蛋白的研究概况[J].中国医药科学,2013,3(9):44-45.
[5]AGAMPODI S B,MATTHIAS M A,MORENO A C, et al.Utility of quantitative polymerase chain reaction in leptospirosis diagnosis:association of level of leptospiremia and clinical manifestations in Sri Lanka [J].Clin Infect Dis,2012, 54(1):1249-1255.
[6]胡群,马思杰,邹春颖,等.鼠类感染钩端螺旋体的PCR检测和基因序列分析 [J].中国病原生物学杂志,2015,10(5):427-434.
[7]刘富强,高立冬,吴子贵,等.湖南省2006年钩端螺旋体宿主动物感染状况调查研究 [J].实用预防医学,2008,15(1):72-74.
[8]田海燕.羊钩端螺旋体病的流行、临床表现与诊断[J].现代畜牧科技,2015(1):60.
[9]王代良.1976—2013年四川省高县钩端螺旋体病流行特征分析[J].预防医学情报杂志,2015,6(31):438-440.
[10]姜明美.羊钩端螺旋体病的流行特点、症状与诊断[J].养殖技术顾问,2014,8(5):98.
S858.262.63
A文章顺序编号1672-5190(2016)03-0100-02
2016-01-29
崔占伟(1986—),男,硕士研究生,主要研究方向为动物疾病防控。
余连喜(1984—),男,兽医师,主要从事畜牧兽医行政管理工作。
(责任编辑:赵景娣)

