饲粮中添加外源酶对湖羊瘤胃发酵培养液产气量、pH值及发酵参数动态变化的影响
陈宇
(宁德出入境检验检疫局,福建 宁德 352100)
饲粮中添加外源酶对湖羊瘤胃发酵培养液产气量、pH值及发酵参数动态变化的影响
陈宇
(宁德出入境检验检疫局,福建 宁德 352100)
旨在研究外源酶对湖羊瘤胃液微生物体外培养的影响,为将外源酶应用于湖羊饲料添加剂提供一定的科学依据。采用瘤胃液体外培养法,将10、20、30、40 mg/kg 4个水平的外源酶加入体外培养体系分别培养6、12、18、24、36、48 h后,测定体外培养液中的产气量(GP)、pH值、氨态氮(NH3-N)浓度、微生物蛋白(MCP)浓度、挥发性脂肪酸(VFA)浓度。结果表明,添加不同水平的外源酶可有效提高瘤胃微生物体外培养液的GP、pH值、NH3-N浓度、MCP浓度及VFA浓度。添加外源酶可改善湖羊瘤胃微生物发酵特性,其中以添加量为10 mg/kg效果最佳。
外源酶;瘤胃微生物;体外培养;湖羊
在畜禽配合饲料中添加适量酶制剂,可以提高畜禽的采食量和饲料利用率,减少氮、磷排放量,降低畜禽养殖对环境造成的污染。在饲料中添加外源酶制剂,可以使包被的淀粉和多糖暴露在消化酶中,从而达到降解多糖的目的[1]。此外,外源酶制剂还可以通过降低内源物质的损失来提高日粮的营养价值[2]。有研究表明,在玉米—豆粕日粮中添加外源复合酶,可以有效提高生长猪的生产性能[3];在生长育肥猪饲料中添加木聚糖酶可以有效提高饲料利用率和猪的生长性能[4-6]。
目前,酶制剂在反刍动物饲料中的应用还不够普及,相关研究也较少。直接添加到反刍动物饲料中的外源酶制剂在瘤胃内会被蛋白酶降解,从而失去活性。但也有研究表明,纤维素酶、半纤维素酶对蛋白酶的水解作用相对稳定,木聚糖酶也可以抵抗多种蛋白酶降解,这主要是由于瘤胃微生物对作用底物有着严格要求。该研究旨在阐明添加外源酶制剂对湖羊瘤胃液微生物体外培养特性的影响,探讨不同培养时间下不同外源酶添加水平对体外培养液产气量(GP)、pH值、氨态氮(NH3-N)浓度、微生物蛋白(MCP)浓度和挥发性脂肪酸(VFA)浓度的影响,为将外源酶开发为湖羊或其他反刍动物的饲料添加剂提供科学依据。
1 材料与方法
1.1 实验动物与饲养管理 健康湖羊公母羊各2只,体重为30~32 kg,每只湖羊都安装永久性瘤胃瘘管,护理15 d后开始试验。实验动物日粮包括粗饲料1 kg和精饲料0.5 kg两部分,粗饲料为新鲜杂交狼尾草,精饲料包括玉米、豆粕、次粉、氯化钠等(见表1)。每日6:30和17:30各饲喂1次,自由饮水。
1.2 培养液的配制 培养液(A):FeCl3·6H2O16.0g,CoCl2·6H2O 2.0 g,MnCl2·4H2O 20 g,CaCl2·2H2O 26.4 g, 用蒸馏水定容至 200 mL。培养液(B):NH4HCO34.0 g,NaHCO335.0 g,用蒸馏水定容至1 000 mL。培养液(C):Na2HPO45.7 g,K2HPO46.2 g,MgSO4·7H2O0.6g,用蒸馏水定容至1000mL。还原剂培养液:NaOH320mL,Na2S·9H2O625mL,加蒸馏水100mL。取800mL蒸馏水+0.2mL培养液A+400mL培养液B+400 mL培养液C+2 mL刃天青溶液+80 mL还原剂培养液,升温至39℃并通入CO2至饱和。

表1 实验湖羊精饲料组成及营养水平
1.3 试验设计 外源酶为纤维素酶和木聚糖酶按照4∶1的比例混合制成,2种酶均购自生工生物工程(上海)股份有限公司。纤维素酶和木聚糖酶酶活按照该公司提供的企业标准方法测定,纤维素酶酶活为22 525 IU,木聚糖酶酶活为24 200 IU。
试验共设5个处理组,每个处理组3个重复,对照组记为A0,处理组分别记为A1、A2、A3、A4。对照组A0的全混合日粮不添加外源酶,处理组A1、A2、A3、A4每千克全混合日粮中分别添加外源酶 10、20、30、40 mg。
1.4 试验方法 在湖羊晨饲前,利用真空负压装置从湖羊永久性瘤胃瘘管采取瘤胃液,4层纱布过滤后灌入经预热的收集瓶中,通入CO2气体,39℃恒温水浴备用。在三角锥形瓶中加入600 mg全混合日粮底物(稻草∶精料=1∶1)和体外培养液30 mL,然后迅速吸取30 mL瘤胃液注入。在(39.0±0.5)℃的摇床中振荡培养。分别在培养0、6、12、18、24、36、48 h时采集三角锥形瓶中的培养液,然后进行相关指标的测定。
1.5 检测指标与方法 培养液气体产量(GP)的测定参照Menke和Raab报道的方法进行。培养液pH值用pHS-3D型酸度计(上海雷磁分析仪器公司)测定。培养液NH3-N浓度的测定参照参考文献[7]报道的方法进行,并做部分改进。培养液MCP浓度的测定参照参考文献[8]报道的嘌呤法进行。培养液VFA浓度的测定参照参考文献[9]报道的方法进行。
1.6 数据处理 试验数据用Microsoft Excel 2013进行初步整理,然后利用SPSS 17.0中的One-way ANOVA进行方差分析,并采用Paired-Sample T Test进行多重比较。试验结果以平均值(Mean)±标准差(S.E.M)形式表示。
2 结果与分析
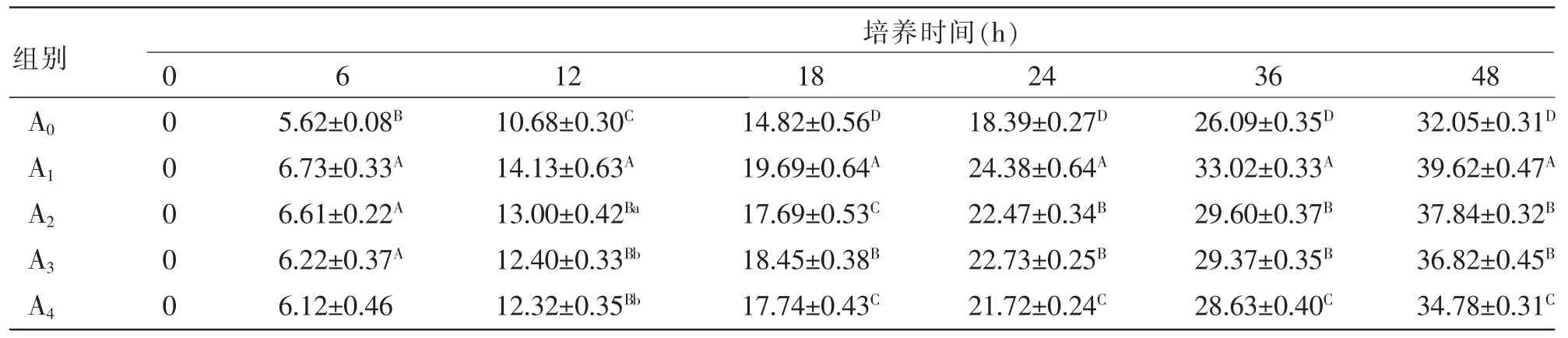
表2 外源酶对湖羊瘤胃微生物体外培养液GP的影响mL

表3 外源酶对湖羊瘤胃微生物体外培养液pH值的影响
2.1 外源酶对湖羊瘤胃微生物体外培养液GP的影响 由表2可知,各组在0~48 h内的产气量均呈上升趋势。产气量的动态变化过程可大致划分为2个阶段,0~24 h为快速上升期,24~48 h为缓慢上升期。其中,在6 h时,处理组A1、A2、A3的产气量均极显著高于对照组 A0(P<0.01)组;在 12~36 h时,处理组A1的产气量极显著高于各处理组及对照组(P<0.01);在24、36、48 h时,处理组A2、A3的产气量极显著高于处理组A4与对照组A0(P<0.01)。
2.2 外源酶对湖羊瘤胃微生物体外培养液pH值的影响 由表3可知,各组在体外培养期间,pH值均呈下降趋势,总体可以分为2个阶段:0~24 h为快速下降阶段,24~48 h为缓慢下降阶段。在培养6 h时,处理组A1、A2的pH值显著高于处理组A3、A4和对照组A0(P<0.05);在培养12 h时,处理组A1的pH值极显著高于其他各处理组和对照组 (P<0.01);在培养18、24 h时,处理组A1、A2的pH值极显著高于对照组A0(P<0.01);在培养18、24、36、48 h时,处理组A1、A2的pH值极显著高于对照组A0(P<0.01)。
2.3 外源酶对湖羊瘤胃微生物体外培养液中NH3-N浓度的影响 由表4可知,各组培养液中NH3-N浓度的变化可分为快速上升和缓慢下降2个阶段,第1阶段为0~12 h,第二阶段为12~48 h。处理组A1的NH3-N浓度在各培养时间点均极显著高于对照组A0(P<0.01),处理组A1的NH3-N浓度在24 h时显著高于处理组A2(P<0.05);在12、24、36 h时,处理组A1的NH3-N浓度极显著高于处理组A3、A4(P<0.01)。结果表明,添加量为10 mg/kg的外源酶对湖羊瘤胃微生物体外培养液中NH3-N浓度的提高作用最明显。
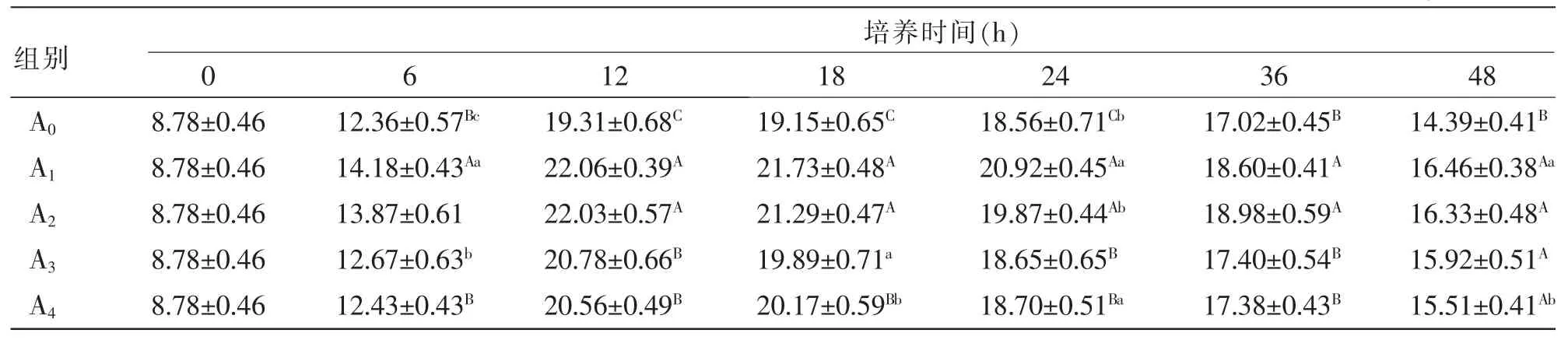
表4 外源酶对湖羊瘤胃微生物体外培养液中NH3-N浓度的影响mg/100 mL
2.4 外源酶对湖羊瘤胃微生物体外培养液中MCP浓度的影响 由表5可知,各处理组体外培养液中MCP浓度的变化趋势相似。在0~12 h和18~24 h 2个时间段内,MCP浓度快速提高。在培养6、12 h时,处理组A1的MCP浓度极显著高于其他各组(P<0.01);在培养12 h时,处理组A2的MCP浓度显著高于处理组A4与对照组A0(P<0.05);在培养24 h时,处理组A1的MCP浓度极显著高于处理组A2与对照组A0(P<0.01),处理组A2的MCP浓度显著高于处理组A4(P<0.05)。

表5 外源酶对湖羊瘤胃微生物体外培养液中MCP浓度的影响mg/100 mL
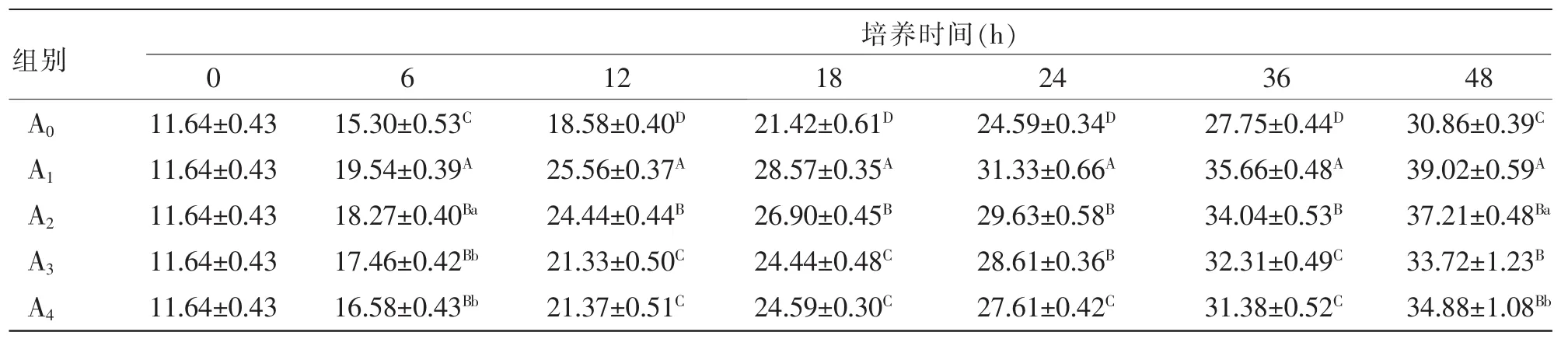
表6 外源酶对湖羊瘤胃微生物体外培养液中乙酸浓度的影响mmol/L
在培养0~12 h时,由于培养底物丰富,瘤胃微生物有充足的底物进行发酵,因此,培养液中的MCP浓度快速上升。除了处理组A1,其他各组MCP产量相似。在培养24~48h,MCP浓度缓慢上升,各组MCP浓度差异变大。结果表明,添加量为10mg/kg的外源酶对湖羊瘤胃微生物体外培养液中MCP浓度的提高作用最明显。
2.5 外源酶对湖羊瘤胃微生物体外培养液中VFA浓度的影响 由表6~9可知,随着微生物体外培养时间的延长,各处理组培养液中的乙酸、丙酸、丁酸和TVFA浓度持续上升。由表6可知,在培养6~48 h时,处理组A1的乙酸浓度极显著高于其他处理组和对照组(P<0.01)。由表7可知,在培养12、18、36 h时,各处理组的丙酸浓度显著或极显著高于对照组(P<0.05或 P<0.01);在培养18~36 h时,处理组A1的丙酸浓度显著或极显著高于其他处理组(P<0.05或P<0.01)。由表8可知,在培养12~48 h时,处理组A1的丁酸浓度显著或极显著高于对照组A0(P<0.05或P<0.01)。由表9可知,在培养6~48 h时,处理组A1的TVFA浓度极显著高于各处理组和对照组(P<0.01);在培养6~36 h时,处理组A2的TVFA浓度极显著高于处理组A3、A4和对照组A0(P<0.01)。由表10可知,在培养6~12 h时,个别处理组的乙酸浓度/丙酸浓度高于或极显著高于对照组(P<0.05或P<0.01);在培养18~48 h时,各处理组培养液中的乙酸浓度/丙酸浓度与对照组相比差异均不显著(P>0.05),表明外源酶不会对瘤胃微生物体外培养液中的VFA成分组成产生显著影响。
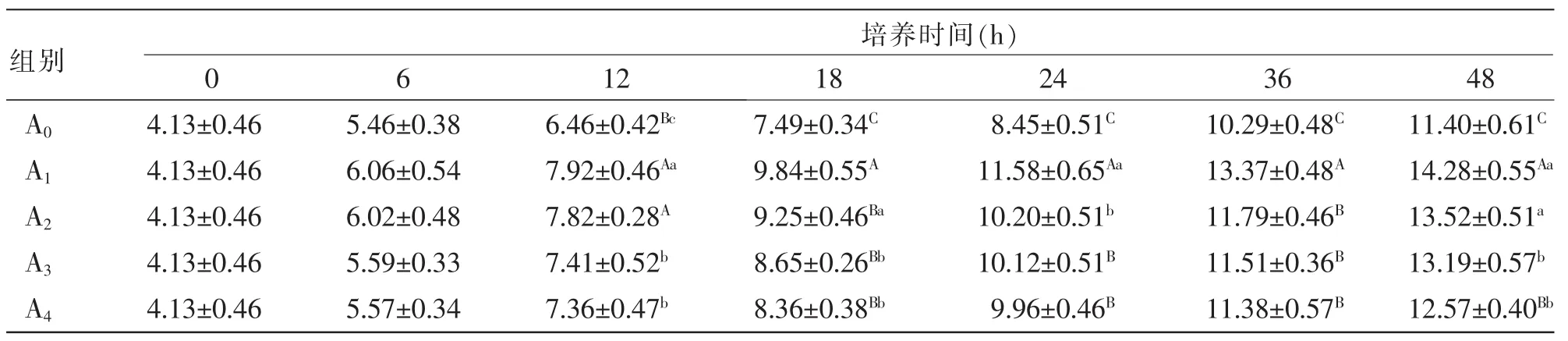
表7 外源酶对湖羊瘤胃微生物体外培养液中丙酸浓度的影响mmol/L
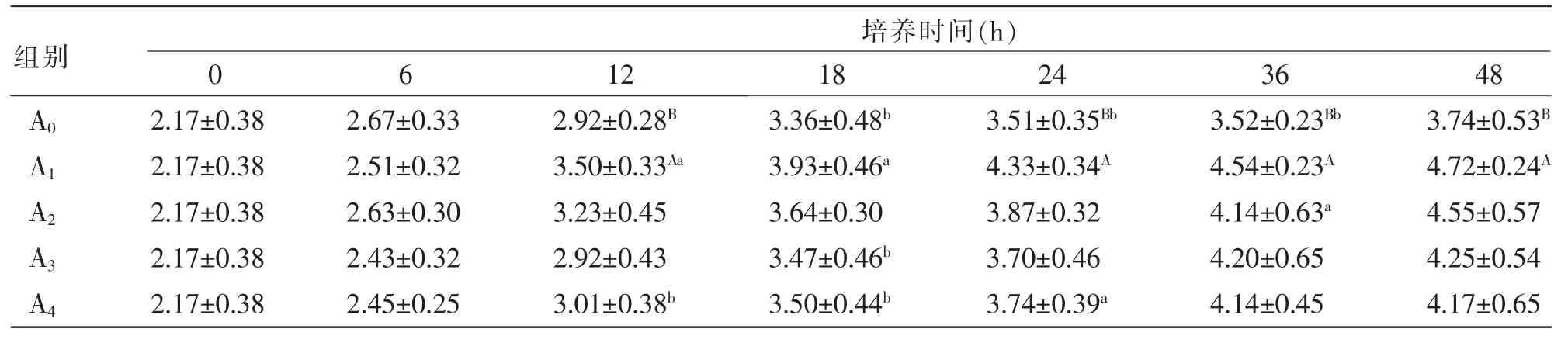
表8 外源酶对湖羊瘤胃微生物体外培养液中丁酸浓度的影响mmol/L

表9 外源酶对湖羊瘤胃微生物体外培养液中TVFA浓度的影响mmol/L

表10 外源酶对湖羊瘤胃微生物体外培养液中乙酸浓度/丙酸浓度的影响mmol/L
3 讨论
3.1 对体外培养液GP的影响 瘤胃微生物体外产气法是利用瘤胃微生物在体外模拟反刍动物瘤胃内环境进行培养的过程,该方法利用恒温水浴锅作为恒温振动环境,通过三通阀来控制厌氧环境。Raab等[10]提出的体外产气法具有操作简单、试验时间短、成本低的优点,可以有效模拟反刍动物瘤胃内微生物生长及繁殖环境,试验结果重现性好[11]。通常情况下,在培养底物中碳水化合物含量较高时,体外培养产气量的高峰一般出现在培养24 h左右;当培养底物中蛋白质含量较高时,产气量的高峰一般出现在培养48 h左右;当培养底物中粗纤维和木质素含量较高时,产气量的高峰一般出现在培养48 h之后。在该研究中,底物选用高蛋白质精料(精粗比为1∶1),培养底物中碳水化合物含量较低,体外培养产气高峰出现在培养48 h左右,试验结果符合理论推断。
微生物培养产生的气体主要包括挥发性脂肪酸、甲烷、CO2等瘤胃微生物利用底物产生的代谢产物。体外培养产气量可以作为了解饲料在瘤胃内降解特性的依据[12-13]。在该研究中,各组在培养0~24 h时,微生物产气量快速上升,这主要是由于微生物在培养液中充分利用底物营养物质进行代谢;在培养24~48 h时,由于底物中没有足够的营养物质可供微生物利用,而且在培养前期微生物代谢产物积累,因此,严重阻碍了微生物的代谢效率。从培养6 h开始,添加外源酶的瘤胃微生物体外培养液的GP显著或极显著高于未添加外源酶的对照组(P<0.05或P<0.01),由此可知,添加外源酶可提高瘤胃微生物的活性及其对底物的利用率,其中,10 mg/kg的添加量对瘤胃微生物体外培养液GP的提高作用最为显著。
3.2 对体外培养液pH值的影响 反刍动物瘤胃液的pH值是反映营养物质代谢水平的重要指标,其稳定性对瘤胃内环境稳定起到关键作用。影响瘤胃液pH值的因素很多,主要包括:日粮类型、饲喂规律、动物唾液分泌量、瘤胃有机酸含量。瘤胃液pH值对微生物生长和繁殖有很大影响,当瘤胃液pH值小于6.4时,微生物对纤维素的降解率下降[14];当瘤胃液pH值小于5.2时,瘤胃液中不耐酸菌的生长和繁殖受到抑制,而酸性环境有利于乳酸菌的生长、繁殖,其代谢过程中产生大量乳酸,最终引起慢性酸中毒[15]。由于瘤胃酸度增加,产甲烷菌、黄色瘤胃球菌、纤维降解菌、琥珀酸丝状杆菌等纤维素降解菌的生长受到抑制,瘤胃内粗纤维不能被降解、利用,从而出现胃积食现象。
在该研究中,各组瘤胃微生物体外培养液的pH值均随着培养时间的延长而逐渐降低,这主要是由于瘤胃微生物利用有机物产生了VFA和CO2等酸性物质。在培养0~24 h时,pH值下降较快,这是由于瘤胃微生物在该段时间内可利用的底物多,生长、繁殖速度较快;在培养 24~48 h时,培养液pH值下降缓慢,这主要是由于培养液中的大量底物已经被微生物利用,剩余底物不能满足其需求,致使微生物生长受到抑制,造成VFA产量降低。瘤胃微生物体外培养pH值正常范围在6.6~6.8。从培养6 h开始,与其他处理组和对照组相比,外源酶10 mg/kg处理组的pH值在各培养时间点均为最高值。这是由于低浓度外源酶具有调控瘤胃发酵、促进底物利用的作用。各组在培养48 h时培养液的pH值最低,由此可知,在该时间点瘤胃液体外发酵程度最大。
3.3 对体外培养液中NH3-N浓度的影响 反刍动物瘤胃中的NH3-N是瘤胃微生物降解饲料中的蛋白质、氨基酸等含氮成分时产生的,也是合成MCP的重要原料。反刍动物瘤胃中NH3-N的浓度维持在一个动态平衡的状态,其浓度变化受到2个因素的影响:一是饲粮中蛋白质含量和种类,主要是可消化蛋白质比例;二是瘤胃微生物合成MCP的速度。瘤胃中主要由厌氧真菌和细菌分泌蛋白酶,利用蛋白质合成NH3-N。研究发现,瘤胃内有7种真菌可以通过合成有氨基肽酶活性的蛋白酶利用蛋白质[16]。有研究表明,瘤胃内去除厌氧真菌后,蛋白酶合成量显著减少,真菌和细菌竞争作用消失,细菌生长、繁殖抑制得到解除,对NH3-N利用速度加快。反刍动物瘤胃液中NH3-N浓度越高,表明饲粮中蛋白质被利用的程度越高,细菌合成MCP的原料就越多,从而可以提高MCP的合成量。
在该研究中,各组体外培养液中的NH3-N浓度在培养0~12 h时呈快速上升趋势,主要是由于瘤胃微生物有充足的碳水化合物可供利用,生长繁殖快速,大量利用蛋白质产生NH3-N;在培养12~48 h时进入缓慢下降阶段,这是由于微生物生成NH3-N的速度小于细菌利用NH3-N合成MCP的速度。从培养6 h开始,与其他处理组及对照组相比,外源酶10 mg/kg处理组的NH3-N浓度始终处于较高水平,这主要是由于低浓度外源酶可提高厌氧真菌的活性。
3.4 对体外培养液中MCP浓度的影响 瘤胃液中的MCP是反刍动物所需蛋白质营养的主要来源,对反刍动物生长影响很大。瘤胃中的细菌利用NH3-N合成MCP,而一些黄色瘤胃球菌和白色瘤胃球菌对NH3-N的利用优于对氨基酸的利用。在该研究中,在培养0~12 h和18~24 h 2个时间段内,各组体外培养液中MCP的合成呈现出快速上升趋势,这主要是由于培养液中NH3-N的浓度较高,细菌有充足的NH3-N可供合成MCP;在培养后期,NH3-N产量减少,抑制细菌合成MCP,MCP合成进入缓慢期。该研究结果表明,添加10 mg/kg的外源酶能够显著提高培养液NH3-N浓度,促进细菌合成MCP,提高蛋白质利用率。然而,40 mg/kg处理组培养液中的MCP浓度在除48 h外的各培养时间点与对照组相比差异均不显著(P>0.05),表明高浓度外源酶抑制了微生物的活性。
3.5 对体外培养液VFA浓度的影响 反刍动物瘤胃液中的VFA是微生物降解碳水化合物的产物,是反刍动物机体主要的碳来源和能量来源,瘤胃液VFA为反刍动物提供60%~80%的能量[17]。在该研究中,在培养0~18 h时,培养液中的VFA浓度快速上升,主要是由于底物中碳水化合物含量较高,引起瘤胃液VFA浓度升高,进而刺激瘤胃上皮组织对VFA的吸收,提高吸收率。由乙酸、丙酸浓度变化情况可知,添加外源酶可以显著提高二者产量,以添加量为10 mg/kg的效果最佳。在培养18~48 h时,各处理组培养液中的乙酸浓度/丙酸浓度与对照组相比差异均不显著(P>0.05),表明外源酶不会改变VFA中各成分组成比例,只是提高VFA总产量,这主要是由于外源酶可以提高瘤胃微生物活性,进而增加其对底物的利用率。
4 结论
在体外培养条件下,添加外源酶可改善湖羊瘤胃微生物发酵特性,提高瘤胃微生物对底物的利用率,其中以添加量为10 mg/kg效果最佳。
[1]BEDFORD M R.The effect of enzymes on digestion[J].J Appl Poultry Res,1996,5(4):370-378.
[2]DÄNICKE S,BÖTTCHER W,JEROCH H,et al. Replacement of soybean oil with tallow in rye-based diets without xylanase increases protein synthesis in small intestine of broilers[J].J Nutr,2000,130(4):827-834.
[3]LINDEMANN M D,GENTRY J L,MONEGUE H J,et al. Determination of the contribution of an enzyme combination (Vegpro)to performance in grower finisher pigs [C]//Proceedings of the Conference of the Australasian Pig Science Association.Canberra:the Australasian Pig Science Association,1997:247.
[4]SCHULZE H,PARTRIDGE G G,CRESWELL D.The effect of feed enzyme supplementation to corn/soya based diets on performance of finisher pigs from 46 to 92 kg[J].J Anim Sci,1996,74(1):197.
[5]SCHULZE H,CAMPBELL R G.Effect of exogenous xylanase on performance of pig fed corn/soya based diets[J].J Anim Sci,1998,76(1):179.
[6]PARTRIDGE G G,ALCANTARA P F,CRESWELL D. Effect of xylanase addition to corn/soybean meal/wheat pollard diets for grower/finisher pigs[C]//Proceedings of the 8thWorld Conference on Animal Production.Seoul:The World Association of Animal Production,1998:626-627.
[7]冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,2010,31(6/7):37.
[8]MAKKAR H P,BECKER K.Purine quantification in digesta from ruminants by spectrophotometric and HPLC methods[J].Br J Nutr,1999,81(2):107-112.
[9]邓思川.化学处理对真姬菇菌糠营养组分及人工瘤胃发酵的影响[D].福州:福建农林大学,2013:4.
[10]RAAB L,CAFANTARIS B,JILG T,et al.Rumen protein degradation and biosynthesis.Ⅰ.A new method for determination of protein degradation in rumen fluid in vitro[J].Br J Nutr,1983,50(3):569-582.
[11]BLÜMMEL M,BULLERDIECK P.The need to complement in vitro gas production measurements with residue determinations from in sacco degradabilities to improve the prediction of voluntary intake of hays[J]. Anim Sci,1997,64(1):71-75.
[12]WILLIAMS B A.Cumulative gas production techniques for forage evaluation[M]//GIVENS D I,OWEN E,OMED H M,et al.Forage Evaluation in Ruminant Nutrition. Oxford City:Oxford University Press,2000:189-213.
[13]BODINE T N,PURVIS H T,ACKERMAN C J,et al. Effects of supplementing prairie hay with corn and soybean meal on intake,digestion,and ruminal measurements by beef steers[J].J Anim Sci,2000,78(12):3144-3147.
[14]BLÜMMEL M,BECKER K. The degradability characteristics of 54 roughages and neutral-detergent fibre as described by gas production and their relationship to voluntary feed intake [J].Br J Nutr,1997,77(5):757-768.
[15]SUNG H G,KOBAYASHI Y,CHANG J,et al.Low ruminal pH reduces dietary fiber digestion via reduced microbial attachment [J].Asian-Aust J Anim Sci,2007,20(2):200-207.
[16]DARREN W B.Effect of the number of step-up diets fed during grain adaptation on acidosis and feeding behaviour of feedlot cattle [D].Saskatoon:University of Saskatchewan,2005.
[17]PENNER G B,BEAUCHEMIN K A,MUTSVANGWA T. Severity of ruminal acidosis in primiparous holstein cows during the periparturient period[J].J Dairy Sci,2007,90(1):365-375.
Effects of Exogenous Enzymes Supplementation to Diet on Gas Production,pH Value and Dynamic of Changes of Fermentation Parameters in Rumen Fermentation of Lake Sheep in vitro
CHEN Yu
(Ningde Entry-exit Inspection and Quarantine Bureau,Ningde 352100,China)
The aims of the present study were to assess the effect of exogenous enzymes supplementation on in vitro cultural characteristic of microbes in rumen fermentation of Lake Sheep and to provide scientific references for the application of exogenous enzymes in animal feedstuff.Four levels of exogenous enzymes,including 10,20,30,40 mg/kg,were supplemented into in vitro rumen fermentation cultural system respectively.The rumen microbes were co-cultured with exogenous enzymes,and the gas production(GP),pH value,NH3-N concentration,MCP concentration and VFA concentration in the cultural fermentation were determined at 6th,12th,18th,24th,36thand 48thh after the start of culture.The results showed that the GP,pH value,NH3-N concentration,MCP concentration and VFA concentration in the rumen microbes fermentation of Lake Sheep in vitro were effectively increased by supplementation of different levels of exogenous enzymes,and the 10 mg/kg of exogenous enzymes exhibited the best performance.
exogenous enzymes;rumen microbes;in vitro culture;Lake Sheep
S816.79;S826.6
A文章顺序编号:1672-5190(2016)09-0039-06
2016-08-10
陈宇(1981—),男,兽医师,硕士,主要从事农产品质量、饲料及饲料添加剂质量控制研究工作。
(责任编辑:赵俊利)

