17α-甲基睾酮对麦穗鱼雌鱼肝脏组织学的影响
刘少贞,赵凌瑞,朱玉婷,曹谨玲,宋 晶
(山西农业大学动物科技学院,山西 太谷 030801)
17α-甲基睾酮对麦穗鱼雌鱼肝脏组织学的影响
刘少贞,赵凌瑞,朱玉婷,曹谨玲,宋 晶
(山西农业大学动物科技学院,山西 太谷 030801)
为评价外源性雄激素17α-甲基睾酮(MT)对水生动物肝脏组织学结构的影响,对麦穗鱼雌鱼进行半静水MT暴露试验,探讨MT对麦穗鱼雌鱼的体重、肝脏重量、肝体指数以及肝脏组织学的影响。结果显示,MT暴露前期和中期,麦穗鱼体重变化不明显,但暴露后期体重显著降低(P<0.05);暴露于不同浓度的MT时,麦穗鱼雌鱼的肝脏重量与对照组相比均呈现不同程度的下降趋势;肝体指数的变化情况与肝脏重量一致,在暴露的中期和后期,麦穗鱼的肝体指数显著低于对照组(P<0.05)。不同浓度的MT暴露后,麦穗鱼肝脏均受到不同程度的损伤,出现肝脏空泡化、肝细胞核固缩等现象,且空泡化和核固缩现象随着MT浓度的升高和暴露时间的延长而加剧。
17α-甲基睾酮;麦穗鱼;肝脏;肝体指数
近年来,环境内分泌干扰物(Endocrine Disrupting Chemicals,EDCs)受到社会各界的极大关注。1995年,美国环境与自然资源委员会将环境内分泌干扰物的研究列为最优先的项目之一[1]。1998年,美国环保局(USEPA)公布了60余种环境内分泌干扰物[2],而欧盟委员会在2000年公布了564种环境中的有毒物质[3]。环境内分泌干扰物,又称为环境激素,主要是指可通过干扰生物体内保持自身平衡和调节发育过程的天然激素的合成、贮存、分泌、体内运输、结合、反应和代谢等过程,从而对生物体的生殖系统、神经系统和免疫系统等的功能产生影响的外源性物质,包括环境雌激素、环境性激素和环境甲状腺激素。研究表明,内分泌干扰物会对动物产生影响[4-6],引起动物繁殖障碍、发育异常、性别转换等[7-10]。人类成年后发生的肥胖、心脏病和生育障碍等也可能是在胚胎时期受内分泌干扰物的影响所致[11]。低浓度的外源性雌激素EE2(25 ng/L)暴露28 d后会使稀有鮈鲫的体长显著降低并使其体重显著下降[12]。 100 mg/(kg·BW)的 4-硝基酚(PNP)会造成大鼠肝脏组织病理损伤,影响肝脏正常生理功能[13]。双酚A(BPA)达到一定浓度时会改变大鼠靶器官的生长、发育和生理功能,进而影响机体免疫功能[14]。 氯化镉(CdCl2)暴露会影响斑马鱼肝型脂肪酸结合蛋白相关基因lfabp的表达,抑制肝细胞的成熟[15]。2,3,7,8-四氯代二苯并二噁英(TCDD)和 3,3′,4,4′-四氯联苯(PCB77)对斑马鱼进行水域染毒5 d后便可引起斑马鱼肝脏丙二醛 (MDA)含量增加,同时使超氧化物歧化酶(SOD)和谷胱甘肽-S-转移酶(GST)活力降低[16]。环境雌激素双酚A对斑马鱼的肝脏也会产生有害作用[17]。大量研究表明,环境内分泌干扰物对生物体的影响很大。前人的研究多集中在环境激素对性腺的影响,而肝脏作为重要的解毒器官,环境激素对其组织结构和功能的影响也不容忽视[18]。
17α-甲基睾酮(MT)是一种人工合成的雄激素类药物[19-20],作为激素的替代物在养殖业和医药行业中被普遍应用。不同浓度的MT对鱼类有不同的生物学作用[21],低浓度的MT可作为饲料添加剂促进鱼类的生长发育,而高浓度的MT则会抑制鱼类的生长发育,甚至导致鱼类畸形和死亡[22]。MT属于雄激素,在生产单一雄鱼方面发挥重要作用[23-25]。随着MT在水产养殖业中的广泛应用,各地水体中的MT浓度越来越高,对水生生物的健康造成了危害,对人类的健康也造成了威胁。
麦穗鱼(Pseudorasbora parva)属鲤形目(Cypriniformes)鲤科(Cyprinidae)鮈亚科(Gobioninae)[26],是一种小型鱼类,廉价易得,对环境适应能力强,容易在实验室饲养、繁殖[27-29]。 近年来,不少环境毒理学实验都以麦穗鱼作为实验材料[30]。笔者以麦穗鱼雌鱼为研究对象,探讨半静水MT暴露对其体重、肝脏重量、肝体指数以及肝脏组织学的影响,为从基因和蛋白水平揭示MT对水生生物肝脏功能的影响机制提供理论基础,同时也为麦穗鱼作为指示生物在环境激素动态监测方面的应用提供可靠依据。
1 材料与方法
1.1 实验动物麦穗鱼,采自山西农业大学思想湖,在实验室饲养驯化1个月后,挑选体形匀称、体表无机械损伤、健康有活力的个体作为试验材料。该研究所用的麦穗鱼体重为(0.96±0.21)g。
1.2 药品与主要仪器17α-甲基睾酮,购自Sigma公司;无水乙醇、苦味酸、冰醋酸、二甲苯等试剂,购自天津市化学工业有限公司;苏木精、伊红,购自南昌雨露实验器材有限公司;石蜡切片机(Leica RM 2245),显微镜成像系统(RCH1-NK50i)。
1.3 试验设计共设3个MT处理组,浓度分别为25、50、100 ng/L,以及 1 个溶剂对照组[0.001%(v/v)无水乙醇水溶液]。各试验组和对照组均设置2个重复,每个重复45尾麦穗鱼,共360尾。采用半静水暴露方法对麦穗鱼进行MT暴露试验[19]。水温恒定在(22±2)℃,每天定时定量投饵,观察实验鱼的健康状况,及时捞出死鱼并做好记录。
1.4 取样及生物学指标测定经过7、14、21 d的MT暴露后,分别捞取处理组和对照组的麦穗鱼进行解剖取样。每次每缸随机捞取15尾鱼,用吸水纸吸干其体表水分,然后用分析天平称量鱼的体重并记录,然后迅速解剖,摘取其肝脏并称重,用于计算肝体指数。随后将其置于波恩氏液中固定,备用。肝体指数计算公式如下:
肝体指数(%)=肝脏重量(g)/体重(g)×100%
1.5 石蜡切片的制作麦穗鱼的肝脏经过波恩氏液固定48 h,用自来水冲洗12~24 h,以梯度浓度的乙醇脱水,用二甲苯透明;组织浸蜡(熔点为54~56℃的软蜡和熔点为56~58℃的硬蜡),硬蜡包埋,包埋后过夜,切片,制成6 μm厚的连续蜡带;用苏木精—伊红(H E)染色,中性树胶封片,光学显微镜下观察麦穗鱼肝脏组织切片并拍照。
1.6 数据处理试验结果以平均值±标准差(mean±SD)表示。采用SPSS 19.0统计软件中的单因素方差分析法(One-Way ANOVA)进行显著性检验。P<0.05表示差异显著。
2 结果与分析
2.1 生物学指标变化由表1可知,麦穗鱼雌鱼在不同浓度的MT中暴露7 d和14 d时,其体重未发生显著变化;当暴露于50 ng/L和100 ng/L的MT中21 d时,其体重显著低于对照组(P<0.05);暴露于不同浓度的MT 7、14、21 d时,麦穗鱼雌鱼的肝脏重量与对照组相比均显现不同程度的下降,其中,100 ng/L的MT暴露7 d时,麦穗鱼雌鱼的肝脏重量显著低于对照组(P<0.05);肝体指数的变化情况与肝脏重量一致,当暴露于50 ng/L和100 ng/L的MT 7 d和14 d时,麦穗鱼雌鱼的肝体指数显著低于对照组(P<0.05);当暴露于50 ng/L的MT 21 d时,麦穗鱼雌鱼的肝体指数显著低于对照组 (P<0.05)。
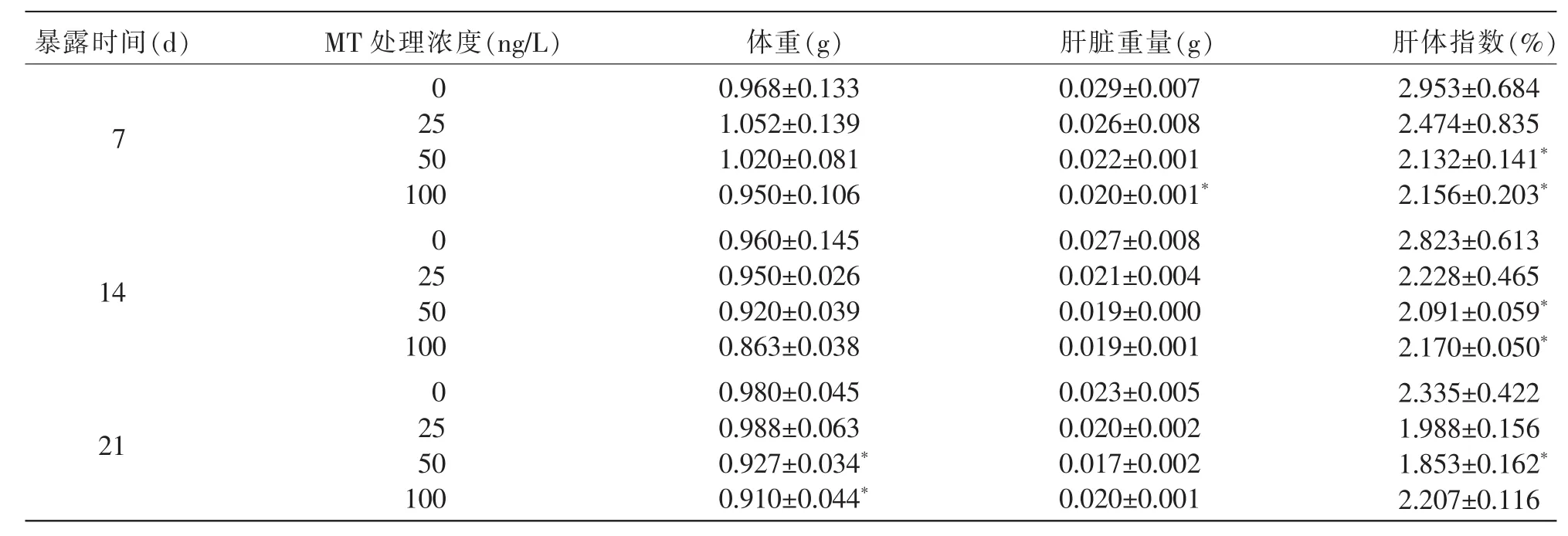
表1 MT不同暴露时间麦穗鱼的相关生物学指标测定结果

图1 不同浓度MT暴露7、14、21 d后麦穗鱼雌鱼的肝脏组织学观察
2.2 肝脏组织学变化对照组麦穗鱼的肝脏形态正常,肝细胞完整,细胞呈椭圆形或多边形,肝细胞索清晰可见,细胞界限明显,肝细胞结构清晰,细胞核大而清晰可见,位于细胞中央,肝细胞排列紧密(图 1 A1、B1、C1)。25 ng/L MT 处理组麦穗鱼的肝脏受到外源性雄激素MT的影响,肝脏组织结构产生变化:MT暴露7 d时,肝细胞依然围绕中央静脉紧密排列,但放射状不明显,部分肝细胞的椭圆外形出现变形,细胞核变小(图1 A2);延长MT暴露时间至14 d,肝细胞形状变形明显,细胞膜少量溶解,细胞界限不明显,同时,细胞排列松散(图1 B2);MT暴露21 d时,肝细胞变形严重,排列松散而紊乱,细胞膜溶解增多,细胞界限模糊,细胞结构不清晰,甚至有的肝细胞核溶解消失,有的出现核固缩(PN)现象(图 1 C2)。50 ng/L MT 处理组的麦穗鱼肝脏组织结构损伤较明显:MT处理7 d时,肝细胞排列松散,部分细胞膜溶解,细胞界限模糊,少量肝细胞核变小(图1 A3);MT暴露14 d时,肝细胞膜溶解加剧,肝细胞结构模糊,细胞质溶解,细胞形状扭曲,细胞核变小,有些肝细胞核已经溶解(图1 B3);MT暴露21 d后,肝细胞排列紊乱,细胞变形严重,细胞界限模糊,细胞核溶解的细胞增多(图1 C3)。100 ng/L MT处理组的麦穗鱼肝脏组织结构损伤严重:MT暴露7 d后,肝细胞界限模糊,细胞松散,排列紊乱,细胞间隙增大,出现裂缝,细胞变形,部分细胞核溶解(图1 A4);MT处理14 d时,肝细胞扭曲变形,排列松散而紊乱,细胞核溶解加剧,出现空泡(图1 B4);MT处理21 d时,肝组织细胞严重损伤,肝细胞排列紊乱,细胞间隙增大,裂缝增多,细胞严重变形,界限模糊,细胞核溶解严重,空泡增多(图 1 C4)。
3 讨论
该研究的实验对象为成熟的雌性麦穗鱼,其在浓度为 25、50、100 ng/L 的 MT 暴露 7、14、21 d 后,肝脏形态受到严重影响,并且随着MT浓度的增大,抑制作用增强,且MT暴露的时间越长,抑制作用也越明显。与对照组相比,高浓度MT暴露21 d后麦穗鱼的体重显著降低,而MT短期暴露并没有对其体重产生显著抑制作用。在不同浓度的MT暴露一段时间后,麦穗鱼的肝脏重量呈现出降低的趋势,且肝体指数的变化也表现出相似的趋势,表明外源性雄激素MT对麦穗鱼的肝脏有一定的损伤作用。
肝脏是鱼类最主要的解毒器官,当鱼类受到外界毒物浸染时,肝脏成为最主要的靶器官。许多研究表明,当受到外界毒物浸染时,鱼类的肝细胞会发生不同程度的组织形态学变化。当鱼类的肝脏受到损伤时,肝细胞会发生水肿、脂肪沉淀、肝血窦扩张充血、空泡化、细胞核固缩偏移等现象[31],肝脏损伤严重时,肝细胞甚至会溶解消失、坏死,形成局部病灶[32]。 苯并(a)芘侵染黑鲷后,可造成其肝脏损伤,具体表现为肝细胞水样变性,肝窦状隙扩张,细胞核固缩偏向核膜,部分细胞质溶解,细胞界限模糊[33]。该研究中,麦穗鱼经过MT暴露,肝脏也出现了肝细胞变形、细胞排列紊乱、界限模糊、细胞空泡化、细胞核固缩偏移现象,甚至还出现了细胞核溶解消失,这与前人的研究结果一致。该研究发现,麦穗鱼肝脏损伤程度随MT浓度的增加而逐渐严重,同时,随着暴露时间的延长,损伤也逐渐加重,这也与苯并(a)芘暴露黑鲷肝脏试验结果一致,只是苯并(a)芘暴露下的黑鲷肝脏出现了一段时间的稳定期[33]。外源性雌激素双酚A对斑马鱼的肝脏也有毒害作用,并且随着双酚A浓度的增加,斑马鱼肝脏细胞肿大情况不断加剧,出现核萎缩和空泡化现象[14]。 综上所述,17α-甲基睾酮对麦穗鱼雌鱼肝脏有一定的损伤作用,并且随着暴露浓度的增大和暴露时间的延长,损伤不断加重。此外,该研究结果表明,MT暴露下的麦穗鱼肝脏组织学变化比较明显,且麦穗鱼分布广泛、廉价易得,因此,麦穗鱼具有作为监测环境MT的敏感生物标志物的应用潜力。
[1]CHRISTIANSEN L B,PEDERSEN K L,KORSGAARD B,et al.Estrogenicity of xenobiotics in rainbow trout(Oncorhynchus mykiss)using in vivo synthesis of vitellogenin as a biomarker [J].Marine Environmental Research,1998,46(1/5):137-140.
[2]Japan EnvironmentAgency.Strategic Programson Environmental Endocrine Disruptors (SPEED ′98)[R].Tokyo:Ministry of Environment,1998.
[3]European Commission DG ENV. Towards The Establishment of a Priority List of Substances for Further Evaluation ofTheirRole in Endocrine Disruption Preparation of a Candidate List of Substances as a Basis for Priority Setting. Final Report(Incorporating Corrigenda to Final Report Dated 21 June 2000) [R].Delft: Netherlands BKH Consulting Engineers,2000.
[4]张信连,杨维东,刘洁生.环境内分泌干扰物对生物和人体健康的影响[J].国外医学:临床生物化学与检验学分册,2005,26(6):349-351.
[5]王有基,胡梦红.环境内分泌干扰物对鱼类影响的研究进展[J].渔业现代化,2006(3):41-44.
[6]解美娜,张才乔,曾卫东,等.环境内分泌干扰物对动物繁殖机能的干扰作用及其机制[J].中国兽医学报,2004,24(1):101-103.
[7]NURULNADIA M Y,KOYAMA J,UNO S,etal.Bioaccumulation of dietary endocrine disrupting chemicals (EDCs)by the polychaete,Perinereis nuntia[J].Bull Environ Contam Toxicol,2013,91 (4):372-376.
[8]Van Den BERG M,SANDERSON T,KURIHARA N,et al.Role of metabolism in the endocrine-disrupting effects of chemicals in aquatic and terrestrial systems[J].Pure Appl Chem,2003,75(11/12):1917-1932.
[9]DIEHL J,JOHNSON S E,XIA K,et al.The distribution of 4-nonylphenol in marine organisms of North American Pacific Coast estuaries [J].Chemosphere,2012,87(5):490-497.
[10]LAI K M,JOHNSON K L,SCRIMSHAW M D,et al.Binding of waterborne steroid estrogens to solid phases in river and estuarine systems [J].Environ Sci Technol,2000,34(18):3890-3894.
[11]刘菲,蒲力力.环境内分泌干扰物对男性生殖健康影响的研究进展[J].生殖医学杂志,2006,15(6):425-428.
[12]ZHA J,WANG Z,WANG N,etal.Histological alternation and vitellogenin induction in adult rare minnow(Gobiocypris rarus)after exposure to ethynylestradioland nonylphenol [J].Chemosphere,2007,66(3):488-495.
[13]宋美艳,张永辉,朴元国,等.4-硝基酚对大鼠肝脏的毒性及氧化损伤[J].生态毒理学报,2014,9(3):495-502.
[14]苗颂,寇增强,高志贤.双酚A暴露对大鼠器官结构及细胞因子表达的影响[J].卫生研究,2009,38(1):11-14.
[15]端正花,陈晓欧,刘灵丽,等.苯并三唑和镉对斑马鱼肝脏的联合毒性效应 [J].中国环境科学,2015,35(6):1872-1876.
[16]聂芳红,孔庆波,刘连平,等.两种二噁英类化合物对斑马鱼肝脏 MDA,SOD和 GST的影响[J].食品与生物技术学报,2009,28(2):210-213.
[17]曹娜,魏华,吴陵广,等.双酚A对斑马鱼肝脏和性腺的作用[J].生态学杂志,2010,29(11):2192-2198.
[18]EIDE M,KARLSEN O A,KRYVI H,et al.Precision-cut liver slices of Atlantic cod (Gadus morhua):an in vitro system forstudying the effects ofenvironmental contaminants [J].Aquatic Toxicology,2014,153:110-115.
[19]LIU S,WANG L,QIN F,et al.Gonadal development and transcript profiling of steroidogenic enzymes in response to 17α -methyltestosterone in the rare minnow Gobiocypris rarus [J].J Steroid Biochem,2014,143:223-232.
[20]TILLMANN M,SCHULTE-OEHLMANN U,DUFT M,et al.Effects of endocrine disruptors on prosobranch snails(Mollusca:Gastropoda) in the laboratory.Part Ⅲ :cyproterone acetate and vinclozolin as antiandrogens[J].Ecotoxicology,2001,10(6):373-388.
[21]ANGUS R A,BLANCHARD P.A short-term in vivo screening system for endocrine disrupters using mosquitofish [M].Ohio:US Environmental Protection Agency,1997.
[22]RINCHARD J,DOBROWSKI K,GARIA-ABIADO M A,et al.Uptake and depletion of plasma 17α -methyltestosterone during induction of masculinization in muskellunge,Esox masquinongy:effect on plasma steroids and sex reversal[J].Steroids,1999,64(8):518-525.
[23]KITANO T,TAKAMUNE K,NAGAHAMA Y,et al.Aromatase inhibitor and 17α-methyltestosterone cause sex-reversal from genetical females to phenotypic males and suppression of P450 aromatase gene expression in Japanese flounder (Paralichthys olivaceus) [J].Mol Reprod Dev,2000,56(1):1-5.
[24]ONG SK,CHOTISUKARN P,LIMPIYAKORN T.Sorption of 17α-methyltestosterone onto soils and sediment [J].Water,Air,&Soil Pollut,2012,223 (7):3869-3875.
[25]RIVERO-WENDT C L,MIRANDA-VILELA A L,FERREIRA M F,et al.Cytogenetic toxicity and gonadal effects of 17α -methyltestosterone in Astyanax bimaculatus (Characidae)and Oreochromis niloticus(Cichlidae)[J].Genet Mol Res,2013,12 (3):3862-3870.
[26]肖智,蓝宗辉,陈湘粦.中国麦穗鱼属一新种(鲤形目,鲤科)[J].动物分类学报,2007,32(4):977-980.
[27]王晓南,刘征涛,闫振广,等.麦穗鱼物种敏感性评价[J].环境科学,2013,34(6):2329-2334.
[28]秦玉丽,李林春,黄荣静.麦穗鱼的生物学特性及养殖技术[J].江苏农业科学,2005(3):114-116.
[29]雷小青,严保华,姚毅,等.麦穗鱼生物学特性及繁殖技术研究[J].江西水产科技,2013(2):16-18.
[30]陈涛,张玉兰.麦穗鱼的生物学和毒理学研究进展[J].水产科学,2013,32(11):685-690.
[31]RHIND S M,KYLE C E,KERR C,et al.Effect of duration of exposure to sewage sludge-treated pastures on liver tissue accumulation of persistent endocrine disrupting compounds (EDCs)in sheep [J].Sci Total Environment,2011,409(19):3850-3856.
[32]STRMAC M,BRAUNBECK T.Effects of triphenyltin acetate on survival,hatching success,and liver ultrastructure of early life stage of zebrafish(Danio rerio)[J].Ecotoxicol Environ Saf,1999,44(1):25-39.
[33]翁朝红,王新红,王淑红,等.苯并(a)芘暴露引起黑鲷肝、脾、肠组织病理变化[J].集美大学学报,2008,13(4):309-314.
《畜牧与饲料科学》入选《中国学术期刊影响因子年报》统计源期刊
2015年10月,中国学术期刊(光盘版)电子杂志社有限公司、中国科学技术文献评价研究中心联合发布了《中国学术期刊影响因子年报(自然科学与工程技术·2015版)》。《畜牧与饲料科学》入选统计源期刊,并获颁《中国学术期刊影响因子年报统计刊源证书》。《中国学术期刊影响因子年报》依据科技期刊在同学科、同研究层次的总被引频次、影响因子、下载频次等多项指标,每年按照“优入劣汰”的原则对其收录的科技期刊进行综合筛选、评定。该年报的学术影响力已被众多学术单位和科研院所广泛认可,是我国重要的科技期刊学术水平评价体系之一。
Effect of 17α-Methyltestosterone Exposure on Liver Histology of Female Pesudorasbora parva
LIU Shao-zhen,ZHAO Ling-rui,ZHU Yu-ting,CAO Jin-ling,SONG Jing
(College of Animal Science and Technology,Shanxi Agricultural University,Taigu 030801,China)
In order to understand the effect of exogenous androgen 17α-methyltestosterone(MT)on liver histological structure of aquatic animals,the semi-static water test was conducted using female Pesudorasbora parva as material to evaluate the effect of MT exposure on their body weight,liver weight,hepatosomatic index (HSI)and liver histology.The results showed that in early and middle phase of MT exposure,no significant changes in body weight of female Pesudorasbora parva were observed,however,in the late phase of MT exposure,their body weight were significantly reduced(P<0.05).The liver weight of female Pesudorasbora parva which were subjected to exposure of different dosage MT were reduced in different degrees compared with that of CK.The change of HSI exhibited the similar trend with liver weight.In the middle and late phase of MT exposure,the HSI of female Pesudorasbora parva were significantly lower than that of CK (P<0.05).The histological injuries of liver after MT exposure were observed,including vacuolization and karyopyknosis of hepatocyte,and the injuries were gradually aggravated with the increase of MT dosage and extend of duration of MT exposure.
17α-methyltestosterone;Pesudorasbora parva;liver;hepatosomatic index
R994.6
A文章顺序编号:1672-5190(2016)01-0001-05
2015-12-29
项目来源:山西农业大学引进人才博士科研启动费项目(2014YJ08)。
刘少贞(1983—),女,讲师,博士,主要研究方向为环境毒理学。
宋晶(1983—),男,讲师,博士,主要研究方向为水生生物学。
(责任编辑:赵俊利)

