BABA, BTH对番茄白粉病的抗性研究
李会佳,朱露露,李 帅,杨欢欢,张冬野,汪 强,吴明臣,李景富
(东北农业大学 园艺学院 ,黑龙江 哈尔滨 150030)
BABA, BTH对番茄白粉病的抗性研究
李会佳,朱露露,李帅,杨欢欢,张冬野,汪强,吴明臣,李景富*
(东北农业大学 园艺学院 ,黑龙江 哈尔滨 150030)
分别以500 mg·L-1BABA和50 mg·L-1BTH两种诱导剂处理番茄幼苗,后期进行白粉病菌的接种,接种时间分别为诱导剂处理后1,2,3,5,8和15 d。通过病情指数、相对防效、H2O2和NO含量以及抗白粉病相关基因表达水平的测定,比较分析两种诱导剂的作用时间、最优处理模式以及抗病的相关机制。结果表明:BABA处理后防治效果最佳的间隔时间为第2天,且有效持续时间为10 d左右,BTH处理后1,3和5 d均为最佳期间且有效持续时间可达15 d,相对BABA持续期较长;BABA和BTH诱导后H2O2和NO含量均有显著增加;两种诱导剂处理后抗白粉病相关基因CHI3,GLUCA,GLUCB和PR1A表达趋势相近,但不同抗病相关基因在不同处理时间以及不同材料中均存在差异;喷施BABA和BTH后均有助于番茄抵抗白粉病菌的侵染,提高番茄的抗病能力。
BABA;BTH;信使分子;基因表达;番茄;番茄白粉病
番茄白粉病(tomato powdery mildew)是由白粉菌(powdery mildew fungus)引起的传播性真菌性病害,发病较常见,对番茄生产造成一定的危害[1]。植物诱导抗病性(induced resistance,IR)又称植物诱导系统抗病性(induction of systemic resistance,ISR),是指由生物或非生物因子激活的,依赖于寄主植物的物理或化学屏障的活化抗性过程[2]。β-氨基丁酸(DL-β-amino-n-butyric acid,BABA)是分泌于番茄根部的一种非蛋白类氨基酸,BABA可诱导马铃薯、番茄、葡萄等获得系统抗性(systemic acquired resistance,SAR)[3]。苯并噻二唑(benzothiadiazole,BTH)与水杨酸结构相似,目前用于植物抗病诱导。BTH可诱导烟草、黄瓜、小麦和向日葵等多种作物产生SAR[4-5]。葛秀春等[6]用BTH处理诱导水稻后,显著减轻了水稻幼苗稻瘟病的病情,用BTH浸种可诱发水稻3—4叶期对猪瘟病的抗性。利用诱导剂诱导植物产生抗病性是一种省时高效环保的做法,具有系统性、广谱性、持续性、滞后性和安全性的特点。因此,使用诱导剂来提高植物对病害的抗病性,逐渐得到广泛的使用,有一定研究和应用价值。
1 材料与方法
1.1试验材料
供试材料为:09888(易感白粉病)和09111(抗病)。实验用番茄白粉病病原菌从东北农业大学园艺站采集分离得到。
1.2试验方法
β-氨基丁酸(BABA),苯并噻二唑(BTH)分别用双蒸水配制,BABA的浓度为500 mg·L-1,BTH的浓度为50 mg·L-1[7];待番茄幼苗长至6叶期进行喷雾处理,以叶面凝聚水珠而不滴落为宜。喷施清水作为对照。20株番茄为一个处理,设3次重复。在第1,2,3,5,8,15天后全株接种白粉菌,孢子悬浮液为5×104mL-1。番茄白粉病的分级标准采用陈林年等[8]的6级分级标准。
1.3项目测定
1.3.1病情指数、相对防效及数据处理
病情指数=100×∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)
相对防效/%=[(对照病指-处理病指)/对照病指]×100
试验数据采用SAS软件进行方差分析。
1.3.2信使分子的测定
H2O2含量的测定采用Sergiev等[9]的方法;NO含量的测定参照Misko等[10]的方法。
1.3.3抗病相关基因的qRT-PCR分析
于喷施诱导剂后2,12和24 h剪取幼苗真叶,每次均选取相同部位叶片后立即放入冰盒,于-80 ℃冰箱中保存待用,进行抗病相关基因的检测。采用Trizol法对番茄幼嫩叶片的RNA进行提取。利用北京全式金生物技术有限公司的TransScript ®First-Strand cDNA Synthesis SuperMix,进行cDNA第一链的合成。以Actin为内参基因,根据序列分析结果,目的基因和内参基因利用Primer 5.0进行引物设计。所用引物见表1,由华大基因合成。
表1qRT-PCR引物
Table 1Primers used for qRT-PCR analysis

引物序列(5’→3’)登录号Actin-f5'-ATGGTGGGTATGGGT-CAAAAAG-3'U60480Actin-r5'-GAGGGGCTTCAGTTAGGAG-GA-3'CHI3-f5'-TGCAGGAACATTCACTGGAG-3'Z15141CHI3-r5'-TAACGTTGTGGCATGATGGT-3'GLUCA-f5'-GGTCTCAACCGCGACATATT-3'M80604GLUCA-r5'-CACAAGGGCATCGAAAAGAT-3'GLUCB-f5'-TCTTGCCCCATTTCAAGTTC-3'M80608GLUCB-r5'-TGCACGTGTATCCCTCAAAA-3'PR1A-f5'-CCAAGACTATCTTGCGGTTC-3'AJ011520PR1A-r5'-GAACCTAAGCCACGATACCA-3'
qRT-PCR分析,采用北京全式金生物技术有限公司的TransStart® Top Green qPCR SuperMix试剂盒进行,所用荧光染料为SYBR Green Ⅰ,每个样品设重复4次,每个反应结束后,做熔解曲线的分析。反应条件为:95 ℃变性3 min,94 ℃变性30 s,55 ℃退火30 s, 72 ℃延伸30 s,循环数35个。
每组PCR重复3次取平均值,对所用引物进行熔解曲线分析后,Actin,CHI3,GLUCA,GLUCB和PR1A,5个基因的熔解曲线均呈现出单一峰,满足qRT-PCR试验要求。数据采用2T-△△C法进行分析。
2 结果与分析
2.1最佳诱导间隔期与持效期
于番茄幼苗六叶期喷500 mg·L-1BABA和50 mg·L-1BTH,处理后的1,2,3,5,8,15 d整株接种白粉菌,并进行病情调查,计算相对防效,结果见图1-A。从图1-A可见:BABA处间隔1 d后接种的相对防效为58%。第2天接种白粉菌的防治效果最佳,相对防效达70%。第3天后由于间隔时间变长,相对防效降低,到第15天时,相对防效仅为12%,说明BABA诱导番茄抗白粉病的有效持续时间为10 d左右。
从图1-B可见:BTH处理后间隔1 d后接种的防治效果低于BABA同期水平,相对防效为43%,第3天后接种的相对防效达69%,且第5天后接种的相对防效仍为64%,说明3~5 d为最佳时期。至第8天,防治效果逐渐降低,在第15天,相对防效为20%,说明BTH诱导番茄抗白粉病的有效持续时间可达15 d,相对BABA持续期较长。BTH相对于BABA来说,以最佳间隔时间长、持续周期长的特点,更便于生产应用。
2.2信号分子的变化
2.2.1H2O2含量的变化
由图2-A可见,BABA接种组的H2O2含量于第7天达到最高0.38 mmol·g-1,比对照未接种组高出216.67%,对照接种组达到0.24 mmol·g-1,显著低于BABA接种组处理。而BABA接种组与对照接种组的H2O2在第8天均有所降低,这可能与前期H2O2的积累量不高,在抑制病原菌侵染的抗病过程中有所消耗所致。在诱导处理后11~13 d,H2O2的逐渐回归原始对照水平,这说明H2O2作为系统抗病过程中的信号物质,因早期激发抗病反应,而被相应的酶转化为对植物无害的H2O和O2。由图2-B结果显示,BTH接种组的H2O2含量于第7天达到峰值,为0.37 mmol·g-1,比对照未接种高出208.33%,对照接种组达到0.24 mmol·g-1,明显低于BTH接种组处理。而BTH接种组与对照接种组的H2O2含量在第9天开始降低,这可能与前期H2O2含量的积累量不高,在抑制病原菌侵染的抗病过程中有所消耗导致。
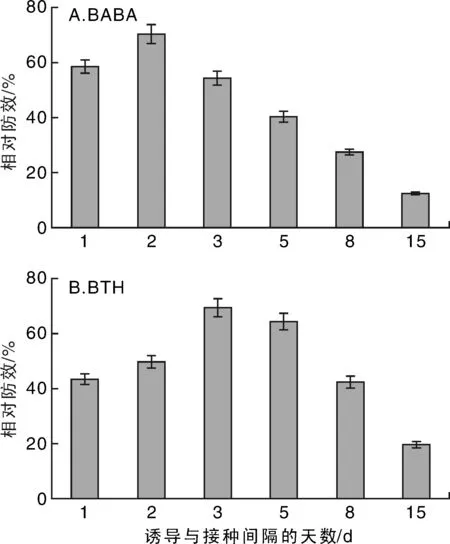
图1 不同接种间隔期对BABA和BTH诱导番茄白粉病的影响Fig.1 Relative control effect of BABA and BTH on tomato powdery mildew at different inoculation intervals
2.2.2NO含量的变化
图3-A可知,BABA接种组的NO含量于第7天达到峰值,为42 μmol·g-1,比对照未接种组高出388.37%,对照接种组达到21 μmol·g-1,明显低于BABA接种组。而BABA接种组与对照接种组的NO在第8天开始降低,接种组整体NO水平高于对照组水平。由图3-B结果可以看出,BTH诱导的接种组的NO含量于第7天达到最高,为44 μmol·g-1,比对照未接种组高出411.62%,明显高于对照接种组的21 μmol·g-1处理。而BTH接种组与对照接种组的NO含量在第8天开始降低,接种组整体NO水平高于对照组水平。
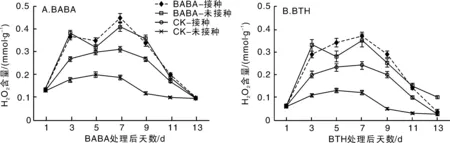
图2 BABA和BTH处理对番茄叶片H2O2含量的变化Fig.2 Effect of BABA and BTH on H2O2 content in tomato leaves at different inoculation intervals
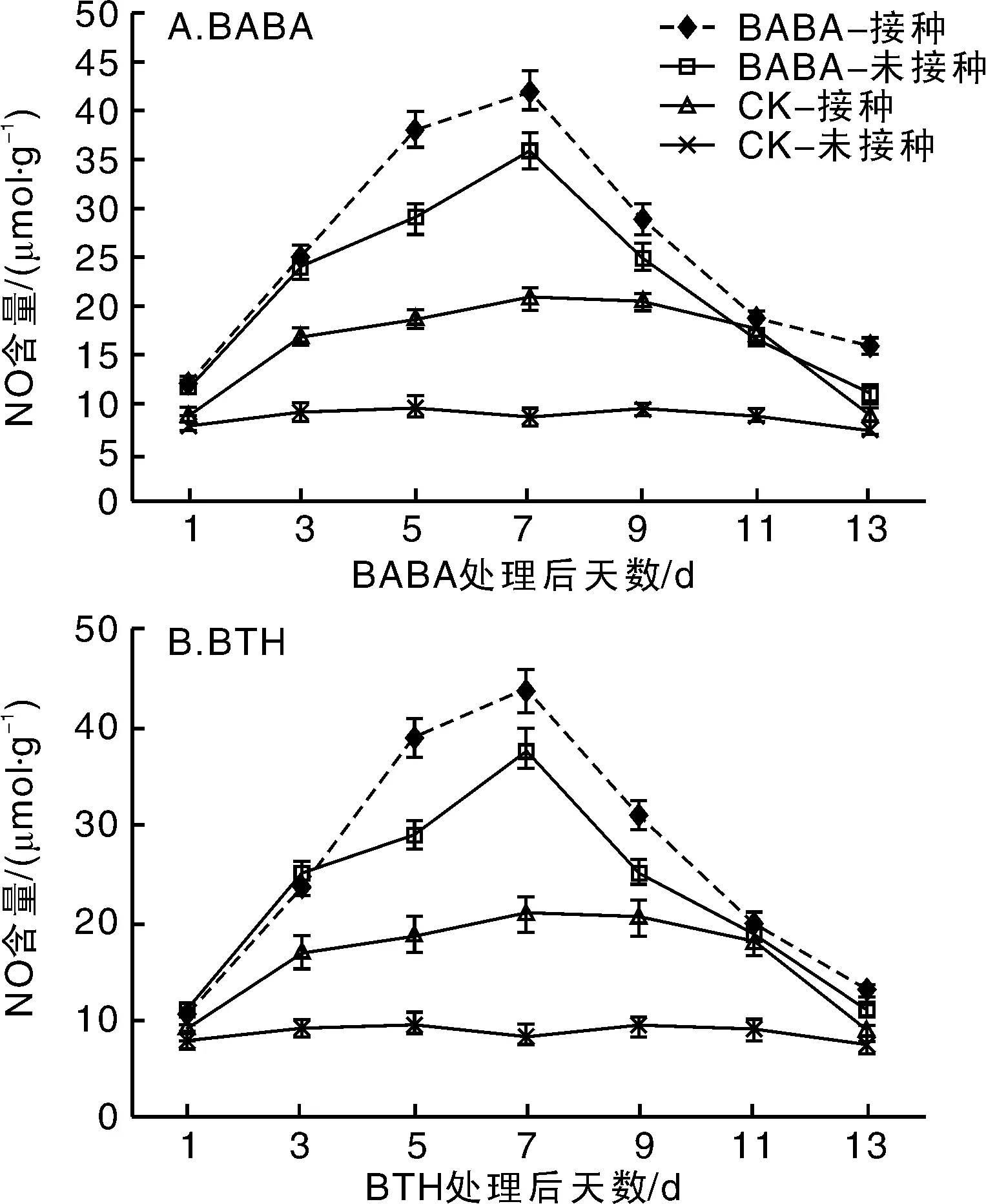
图3 BABA和BTH处理对番茄叶片NO含量的变化Fig.3 Effect of BABA and BTH on NO content in tomato leaves at different inoculation intervals
2.3番茄抗性相关基因的qRT-PCR表达分析
以500 mg·L-1的BABA和50 mg·L-1的BTH对感病材料(09888)和抗病材料(09111)做喷雾处理,以喷施蒸馏水为对照(CK),对番茄中4种抗病相关基因(CHI3,GLUCA,GLUCB和PR1A)进行实时荧光定量PCR分析。结果表明,两种材料在经过喷施诱导剂后,抗病相关基因的表达量都要显著高于CK组,呈逐渐上升趋势,且均在24 h时表达量达到最大,感病材料中抗病基因的表达量略高于抗病材料。在抗病材料中,BTH处理在24 h的CHI3基因相对表达量为10.4,而在感病材料中为11.5,如图4-A;GLUCA基因在感抗病材料中差别不大,但在感病材料中的表达量略高于抗病材料,GLUCB基因经诱导后表达量的差异较为明显,在感病材料中的表达量明显高于抗病材料,如图4-B和4-C。PR1A基因的相对表达量结果如图4-D,结果同样表明在感病材料中的表达量高于在抗病材料中的表达量。总体趋势来看,BTH处理的结果相对于BABA要更好些。四种抗病基因在诱导后,感病材料的表达量要高于抗病材料,表明诱导剂对感病材料起到的诱导作用相对明显;两种材料的抗病基因表达量均高于对照组,说明诱导剂诱导了抗病相关蛋白的表达,增强抗病性。
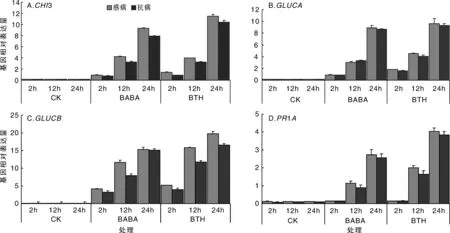
图4 BABA和BTH处理对番茄抗病相关基因相对表达量的影响Fig.4 Effect of BABA and BTH on expression of disease resistance related genes in tomato
3 结论与讨论
植物经过抗性诱导后,需要经过一段时间才能表现出抗性作用,即诱导剂的滞后性。Liljeroth等[11]发现BABA处理感染晚疫病菌的马铃薯后,与未处理BABA的样品相比,感染病菌的样品损害程度降低了40%~50%,但是,在BABA处理后这种效应只持续了4~5 d后效应逐渐降低。本试验中,BABA处理的最佳间隔时间为2 d,随着诱导间隔期的延长,防治效果降低,与Liljeroth等[11]的结果吻合,BABA诱导番茄抗白粉病的持续时间可达10 d左右。BTH处理后随着诱导间隔期的延长,防治效果降低,最佳间隔时间为诱导后第3~5天,持续抗病时间达15 d。说明不同的诱导因子在诱导抗性的表现中滞后性不同。
植物体内的活性氧(reactive oxygen species,ROS)与植物的抗病过程有着密切的联系。大量的研究证明,病原菌侵染植物细胞后,能诱导活性氧的迸发。Doke等[12]在1983年首先发现晚疫病菌(Phytophthorainfestans)侵染马铃薯后,植保素的形成和H2O2的的产生有对应关系。本试验证明BABA和BTH分别对番茄幼苗喷雾处理后发现,诱导组的H2O2含量明显高于清水对照组未接种处理。H2O2含量的明显积累,说明其作为信使分子正在参与植物抗病的信号转导作用,在后期H2O2含量又回落,说明H2O2参与信号转导后,多余的被相应酶系统清除,转化为水和氧。
Noritake等[13]研究发现NO通过诱导植物累积植保素来提高植物的抗病能力,试验中发现施用壳寡糖后,NO的含量明显增加。本研究发现,用诱导剂BABA和BTH在适当的浓度下处理番茄幼苗后,NO的含量在一定时间内有所增加,说明两种诱导剂可以通过信号分子NO来实现其对植物的诱抗作用。Loon等[14]在1970年首先发现病程相关蛋白(PR蛋白)。Ward等[15]证明至少有9种基因家族在PR蛋白中。本试验中的几丁质酶基因(CHI3)属于PR-3家族;GLUCA(β-1,3-葡聚糖酶)、GLUCB属于PR-2家族;PR1A属于PR-1家族。在喷施诱导剂BABA和BTH后,4个基因的表达趋势相近,但在不同处理时间、不同抗病相关基因以及不同材料中均存在差异。Ferraris等[16]对番茄接种枯萎病菌后,β-1,3-葡聚糖酶的活性在抗病品种中的表现低于感病品种。本试验研究发现,诱导剂BABA和BTH处理番茄后,抗病相关基因CHI3,GLUCA,GLUCB和PR1A在感病材料中的表达略高于在抗病材料,与Ferraris等[16]的研究结果一致,可见,喷施BABA和BTH后有助于番茄抵抗白粉病菌的侵染,提高番茄的抗病能力。
[1]SAENZ G S, TAYLOR J W. Phylogeny of the erysiphales (powdery mildew) inferred from internal transcribed spacer(ITS)ribosomal DNA sequence [J].CanadianJournalofBotany, 1999, 77(1):150-168.
[2]KLOPPER J W, TUNZUN S. Proposed definition related to induced disease resistance[J].BiocontrolScienceandTechnology, 1992, 2(4):349-351.
[3]COHEN Y, RUBIN A, VAKNIN M. Post infection application of DL-3-amino-n-butyric acid (BABA) induces multiple forms of resistance againstBremialactucaein lettuce[J].EuropeanJournalofPlantPathology, 2011, 130(1):13-27.
[4]GORLACH J, VOLRATH S, KNAUF-BEITER G, et al. Benzothiadiazole, a novel class of inducers of systemic acquired resistance, activates gene expression and disease resistance in wheat[J].PlantCell, 1996, 8(4):629-643.
[5]TOSI L, LUIGETTI R, ZAZZERINI A. Benzothiadiazole induces resistance to plasmopara h-elianthi in sunflower plants[J].JournalofPhytopathology, 1999, 147(6):365-370.
[6]葛秀春,宋凤鸣,郑重,等,BTH诱发水稻对稻瘟病的系统获得抗性[J]. 浙江农业学报,1999,11(6):311-314.
[7]朱路路,李帅,李景富,等.几种化学诱导剂对番茄白粉病抗性的诱导作用[J].北方园艺,2013(20):109-111.
[8]陈林年,张玉梅,史登玉.不同药剂防治加工番茄白粉病试验研究初报[J].农业科技与信息,2007(2):30-31.
[9]SERGIEV I, ALEXIEVA V, KARANOVE E. Effect of spermine,atrazine and combination between them on some endogenous protective systems and stress marks in plant[J].ComptesRendusdel’Acade'mieBulgaredesSciences:SciencesMathe'matiquesetNaturelles, 1997, 51: 121-124.
[10]MISKO T, SCHILLING R, SALVEMINI D. A fluorometric a assay for the measurement of nitrite in biological samples[J].AnalyticalBiochemistry, 1993, 214(1):11-16.
[11]LILJEROTH E, BENGTSSON T, WIIK L, et al. Induced resistance in potato toPhytphthorainfestans-effect of BABA in greenhouse and field tests with different potato varieties[J].EuropeanJournalofPlantPathology, 2010,127(2):171-183.
[12]DOKE N. Involvement of superoxide anion generation in hyper-sensitive response of potato tuber tissues to infection with an incompatible race ofPhytophthorainfestans[J].PhysiologicalPlantPathology, 1983, 23(3):345-357.
[13]NORITAKE T, LAWAKITA K, DOKE N. Nitric oxide induces phytoalexin accumulation in potato tuber tissues[J].Plant&CellPhysiology, 1996, 37(1):113-116.
[14]van LOON L C, VAN KAMMEN A. Polyacrylamide disc electrophoresis of the soluble proteins fromNicotianatabacumvar. ‘Samsun’ and ‘Samsun NN’. Ⅱ. Changes in protein constitution after infection with tobacco mosaic virus[J].Virology, 1970, 40(2):199-211.
[15]WARD E R, UKNES S J, WILLIAMS S C, et al. Coordinate gene activity in response to agents that induce systemic acquired resistance[J].PlantCell, 1991, 3(10):1085-1094.
[16]FERRARIS L, ABBASTTSTA GENTILE, MATTA A. Activation of glycosidases as a consequence of infection stress inFusariumwilt of tomato[J].JournalofPhytopathology, 1987, 118(4):317-325.
(责任编辑张韵)
Study on the resistance induced by BABA and BTH against powdery mildew in tomato
LI Hui-jia,ZHU Lu-lu,LI Shuai,YANG Huan-huan,ZHANG Dong-ye,WANG Qiang, WU Ming-chen, LI Jing-fu*
(CollegeofHorticulture,NortheastAgriculturalUniversity,Harbin150030,China)
The tomato seedlings were treated with 500 mg·L-1BABA and 50 mg·L-1BTH respectively, then inoculated with powdery mildew fungus on 1, 2, 3, 5, 8 and 15 d after treatment. The duration of action, optimal processing mode and disease-related mechanisms of two inducers were investigated by measuring disease index, relative control effect, H2O2and NO content and powdery mildew resistance related gene expression levels. The results showed that the best time of BABA was the second day and the effective duration was about 10 days, the best time of BTH was the first, third and fifth day and the effective duration was up to 15 days. The contents of H2O2and NO were significantly increased. The expression patterns ofCHI3,GLUCA,GLUCB,PR1Agenes all showed similar trend, but had differences at different treatment time in different materials. In conclusion, BABA and BTH could be used to improve the disease resistance of tomato to tomato powdery mildew.
BABA;BTH;messenger molecules;gene expresstion; tomato; tomato powdery mildew
10.3969/j.issn.1004-1524.2016.04.07
2015-09-07
“十二五”农村领域国家科技计划课题(2012BAD02B02-7)
李会佳(1989—),男,黑龙江佳木斯人,硕士,从事番茄育种研究。E-mail: lhj1949@hotmail.com
,李景富,E-mail: lijf_2005@126.com
S641.2
A
1004-1524(2016)04-0580-06
李会佳,朱露露,李帅,等. BABA, BTH对番茄白粉病的抗性研究[J].浙江农业学报,2016,28(4): 580-585.

