Caspases抑制条件下5-FU诱导乳腺癌细胞发生坏死性凋亡的作用
张智瑞, 孙小锦, 崇殿龙, 周 灿, 任 凯, 刘 浩
(蚌埠医学院药学系,安徽省生化药物工程技术研究中心,蚌埠 233030;*通讯作者,E-mail: liuhao6886@foxmail.com)
Caspases抑制条件下5-FU诱导乳腺癌细胞发生坏死性凋亡的作用
张智瑞, 孙小锦, 崇殿龙, 周 灿, 任 凯, 刘 浩
(蚌埠医学院药学系,安徽省生化药物工程技术研究中心,蚌埠 233030;*通讯作者,E-mail: liuhao6886@foxmail.com)
目的 探讨5-氟尿嘧啶(5-fluorouracil,5-FU)对乳腺癌细胞MDA-MB-231增殖的抑制作用,并在抑制caspases的条件下,对5-FU诱导的乳腺癌细胞的死亡形式进行探讨。 方法 MTT法检测不同浓度的5-FU(0,4,8,16,24,32 μmol/L)对乳腺癌细胞增殖的抑制作用,筛选适宜的药物浓度。在适宜药物浓度下实验分为对照组、z-VAD-fmk组、5-FU组、5-FU+z-VAD-fmk组,MTT法检测乳腺癌细胞存活率;PI单染流式细胞术检测乳腺癌细胞的死亡率;DAPI染色检测乳腺癌细胞核的变化;透射电镜观察乳腺癌细胞的死亡形式;Western blot检测坏死性凋亡蛋白RIP1表达的变化。 结果 8 μmol/L为5-FU的适宜浓度,该浓度下MDA-MB-231细胞在24 h,48 h,72 h的存活率分别为(68.94±1.17)%,(48.76±1.47)%和(44.15±2.41)%。 MTT、PI、DAPI实验结果表明与对照组和5-FU组相比,5-FU+z-VAD-fmk组细胞存活率明显降低(P<0.05),细胞核浓染加深,核固缩现象显著。电镜结果显示5-FU组细胞发生凋亡,5-FU+z-VAD-fmk组细胞发生坏死性凋亡。Western blot结果表明:z-VAD-fmk联用时5-FU明显上调RIP1蛋白的表达。 结论 5-FU可以诱导MDA-MB-231细胞发生凋亡; caspases抑制条件下5-FU通过激活RIP1诱导MDA-MB-231细胞发生坏死性凋亡。
乳腺癌; 5-氟尿嘧啶; z-VAD-fmk; 凋亡; caspases; 坏死性凋亡
乳腺癌是女性高发的恶性肿瘤,中国的乳腺癌发病率增长速度是全球的两倍多[1],目前的治疗手段仍以手术或放化疗为主,其发生腋淋巴结转移的患者预后情况差。5-氟尿嘧啶(5-fluorouracil,5-FU)作为经典的抗代谢药物,对胃癌、肠癌、乳腺癌、食管癌、肝癌和胰腺癌治疗效果较好[2]。5-FU可通过线粒体途径启动一系列不同的凋亡相关蛋白参与调控凋亡过程[3],或是产生过量的活性氧自由基促进细胞凋亡的发生[4]。大多数抗肿瘤药物抑制肿瘤细胞的增殖都是通过促进细胞发生凋亡来实现的。以凋亡耐受及药物转运蛋白的高表达为特征的肿瘤多药耐药的出现,使凋亡诱导剂及相关药物在临床中的应用受到限制。传统的细胞死亡形式分为坏死和凋亡,后者又称为程序性死亡,在最新研究中,坏死性凋亡作为一种新的非caspases依赖的程序性死亡形式被发现,对肿瘤耐药细胞的研究证实,坏死性凋亡诱导剂在规避肿瘤多药耐药方面具有“广谱性”[5,6]。本研究旨在观察5-FU对乳腺癌细胞株MDA-MB-231的抑制作用,并对caspases抑制条件下5-FU作用后细胞的死亡形式进行分析探讨,为5-FU类药物的临床应用提供实验基础。
1 材料与方法
1.1 主要试剂
5-FU购于上海麦克林生化科技有限公司;DMEM培养基、胎牛血清为美国Gibco公司产品;MTT、PI购于美国Sigma公司;DAPI购于碧云天生物技术公司;z-VAD-fmk购于美国Calbiochem公司; RIP1抗体购于美国Santa Cruz Biotechnology公司; DMSO、HRP标记的山羊抗兔IgG与β-actin抗体购于合肥BioSharp公司;ECL发光试剂盒购于美国Millipore公司。
1.2 细胞株及细胞培养
人乳腺癌MDA-MB-231细胞株购于中国科学院上海细胞库,由蚌埠医学院生化药理研究室保存。 MDA-MB-231细胞使用含有10%的胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM高糖培养基,置于 37 ℃、含5% CO2饱和湿度的细胞培养箱中培养。
1.3 MTT法检测细胞的存活率
将处于对数生长期的MDA-MB-231细胞按7×103/孔接种于96孔板中,每孔100 μl。在培养箱中放置生长24 h,弃去培养液,加入100 μl不同浓度的5-FU(0,4,8,16,24,32 μmol/L)进行处理,每组3个复孔。药物分别作用24,48,72 h,每孔分别避光加入15 μl MTT,继续培养4 h,缓慢吸去上清,每孔加入150 μl DMSO,37 ℃烘箱孵育30 min,酶标仪在波长490 nm处测吸光度值。Pan-caspases抑制剂z-VAD-fmk与药物合用时,预先使用20 μmol/L z-VAD-fmk作用于细胞1 h,弃去上清,将5-FU与其合用加入96孔板中,再进行如上检测。
1.4 PI单染流式细胞术检测细胞死亡率
MDA-MB-231细胞以1.2×105/孔接种到12孔板中,当细胞汇合率达80%时, 每孔分别加入5-FU、z-VAD-fmk、5-FU+z-VAD-fmk后继续培养24 h,收集细胞,加入预冷的75%乙醇固定,-20 ℃过夜。检测之前用预冷的PBS重悬2次,加入600 μl PI检测液,4 ℃避光孵育2 h,用流式细胞仪进行检测。
1.5 DAPI染色检测细胞核的变化
将MDA-MB-231细胞以1.2×105/孔接种于12孔板培养24 h,分组给药,药物处理24 h,用4%多聚甲醛进行固定,PBS洗涤3次,每孔加入600 μl DAPI染色液避光反应15 min,通过荧光显微镜观察细胞核形态学变化。
1.6 透射电镜实验观察细胞死亡形式
细胞分别在5-FU、5-FU+z-VAD-fmk作用下培养24 h,用巴氏吸管缓慢收集细胞,置于2.5%戊二醛中固定,乙醇脱水,LR White树脂进行渗透包埋,切片,柠檬酸铅与醋酸铀双染色,透射电子显微镜观察细胞的超微结构。
1.7 Western blot检测凋亡蛋白与坏死性凋亡蛋白的表达
培养细胞于60 mm培养皿中,药物作用24 h,收集细胞,加入适量预冷的RIPA蛋白裂解液,冰上裂解30 min,4 ℃低温离心机中12 000 r/min离心30 min,提取蛋白,使用BCA蛋白定量法测各组的蛋白浓度。每组取40 μg蛋白,进行SDS-PAGE电泳,转膜至PVDF膜;使用5%脱脂牛奶封闭2 h,TPBS洗膜3次,每次10 min;加一抗室温孵育4 h,TPBS洗膜3次;加二抗孵育2 h;TPBS洗膜3次,ECL发光试剂盒暗室发光显影,Bio-Rad凝胶成像系统获取图像,并使用Image J软件进行灰度值扫描。1.8 统计学分析
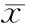
2 结果
2.1 5-FU对MDA-MB-231细胞的增殖抑制作用
MTT结果表明,随着5-FU浓度的增加、作用时间的延长,MDA-MB-231细胞的存活率明显降低(见图1)。8 μmol/L浓度时,24,48和72 h细胞的存活率分别为(68.94±1.17)%,(48.76±1.47)%和(44.15±2.41)%,实验中将8 μmol/L作为后续实验所使用的浓度。
2.2 caspases抑制条件下5-FU对MDA-MB-231细胞增殖的影响
结果显示,与对照组相比,5-FU组细胞存活率[(63.28±3.14)%]明显下降;与5-FU组相比,5-FU+z-VAD-fmk组细胞存活率为(51.13±2.65)%(见图2),对细胞增殖抑制作用进一步加强。即在caspases抑制条件下,5-FU对MDA-MB-231的增殖抑制作用增强。
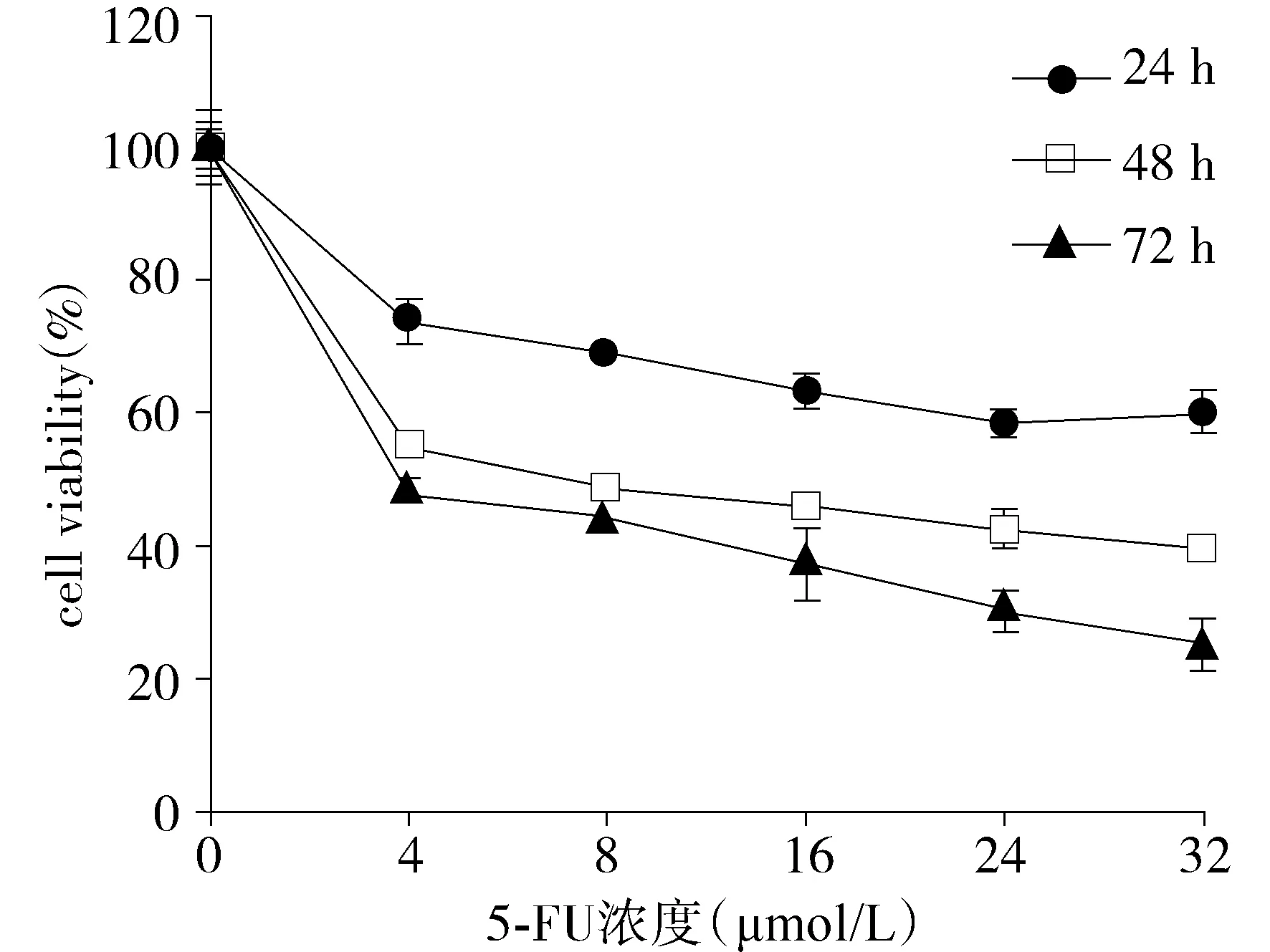
图1 5-FU对MDA-MB-231细胞存活率的变化Figure 1 Changes of the viability of MDA-MB-231 cells after treated with 5-FU for different time
2.3 PI单染实验检测细胞的死亡率
PI染色结果显示,对照组细胞死亡率为(3.93±0.45)%;与对照组相比,5-FU组细胞的死亡率[(35.8±2.27)%]明显增加;与5-FU组相比,5-FU+z-VAD-fmk组细胞死亡率[(44.3±1.45)%]进一步增加。即当使用caspases抑制剂z-VAD-fmk时,5-FU诱导MDA-MB-231细胞死亡率明显增加,差异均具有统计学意义(P<0.05)。
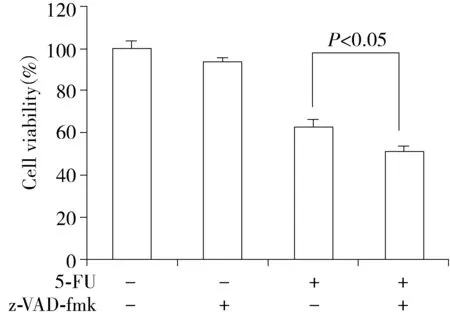
图2 Caspases抑制条件下,5-FU对MDA-MB-231的增殖抑制作用Figure 2 Effects of 5-FU on MDA-MB-231 cells under the condition of caspases inhibition
2.4 DAPI实验观察MDA-MB-231细胞核的变化
细胞进行DAPI染色荧光显微镜结果显示,对照组与z-VAD-fmk组的细胞核呈浅蓝色,均匀淡染;与对照组相比,5-FU组胞核浓染,出现了核碎裂;与5-FU组相比,5-FU+z-VAD-fmk组细胞核浓染加深,核碎裂现象加剧(见图4)。
图3 PI单染法检测5-FU和z-VAD-fmk以及两者联用24 h时MDA-MB-231细胞的死亡率Figure 3 Analysis of the cell death rate of MDA-MB-231 cells after treated with 5-FU,z-VAD-fmk and their combination for 24 h by PI staining
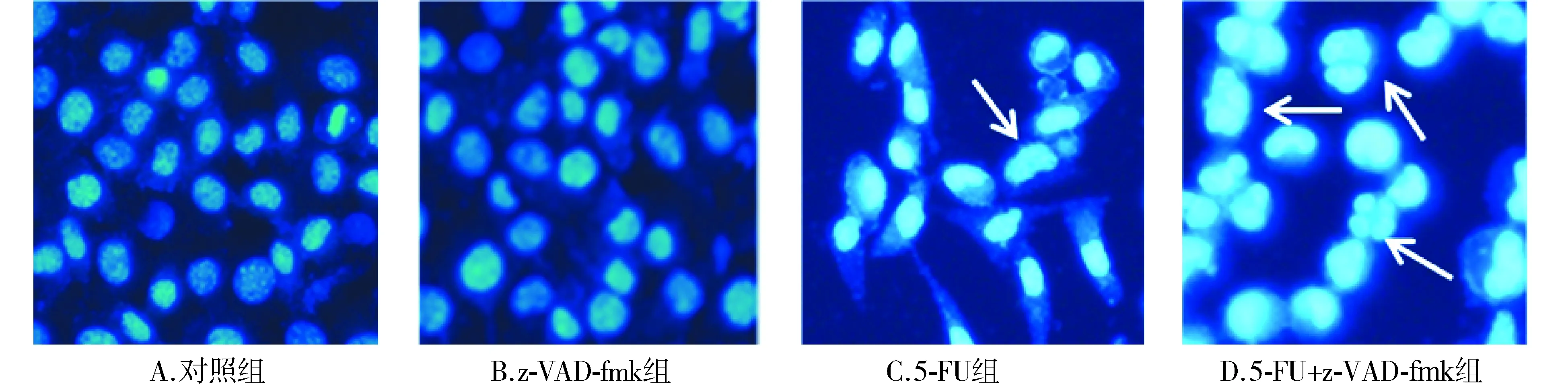
图4 DAPI染色检测5-FU和z-VAD-fmk单独及联合使用时对MDA-MB-231细胞核的影响Figure 4 Changes of MDA-MB-231 cell nuclei after treated with 5-FU,z-VAD-fmk and their combination by DAPI staining
2.5 MDA-MB-231细胞超微结构的改变
电镜结果表明,与对照组相比,5-FU作用后的细胞的超微结构明显改变,细胞皱缩,染色质边聚,线粒体有正常的超微结构,呈典型的凋亡形态学变化(见图5)。而5-FU和z-VAD-fmk联用组的电镜结果显示,细胞破裂,线粒体肿胀、细胞内容物外泄,呈典型的坏死性凋亡形态学变化(见图5)。

图5 单用5-FU 及与 z-VAD-fmk合用24 h细胞超微结构的变化Figure 5 Changes of the ultrastructure of the cells after treated with 5-FU and its combination with z-VAD-fmk for 24 h
2.6 Western blot检测相关蛋白的表达
RIP1是坏死性凋亡通路的关键蛋白,Western blot结果显示,单独使用 5-FU 组和z-VAD-fmk组均不能激活RIP1蛋白的表达,而5-FU+z-VAD-fmk 组RIP1蛋白表达明显增加(P≤0.05,见图6),由单用时的1.31±0.05增加至3.95±0.20。
3 讨论
5-氟尿嘧啶(5-FU)是常用的影响核酸合成的抗癌药物,能影响DNA的合成,对细胞具有抑制作用,用于多种肿瘤的治疗[7,8]。5-FU耐药性的发生成为其临床使用中的一大威胁,因此克服其耐药成为关键性问题。坏死性凋亡(necroptosis)是近年来被发现的一种非caspases依赖的程序性死亡方式,即在caspases被抑制的情况下,死亡受体与配体相结合,调控相关蛋白的表达触发坏死性凋亡[9]。坏死性凋亡的诱导与抑制不仅参与机体的生理调节过程,在脑缺血、心肌缺血、急性和慢性神经退行性疾病、肿瘤等多种人类疾病中也具有重要作用。它是一个主动的、信号依赖的过程,可以被许多因素所诱导,如TOLL样受体激动剂、FAS配体的产物、c-IAP1/2拮抗剂等。有研究表明,坏死性凋亡的诱导剂可激活细胞死亡而无需“触动”已揭示的最“难以捉摸”并高度可控的肿瘤耐药机制[10,11]。因此,引发癌细胞发生坏死性凋亡的方法是治疗癌症的有效手段之一。在caspases被抑制情况下,5-FU可以诱导结肠癌细胞通过RIP1和NF-kB通路发生坏死性凋亡[12];Smac可以诱导肺癌细胞发生坏死性凋亡[13]。本实验中,透射电镜结果表明,单独使用5-FU时MDA-MB-231细胞发生凋亡,而加入pan-caspases抑制剂z-VAD-fmk时,MDA-MB-231则发生坏死性凋亡。
细胞凋亡是受死亡信号调节并伴随天冬氨酸半胱氨酸蛋白酶caspases活化的一种细胞主动自杀的死亡方式,凋亡是由多基因严格调控的过程[14]。有研究报道,Bcl-2家族蛋白在细胞凋亡过程中具有重要的控制作用,其蛋白成员之间的协同作用共同决定细胞是否进入凋亡程序[15,16]。本课题设置不同剂量的5-FU处理MDA-MB-231细胞,MTT结果显示,与对照组相比,随着药物剂量的增大,5-FU对MDA-MB-231细胞的增殖抑制作用明显增强,细胞凋亡率明显升高。
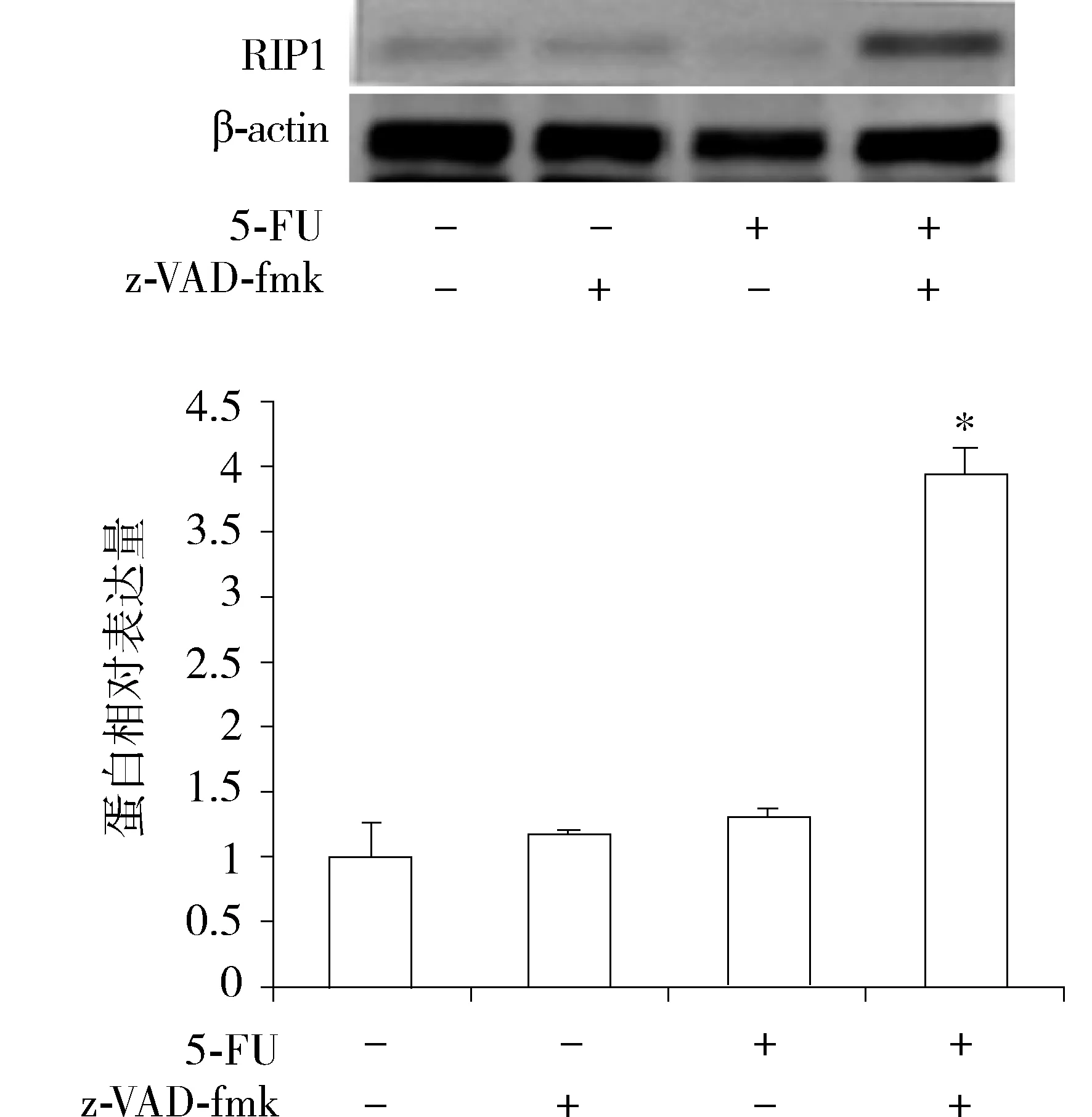
与其他三组比较,*P≤0.05图6 单用5-FU和z-VAD-fmk及两者合用对RIP1蛋白表达的影响Figure 6 Effects of 5-FU, z-VAD-fmk and their combination on protein expression of RIP1
坏死性凋亡定义为:一种与坏死具有相似的形态学特征(细胞体积及胞内细胞器肿胀,包膜完整性破坏,内容物外泄),且为非caspases依赖性的程序性细胞死亡,即在caspases抑制的条件下,死亡受体与配体的结合可触发坏死性凋亡。坏死性凋亡的调节涉及一系列分子的表达与活化,RIP在此过程中发挥了重要的作用[17],研究报道,caspases-8与RIP蛋白的交互表达可引起坏死性凋亡与凋亡的相互转化[18]。本实验中,使用pan-caspases抑制剂z-VAD-fmk联用后,5-FU诱导细胞死亡率明显增加。通过Western blot检测坏死性凋亡关键蛋白RIP1的表达,发现与z-VAD-fmk联用时,RIP1明显被激活,触发坏死性凋亡。
综上所述,5-FU诱导乳腺癌MDA-MB-231细胞发生凋亡,但在caspases被抑制的情况下,5-FU通过激活RIP1诱导MDA-MB-231细胞发生了坏死性凋亡。本研究不仅加深了对细胞死亡方式的理解与认识,也为5-FU在肿瘤治疗及其多药耐药克服的研究、坏死性凋亡诱导剂在临床中的研究提供一定的实验基础,具体机制有待进一步考察。
[1] Chen,W,Zheng R,Baade PD,etal.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] Silverstein RA,González de Valdivia E,Visa N.The incorporation of 5-fluorouracil into RNA affects the ribonucleolytic activity of the exosome subunit Rrp6[J].Mol Cancer Res,2011,9(3):332-340.
[3] Okamura M,Shimada J,Sakagami H.Comparative analysis of cell death induction by cisplatin and 5-FU in human oral squamous and hepatocellular carcinoma cell lines[J].Anticancer Res,2008,28(1A):253-259.
[4] Chibber S,Farhan M,Hassan I,etal.White light-mediated Cu(Ⅱ)-5FU interaction augments the chemotherapeutic potential of 5-FU:an in vitro study[J].Tumour Biol,2011,32(5):881-892.
[5] Zhou,W,Yuan J.Necroptosis in health and diseases[J].Semin Cell Dev Biol,2014,35:14-23.
[6] Fulda S.Therapeutic exploitation of necroptosis for cancer therapy[J].Semin Cell Dev Biol,2014,35:51-56.
[7] Lee,JJ,Beumer JH,Chu E.Therapeutic drug monitoring of 5-fluorouracil[J].Cancer Chemother Pharmacol,2016,20:1-18.
[8] 林宇,苏富琴,陈咏梅.5-氟尿嘧啶临床应用进展[J].齐齐哈尔医学院学报,1999,20(3):294-295.
[9] Vandenabeele P,Galluzzi L,Vanden Berghe T,etal.Molecular mechanisms of necroptosis:an ordered cellular explosion[J].Nat Rev Mol Cell Biol,2010,11(10):700-714.
[10] Han W,Li L,Qiu S,etal.Shikonin circumvents cancer drug resistance by induction of a necroptotic death[J].Mol Cancer Ther,2007,6(5):1641-1649.[11] Xuan,Y,Hu X.Naturally-occurring shikonin analogues-a class of necroptotic inducers that circumvent cancer drug resistance[J].Cancer Lett,2009,274(2):233-242.
[12] Oliver Metzig M,Fuchs D,Tagscherer KE,etal.Inhibition of caspases primes colon cancer cells for 5-fluorouracil-induced TNF-alpha-dependent necroptosis driven by RIP1 kinase and NF-kappaB[J].Oncogene,2016,35(26):3399-3409.
[13] Hannes S,Abhari BA,Fulda S.Smac mimetic triggers necroptosis in pancreatic carcinoma cells when caspase activation is blocked[J].Cancer Lett,2016,380(1):31-38.
[14] Gillies LA,Kuwana T.Apoptosis regulation at the mitochondrial outer membrane[J].J Cell Biochem,2014,115(4):632-640.
[15] Gross A.BCL-2 family proteins as regulators of mitochondria metabolism[J].Biochim Biophys Acta,2016,1857(8):1243-1246.
[16] Tomek M,Akiyama T,Dass CR.Role of Bcl-2 in tumour cell survival and implications for pharmacotherapy[J].J Pharm Pharmacol,2012,64(12):1695-1702.
[17] Degterev A,Zhou W,Maki JL,etal.Assays for necroptosis and activity of RIP kinases[J].Methods Enzymol,2014,545:1-33.
[18] Nogusa S,Thapa RJ,Dillon CP,etal.RIPK3 activates parallel pathways of MLKL-driven necroptosis and FADD-mediated apoptosis to protect against influenza A virus[J].Cell Host Microbe, 2016, 20(1):13-24.
5-FU induces necroptosis in breast cancer cells after the inhibition of caspases
ZHANG Zhirui, SUN Xiaojin, CHONG Dianlong, ZHOU Can, REN Kai, LIU Hao*
(FacultyofPharmacy,BengbuMedicalCollege,AnhuiEngineeringTechnologyResearchCenterofBiochemicalPharmaceuticals,Bengbu233030,China;*Correspondingauthor,E-mail:liuhao6886@foxmail.com)
ObjectiveTo explore the inhibitive effect of 5-fluorouracil(5-FU) on the proliferation of human breast cancer MDA-MB-231 cells and analyze the form of cell death in the condition of caspase inhibition.MethodsMTT assay was used to detect the viability of breast cancer MDA-MB-231 cells after exposed to different concentrations(0,4,8,16,24,32 μmol/L) of 5-FU for screening the appropriate concentration of 5-FU. Then the experiment was divided into four groups:control group, z-VAD-fmk group, 5-FU group, 5-FU+z-VAD-fmk group. The viability of breast cancer was evaluated by MTT assay, the cell death rate was assessed using flow cytometry with PI staining, DAPI staining was performed to demonstrate the cell nucleus changes, the form of cell death was observed under transmission electron microscopy, and Western blot was used to detect the expression of necroptosis-related protein RIP1.ResultsThe appropriate concentration of 5-FU in MDA-MB-231 cells was 8 μmol/L, and the cell survival rates were(68.94±1.17)%, (48.76±1.47)% and (44.15±2.41)% after exposed to 8 μmol/L 5-FU for 24,48,72 h.MTT,PI,DAPI results showed that compared to control group and 5-FU group,the cell survival was significantly decreased in 5-FU+z-VAD-fmk group(P<0.05),and the hyperchromatic nuclei was gradually darkened and karyopyknosis was observed.The electron microscope results indicated that apoptosis occurred in 5-FU group,and the necroptosis happened in 5-FU+z-VAD-fmk group. RIP1 protein was up-regulated clearly after the combined treatment with 5-Fu and z-VAD-fmk.Conclusion5-FU can induce the apoptosis in MDA-MB-231 cells, and it can induce the necroptosis by activating RIP1 when caspases activation is blocked by z-VAD-fmk.
breast cancer; 5-fluorouracil; z-VAD-fmk; apoptosis; caspases; necroptosis
国家自然科学基金资助项目(81372899);安徽省高等学校省级自然科学研究项目重大项目(KJ2016SD39)
张智瑞,女,1992-04生,硕士,E-mail:824039564@qq.com
2016-07-05
R737.9
A
1007-6611(2016)09-0808-05
10.13753/j.issn.1007-6611.2016.09.006

