IRS-2 siRNA对肾母细胞瘤G401细胞增殖的影响及其分子机制
杨 洁, 王宝西
(第四军医大学附属唐都医院儿科,西安 710038; *通讯作者,E-mail:ekwbx1960@163.com)
IRS-2 siRNA对肾母细胞瘤G401细胞增殖的影响及其分子机制
杨 洁, 王宝西
(第四军医大学附属唐都医院儿科,西安 710038;*通讯作者,E-mail:ekwbx1960@163.com)
目的 观察胰岛素受体底物2(IRS-2)siRNA对肾母细胞瘤G401细胞增殖的影响,探讨其分子机制。 方法 应用siRNA干扰IRS-2表达,将G401细胞分为空白对照组、阴性对照组和IRS-2 siRNA组,空白对照组不做处理,阴性对照组转染阴性对照siRNA,IRS-2 siRNA组转染IRS-2特异性siRNA。MTT法检测IRS-2对肾母细胞瘤G401细胞增殖的影响,流式细胞术分析IRS-2 siRNA对细胞周期和凋亡的影响,Western blot检测IRS-2 siRNA对p-Akt、Akt、CDK2和Cyclin A2表达的影响。 结果 与空白对照组和阴性对照组相比,IRS-2 siRNA组G401细胞的IRS-2 mRNA和蛋白的表达均显著下调(P<0.01),IRS-2 siRNA抑制肾母细胞瘤G401细胞增殖;与空白对照组和阴性对照组相比,IRS-2 siRNA组G401 S期细胞数量显著增加(P<0.01),G2/M期细胞数量显著减少(P<0.01),IRS-2 siRNA组G401细胞的早期凋亡和晚期凋亡显著增加(P<0.01);与空白对照组和阴性对照组相比,IRS-2 siRNA组p-Akt、CDK2和Cyclin A2在蛋白水平的表达均下调(P<0.01)。 结论 IRS-2通过激活Akt信号通路,调控CDK2和Cyclin A2的表达,进而促进肾母细胞瘤G401细胞增殖。
胰岛素受体底物2; 肾母细胞瘤; 细胞增殖; 细胞周期; 细胞凋亡; Akt信号通路
肾母细胞瘤是儿童肾脏最常见恶性肿瘤,约占儿童肾脏肿瘤的95%[1,2]。其发生是多因素、多基因参与的生物学过程。目前尚未清楚肾母细胞瘤的发病机制,因而缺乏相应的靶向治疗手段。胰岛素受体底物2(insulin receptor substrate 2,IRS-2)最初在IRS1-/-小鼠被胰岛素刺激的细胞中发现[3]。IRS-2是有丝分裂发生的主要介质且调控葡萄糖代谢[4]。研究表明,IRS-2与乳腺癌、胰腺癌等肿瘤的细胞生存相关,参与肿瘤的发展过程[5,6]。然而IRS-2在肾母细胞瘤中的作用尚未见报道。本研究应用siRNA沉默IRS-2基因表达,分析对人肾母细胞瘤G401细胞增殖的影响,观察Akt信号通路,及细胞周期调节蛋白CDK2和Cyclin A2表达的变化,探讨IRS-2影响肾母细胞瘤细胞增殖的分子机制。
1 材料与方法
1.1 细胞株
人肾母细胞瘤G401细胞由第四军医大学中心实验室提供,用含10%新生胎牛血清的Mc-Coy5A培养基,置于5%CO2,37 ℃孵箱中培养,取对数生长期的细胞进行实验。
1.2 主要试剂与仪器
新生胎牛血清购自美国Gibico公司;Mc-Coy5A培养基购自美国Life Technologies公司;MTT、碘化丙啶(PI)、RnaseA、胰岛素受体底物2(IRS-2)购于美国Sigma公司;Trizol和Lipofectamine2000购于美国Invitogen公司;Annexin Ⅴ-FITC凋亡试剂盒购自美国BD BioScience公司;qRT-PCR试剂盒和逆转录试剂盒购自日本TaKaRa公司;兔抗人IRS-2单克隆抗体、兔抗人p-Akt单克隆抗体、兔抗人Akt多克隆抗体、兔抗人Cyclin A2单克隆抗体、兔抗人CDK2单克隆抗体、小鼠抗人β-Actin单克隆抗体均购自美国Cell Signaling公司;RIPA细胞裂解液购于上海碧云天公司;ECL化学发光试剂盒购于美国Pierce公司。
二氧化碳培养箱Galaxy S(英国RS Biotech公司);低速离心机TDL-5(上海安亭科学仪器厂);高通量多功能微板测试系统(德国BMG Labtechnologies公司);FASCalibar流式细胞仪(美国FALS CALIBAR BD公司);垂直电泳系统SE260(美国Amersham公司);湿法蛋白电转印系统DYCZ-40D(北京六一仪器厂);GBOX-HR全自动凝胶成像分析系统(英国SYNGENE公司);实时定量PCR仪iQ5 Multicolor(美国Bio-Rad公司)。
1.3 siRNA合成与转染
IRS-2 siRNA sense:5′-GAUCUGUCUGGCUUUAUCATT-3′,antisense:5′-UGAUAAAGCCAGACAGAUCTT-3′;阴性对照siRNA(negative siRNA)sense:5′-UUCUCCGAACGUGUCACGUTT-3′,antisense:5′-ACGUGACACGUUCGG AGAATT-3′;由上海吉玛制药技术有限公司设计与合成。将G401细胞分为空白对照组、阴性对照组与IRS-2 siRNA组,空白对照组不做干预,阴性对照组转染阴性对照siRNA,IRS-2 siRNA组转染IRS-2特异性siRNA。将G401细胞用无抗生素含血清的Mc-Coy5A培养液重悬,接种于96或6孔板中继续培养24 h。按照LipofectamineTM2000转染试剂说明书操作,将siRNA瞬时转染G401细胞,转染4-6 h,换新鲜的含10%血清的完全培养基,继续培养24,48,72 h分别检测细胞增殖、周期及凋亡。
1.4 MTT比色法检测IRS-2 siRNA对G401细胞增殖的影响
G401细胞以5 000个/孔接种于96孔板,每孔200 μl培养基。实验分组为空白对照组、阴性对照组(70 nmol/L)和IRS-2 siRNA(70 nmol/L)组。每组5个复孔,转染后再分别培养24,48,72 h,再每孔加入5 mg/ml MTT 溶液20 μl,继续培养4 h,弃上清并加入150 μl DMSO,在POLARstar+OPTIMA微板测试仪上检测光吸收值,检测波长为490 nm。
1.5 流式细胞仪检测IRS-2 siRNA对G401细胞周期的影响
转染48 h时收集细胞,PBS洗涤2次,用75%乙醇过夜固定;再加入0.3 ml浓度为100 μg/ml PI染液,避光静置20 min;使用流式细胞仪检测,激发波长为488 nm,PI的红色荧光通过630 nm的滤光片进行收集,BD FACSort CellQuest软件获取数据,采用Modfit LT软件分析DNA含量变化。
1.6 流式细胞仪检测IRS-2 siRNA对G401细胞凋亡的影响
收集转染48 h的细胞,PBS洗涤2次。用500 μl结合缓冲液悬浮细胞,再加入5 μ1 Annexin Ⅴ/FITC与5 μl 20 μg/ml的碘化丙锭,混合均匀,避光静置20 min。用流式细胞仪检测,FITC受激发后发绿色荧光,PI发红色荧光,结果用随机软件进行分析。
1.7 Real time PCR检测转染IRS-2 siRNA时G401细胞中IRS-2 mRNA表达
G401细胞在转染24 h时加入Trizol。用氯仿、异丙醇等提取总RNA。按照逆转录试剂盒说明书加样,37 ℃ 90 min,70 ℃ 10 min,终止反应。Real time PCR反应,按照人IRS-2序列,设计Real time PCR 引物。IRS-2上游引物:5′-TTGACTTCTTGTCCCACCACTTG-3′,IRS-2下游引物:5′-GCTGAGCGTCTTCTTTTAATGATACT-3′;β-actin上游引物:5′-TGGCACCCAGCACAATGAA-3′,β-actin下游引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。扩增条件:94 ℃变性2 min,按94 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s进行30个循环,于72 ℃延伸10 min。用2-ΔΔCt法对Real time PCR的结果相对定量分析。
1.8 免疫蛋白印迹分析IRS-2 siRNA对CDK2、Cyclin A2表达和Akt信号通路的影响
收集转染48 h的细胞,应用RIPA裂解液提取细胞总蛋白。变性后电泳,转膜,用5%脱脂奶粉室温封闭1 h,分别加入兔抗人IRS-2单克隆抗体(1∶1 000稀释)、兔抗人p-Akt单克隆抗体(1∶1 000稀释)、兔抗人Akt多克隆抗体(1∶1 000稀释)、兔抗人Cyclin A2单克隆抗体(1∶1 000稀释)、兔抗人CDK2单克隆抗体(1∶1 000稀释)、小鼠抗人β-actin单克隆抗体(1∶3 000稀释),4 ℃孵育过夜,洗膜,用HRP标记的羊抗兔/羊抗鼠二抗(1∶2 000稀释)室温孵育2 h,洗膜。加入免疫印迹化学发光液,应用Syngene G Box凝胶成像仪拍照,GeneTools软件分析。
1.9 统计学分析
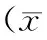
2 结果
2.1 转染IRS-2 siRNA后肾母细胞瘤G401细胞中IRS-2表达下调
在肾母细胞瘤G401细胞中稳定转染IRS-2 siRNA后,与空白对照组相比,阴性对照组无显著性差异,siRNA组IRS-2 mRNA表达减少[(18.7±3.1)%],差异具有统计学意义(P<0.01);与阴性对照组相比,siRNA组IRS-2 mRNA表达也显著减少[(19.2±3.0)%,P<0.01,见图1A];同时,siRNA组IRS-2蛋白表达与空白对照组和阴性对照组相比也均明显下调(P<0.01,见图1B)。表明siRNA有效地沉默了G401细胞中IRS-2表达。
2.2 沉默IRS-2对G401细胞增殖的影响
与空白对照组相比,IRS-2 siRNA组48,72 h时G401细胞的增殖能力显著降低为(64.4±4.5)%和(58.2±5.8)%(P<0.01);IRS-2 siRNA组24 h时无显著变化。阴性对照组与空白对照组相比无统计学差异。与阴性对照组相比,IRS-2 siRNA组48,72 h时G401细胞的增殖能力也均显著降低为(60.3±4.2)%和(61.9±4.6)%(P<0.01,见图2)。说明沉默IRS-2表达可抑制肾母细胞瘤G401细胞增殖。
2.3 沉默IRS-2对G401细胞周期的影响
在G401细胞中转染IRS-2 siRNA 48 h时,将其消化分散为单细胞悬液,通过流式细胞仪检测细胞周期。IRS-2 siRNA组与空白对照组相比,G0/G1期细胞数量有所增加,S期细胞数量显著增加(P<0.01),而G2/M期细胞数量显著减少(P<0.01);阴性对照组与空白对照组无统计学差异;与阴性对照组相比,IRS-2 siRNA组G0/G1期细胞数量也有所增加,S期细胞数量也显著增加(P<0.01),而G2/M期细胞数量也显著减少(P<0.01,见图3)。证明沉默IRS-2使肾母细胞瘤G401细胞阻滞在S期,抑制细胞进入G2/M期进行分裂。
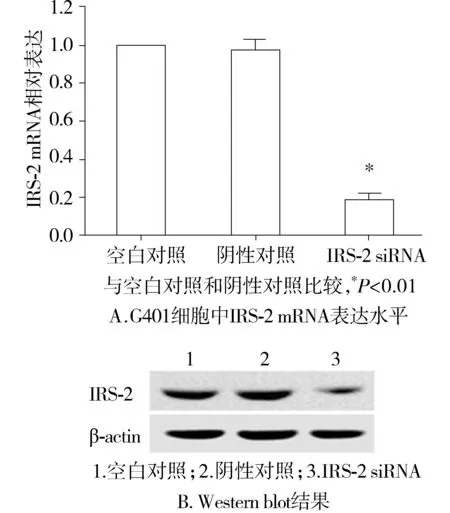
图1 转染IRS-2 siRNA后G401细胞中IRS-2表达的变化Figure 1 The changes of IRS-2 expression after transcription IRS-2 siRNA in G401 cells
与空白对照组和阴性对照组比较,*P<0.01图2 沉默IRS-2对G401细胞增殖的影响(MTT比色分析)Figure 2 Effect of IRS-2 silencing on G401 cell proliferation by MTT assay
2.4 沉默IRS-2对G401细胞凋亡的影响
在肾母细胞瘤G401中转染IRS-2 siRNA 48 h时,收获细胞制备为单细胞悬液,采用Annexin Ⅴ+PI试剂盒染色,运用流式细胞仪检测。空白对照组早期凋亡细胞为(5.61±2.33)%;晚期凋亡细胞为(3.26±1.87)%。与空白对照组相比,siRNA组早期凋亡细胞显著增加(P<0.01),为(13.55±2.52)%,晚期凋亡细胞也增加(P<0.01),为(17.09±2.83)%;而阴性对照组与空白对照组相比无统计学差异。与阴性对照组相比,siRNA组早期凋亡和晚期凋亡细胞均显著增加(P<0.01,见图4)。

与空白对照组和阴性对照组比较,*P<0.01图3 沉默IRS-2对G401细胞周期的影响Figure 3 Effect of IRS-2 silencing on cell cycle of G401 cells

与空白对照组和阴性对照组比较,*P<0.01图4 沉默IRS-2对G401细胞凋亡的影响Figure 4 Effect of IRS-2 silencing on apoptosis of G401 cells
2.5 沉默IRS-2抑制G401细胞Akt信号通路的激活
为进一步分析IRS-2生物学作用的分子机制,采用Western blot分析沉默IRS-2对肾母细胞瘤G401细胞内p-Akt、Akt、CDK2和Cyclin A2表达的影响,结果发现,沉默IRS-2后与空白对照组和阴性对照组相比p-Akt、CDK2和Cyclin A2表达均下降,而Akt表达无统计学差异;阴性对照组与空白对照组相比各蛋白无统计学差异(见图5)。
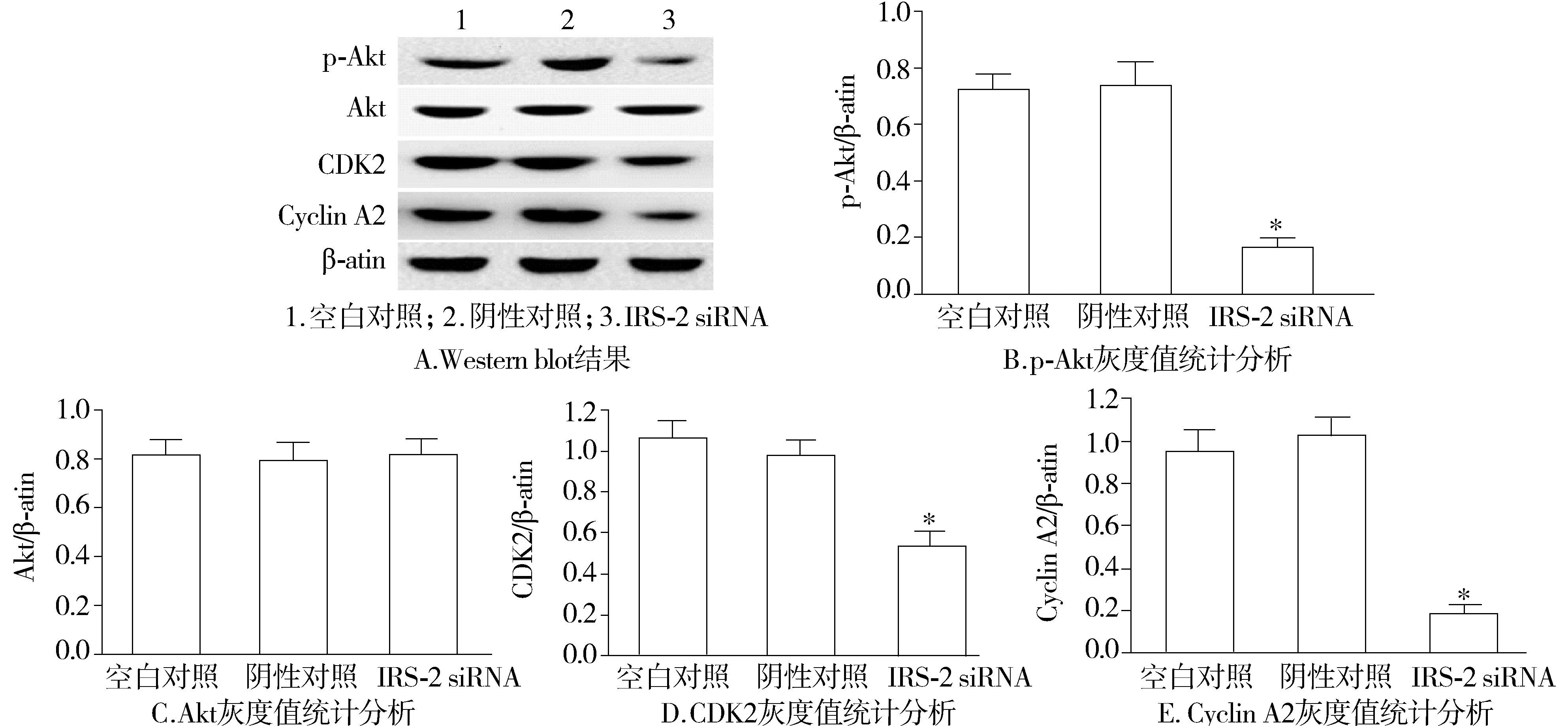
与空白对照组和阴性对照组比较,*P<0.01图5 沉默IRS-2对p-Akt、Akt、CDK2、Cyclin A2表达的影响Figure 5 Effect of IRS-2 silencing on p-Akt, Akt, CDK2 and Cyclin A2 expression
3 讨论
IRS-2属于胰岛素受体底物(IRS)家族成员,IRS是一类胞质蛋白激酶,它们是在胰岛素信号传导中首次被发现。研究表明,在人类乳腺癌、神经母细胞瘤和间皮瘤细胞中IRS-2传导信号能够促进细胞的迁移与侵袭能力[5,7]。IRS-2促进肿瘤恶化和侵袭能力的一个可能的机制是通过促进肿瘤细胞表面的葡萄糖转运从而增强糖酵解引起的。IRS-2也被证实与促进肿瘤细胞生存相关,这很可能是由于其参与了肿瘤发展的进程。IRS-2在胰腺癌细胞中能够通过调控IGF1信号通路促进肿瘤的发展过程[8]。近期的研究结果表明,IRS-2在肾癌和口腔癌中表达上调,并通过激活Akt信号通路促进肿瘤细胞增殖[9,10]。另外,IRS-2缺失型乳腺癌细胞更容易发生凋亡[11]。本研究结果显示,应用siRNA沉默IRS-2表达后,肾母细胞瘤G401细胞的增殖能力显著下降,凋亡增加,证明IRS-2可促进肾母细胞瘤G401细胞增殖并抑制凋亡。
细胞周期是细胞生命活动的一项重要的过程,其进展程度受很多分子的调控,其中细胞周期调节器(Cyclins)是细胞周期的主要调节因子,它们分别参与细胞周期的不同阶段。细胞周期蛋白依赖性蛋白激酶(CDKs)也参与细胞周期的调节。其中CDK2与Cyclin A2结合,促进细胞由S进入G2/M期进行细胞分裂[9,10]。本研究结果显示,当IRS-2 siRNA处理肾母细胞瘤G401细胞后,S期细胞数量增加,而G2/M期细胞数量显著减少;同时CDK2和Cyclin A2表达下调。这说明IRS-2能够通过调控CDK2和Cyclin A2的表达,使细胞跨越S-G2/M期节点,进而促进肾母细胞瘤G401细胞进行分裂、增殖。
磷酯酰肌醇-3激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)信号通路在肿瘤的发生、发展过程中发挥非常重要的作用。研究发现PI3K/Akt信号通路在卵巢癌、结直肠癌、淋巴瘤、胰腺癌、非小细胞肺癌、淋巴瘤及胃癌等多种肿瘤组织中过度表达和活化[12-16]。其中相关基因异常表达所致的功能获得或者缺失可引起肿瘤细胞增殖、凋亡、迁移及侵袭的异常。活化的Akt可调节许多与细胞增殖相关的蛋白,如mTOR、c-myc和CREB等。活化的PI3K-Akt可通过TSC1/2复合物激活其下游分子mTOR。mTOR可调控在翻译过程中起重要作用的4E-BPl、p70S6K和eIF4GI等蛋白的表达[6]。c-myc是一种较强的细胞周期促进因子,可使细胞逃离G0期,引起细胞增殖,Akt通过增加癌基因c-myc的转录、上调该基因的表达而影响细胞周期。近来的研究表明,在肾癌和口腔癌中激活PI3K-Akt信号通路可上调细胞周期调控因子CDK2和Cyclin A2的表达,进而促进细胞分裂增殖。本研究结果显示,在肾母细胞瘤G401细胞中沉默IRS-2表达,则抑制PI3K-Akt信号通路激活,下调CDK2和Cyclin A2的表达。说明IRS-2可通过激活PI3K-Akt信号通路影响肾母细胞瘤增殖。
总之,siRNA干扰IRS-2表达后,通过抑制PI3K-Akt激活,调控CDK2和Cyclin A2的表达,进而抑制了肾母细胞瘤G401细胞分裂、增殖。这将有助于进一步了解肾母细胞瘤发病机制,为开辟肾母细胞瘤治疗的新途径提供实验依据。
[1] Pastore G,Znaor A,Spreafico F,etal.Malignant renal tumours incidence and survival in European children(1978-1997):Report from the automated childhood cancer information system project[J].Eur J Cancer,2006,42(13):2103-2114.
[2] Davidoff AM. Wilms tumor[J].Adv Pediatr,2012,59(1):247-267.
[3] Patti ME,Sun XJ,Bruening JC,etal.4PS/insulin receptor substrate(IRS)-2 is the alternative substrate of the insulin receptor in IRS-1-deficient mice[J].J Biol Chem,1995,270(42):24670-24673.
[4] White MF.IRS proteins and the common path to diabetes[J].Am J Physiol Endocrinol Metab,2002,283(3):E413-422.
[5] Pankratz SL,Tan EY,Fine Y,etal.Insulin receptor substrate-2 regulates aerobic glycolysis in mouse mammary tumor cells via glucose transporter 1[J].J Biol Chem,2009,284(4):2031-2037.[6] Boissan M,Beurel E,Wendum D,etal.Overexpression of insulin receptor substrate-2 in human and murine hepatocellular carcinoma[J].Am J Pathol,2005,167(3):869-877.
[7] Cui X,Kim HJ,Kuiatse I,etal.Epidermal growth factor induces insulin receptor substrate-2 in breast cancer cells via c-Jun NH2-terminal kinase/activator protein-1 signaling to regulate cell migration[J].Cancer Res,2006,66(10):5304-5313.
[8] Stoeltzing O,Liu W,Fan F,etal.Regulation of cyclooxygenase-2(COX-2) expression in human pancreatic carcinoma cells by theinsulin-like growth factor-I receptor(IGF-IR)system[J].Cancer Lett,2007,258(2):291-300.
[9] Ma Y,Zhang H,He X,etal.miR-106a* inhibits the proliferation of renal carcinoma cells by targeting IRS-2[J].Tumour Biol,2015,36(11):8389-8398.
[10] Gao L,Wang X,WangX,etal.IGF-1R, a target of let-7b, mediates crosstalk between IRS-2/Akt and MAPK pathways to promote proliferation of oral squamous cell carcinoma[J].Oncotarget,2014,5(9):2562-2574.
[11] Clark JL,Dresser K,Hsieh CC,etal.Membrane localization of insulin receptor substrate-2(IRS-2) is associated with decreased overall survival in breast cancer[J].Breast Cancer Res Treat,2011,130(3):759-772.
[12] Maira SM,Finan P,Garcia-Echeverria C.From the bench to the bed side:PI3K pathway inhibitors in clinical development[J].Curr Top Microbiol Immunol,2010,347:209-239.
[13] Shi F,Wang YC,Zhao TZ,etal.Effects of simulated microgravity on human umbilical vein endothelial cell angiogenesis and role of the PI3K-Akt-eNOS signal pathway[J].PLoS One,2012,7(7):e40365.
[14] Yousif NG.Fibronectin promotes migration and invasion of ovarian cancer cells through up-regulation of FAK-PI3K/Akt pathway[J].Cell Biol Int,2014,38(1):85-91.
[15] Xu ZZ,Xia ZG,Wang AH,etal.Activation of the PI3K/AKT/mTOR pathway in diffuse large B cell lymphoma:clinical significance and inhibitory effect of rituximab[J].Ann Hematol,2013,92(10):1351-1358.
[16] Presneau N,Shalaby A,Idowu B,etal.Potential therapeutic targets for chordoma:P13K/AKT/TSCl/TSC2/mTOR pathway[J].Br J Cancer,2009,100(9):1406-1414.
Effects of IRS-2 siRNA on proliferation of nephroblastoma G401 cells and its molecular mechanism
YANG Jie, WANG Baoxi*
(DepartmentofPediatrics,TangduHospital,FourthMilitaryMedicalUniversity,Xi’an710038,China;*Correspondingauthor,E-mail:ekwbx1960@163.com)
ObjectiveTo investigate the effects of IRS-2 on the proliferation of nephroblastoma G401 cells and its molecular mechanism.MethodsThe siRNA interference was used to knockdown IRS-2. G401 cells were divided into three groups: blank control group, negative control group and IRS-2 siRNA group. Control siRNA and IRS-2-targeted siRNA were transfected into G401 cells in negative control group and IRS-2 siRNA group, respectively. MTT assay was used to analyze the effects of IRS-2 on proliferation of nephroblastoma G401 cells. The effects of IRS-2 on the cell cycle and apoptosis of nephroblastoma G401 cells were observed by flow cytometer. The effects of IRS-2 siRNA on the expression of p-Akt, Akt, CDK2 and Cyclin A2 were analyzed by Western blot.ResultsIRS-2 mRNA and protein significantly decreased in IRS-2 siRNA group compared to blank control group and negative control group(P<0.01). IRS-2 siRNA inhibited proliferation of nephroblastoma G401 cells. The number of S phase cells significantly increased in IRS-2 siRNA group compared to blank control group and negative control group(P<0.01), meanwhile the number of G2/M phase cells remarkably decreased(P<0.01). The number of early apoptotic cells and late apoptotic cells remarkably increased in IRS-2 siRNA group compared to blank control group and negative control group(P<0.01).The levels of p-Akt, CDK2 and Cyclin A2 proteins decreased in IRS-2 siRNA group compared to blank control group and negative control group(P<0.01).ConclusionIRS-2 may promote the proliferation of nephroblastoma G401 cells through activating Akt signal pathway, regulating CDK2 and Cyclin A2 expression.
IRS-2; nephroblastoma; cell proliferation; cell cycle; apoptosis; Akt signal pathway
陕西省自然科学基金资助项目(2014JM4023)
杨洁,女,1980-06生,本科,主治医师,E-mail:13991103197@163.com
2016-06-14
R737.11
A
1007-6611(2016)09-0813-05
10.13753/j.issn.1007-6611.2016.09.007

