Legumain在大肠癌中的表达及临床意义
王健君, 李晓敏, 何 雷, 周芳芳, 许增祥, 钟树志
(1皖南医学院组织学与胚胎学教研室,芜湖 241002; 2皖南医学院病理学教研室;3皖南医学院弋矶山医院病理科; *通讯作者,E-mail:lxm1980326@sina.com)
Legumain在大肠癌中的表达及临床意义
王健君, 李晓敏, 何 雷, 周芳芳, 许增祥, 钟树志
(1皖南医学院组织学与胚胎学教研室,芜湖 241002;2皖南医学院病理学教研室;3皖南医学院弋矶山医院病理科;*通讯作者,E-mail:lxm1980326@sina.com)
目的 探讨人大肠癌组织中天冬酰胺内肽酶(Legumain)的表达及其与临床病理参数的关系。 方法 制备包含69例大肠腺癌手术切除标本及癌旁组织的组织芯片,采用免疫组织化学方法检测Legumain的表达,分析Legumain表达与临床病理参数的相关性;并应用RT-qPCR检测16对大肠癌及癌旁正常组织Legumain mRNA的表达水平。 结果 Legumain在人大肠癌组织中的表达明显高于癌旁组织,差异具有统计学意义(P<0.05),Legumain高表达与肿瘤的浆膜浸润、淋巴结转移及临床分期相关(P<0.05)。 结论 Legumain人大肠癌组织中高表达,可能促进了大肠癌的侵袭及转移。
大肠癌; Legumain; 转移; 免疫组织化学
Legumain即天冬酰胺内肽酶,是溶酶体半胱氨酸蛋白酶C13家族的成员,最初在豆类植物种子中被发现并被命名为液泡加工酶[1]。在人体内,Legumain定位于14号染色体上,编码长度为433个氨基酸的蛋白,与动脉粥样硬化、脑退行性变、肝脏纤维化、抗原加工处理等病理生理过程密切相关。Liu等[2]最先发现Legumain在人多种恶性肿瘤组织中高表达,随后研究发现Legumain在人乳腺癌、横纹肌肉瘤、胃癌、前列腺癌、黑色素瘤等恶性肿瘤中也高表达,且与患者的不良预后相关[3-7]。大肠癌是消化系统最常见的恶性肿瘤之一,近年来由于生活方式和饮食习惯的改变,其发病率和死亡率逐年上升,大肠癌复发和转移是患者死亡的主要原因[8]。然而Legumain在大肠癌中的研究少见报道,因此本研究通过在蛋白和基因水平检测人大肠癌中Legumain的表达情况,分析Legumain表达与大肠癌临床病理参数的相关性,初步探讨Legumain是否参与了大肠癌的侵袭及转移过程,进一步为大肠癌的治疗提供新靶点。
1 材料和方法
1.1 制备大肠癌及癌旁正常组织的组织芯片
收集皖南医学院附属弋矶山医院大肠癌手术切除标本共69例,所有病例均为2015-01~2016-01期间由普通外科收治的大肠癌患者,患者术前均未接受放、化疗,术后病理均证实为腺癌,且无其他肿瘤性疾病。每例标本留取肿瘤组织及距肿瘤边缘大于5 cm处癌旁组织各1块,经常规石蜡包埋制成供体蜡块,经HE染色观察确定典型部位。使用北京博医康实验仪器有限公司组织芯片仪在45 mm×30 mm受体蜡块上构建48个空点阵(8×6个点,直径为1.2 mm),起始1个点空缺作为阵列位置标志,共制成3块受体蜡块。然后用点样针在供体蜡块上取标本,HE切片比对下在癌及癌旁的典型区域各取1块,同一标本癌及癌旁组织植入相邻的孔内,以保证癌和癌旁组织的反应条件一致,共制备3块8×6阵列的组织芯片。在烤箱中 60 ℃溶蜡后切片进行HE染色及免疫组织化学染色。
1.2 组织芯片免疫组织化学染色
应用SP法进行免疫组织化学染色检测Legumain的表达,DAB显色,用已知阳性大肠癌组织切片作为阳性对照,以PBS缓冲液代替一抗作为阴性对照。浓缩型兔抗人Legumain多克隆抗体购自北京博奥森生物技术有限公司;SP试剂盒、PBS缓冲液、枸橼酸盐缓冲液和DAB显色液等均购自福州迈新生物技术开发有限公司。
1.3 免疫组织化学染色结果评价
组织芯片免疫组织化学染色结果由2位高年资病理医师独立观察评价,分别从染色强度和染色比例两方面进行综合评价。染色强度分为阴性、弱染色(淡棕黄色)、中染色(棕黄色)、强染色(棕褐色);染色比例分为<25%和≥25%。染色强度为阴性或弱染色,且染色比例<25%判定为低表达,其余为高表达。
1.4 组织总RNA提取及RT-qPCR
使用RNAisoTMPlus(Takara公司)提取大肠癌及癌旁组织总RNA,使用逆转录试剂盒(Takara公司)将RNA逆转录为cDNA,使用BestarTMRealtime PCR Master Mix(SYBR Green法)(DBI公司)进行荧光定量PCR(RT-qPCR),以GAPDH作为内参,所用引物:Legumain上游引物5′-GCAGGTTCAAATGGCTGGTAT-3′,Legumain下游引物5′-GGAGTGGGA TTGTCTTCAGAGT-3′,GAPDH上游引物5′-AAGGTCGGAGTCAACGGATTTG-3′,下游引物5′-CCATGGGTGGAATCATATTGGAA-3′,引物由北京睿博兴科生物技术有限公司合成。应用ABI公司的7500定量PCR仪进行qPCR实验,程序如下,预变性95 ℃ 2 min,变性95 ℃ 15 s,退火60 ℃ 34 s,延伸72 ℃ 30 s,40个循环,所有实验均重复3次,计算每个样本的平均ΔCt,ΔCt=(CtLegumain-CtGAPDH)。
1.5 统计学分析
采用SPSS 19.0统计软件(IBM)进行统计分析。qPCR数据以ΔCt±SD表示,组间差异用双侧T检验进行统计。Legumain在大肠癌及癌旁正常组织中的免疫组织化学染色差异表达用χ2检验统计。Legumain的表达与各个临床病理参数间的相关性分析采用χ2检验或Fisher精确概率法。以P<0.05作为差异具有统计学意义。
2 结果
2.1 Legumain在大肠癌和癌旁正常黏膜中的表达
Legumain阳性染色位于细胞质内,呈弥漫性淡黄色至棕褐色颗粒状。高表达Legumain的大肠癌表现为癌细胞胞质呈棕褐色颗粒状,大部分病例的癌旁正常黏膜Legumain为阴性或弱阳性,仅少数病例癌旁正常黏膜呈强阳性,主要位于肠黏膜上皮细胞胞质内,且强阳性范围局限(见图1)。组织芯片上69例大肠癌组织中48例(69.6%)高表达Legumain,21 例(30.4%)低表达;69例相应癌旁正常黏膜中13例(18.8%)高表达Legumain,56例(81.2%)低表达,大肠癌与相应癌旁正常黏膜Legumain表达差异有统计学意义(P<0.05,见表1)。

A.组织芯片(HE染色);B.大肠癌组织Legumain表达(IHC×200);C.大肠癌组织Legumain表达(IHC×400);D.癌旁正常肠黏膜Legumain表达(IHC×200);E.癌旁正常肠黏膜Legumain表达(IHC×400)图1 大肠癌及癌旁组织芯片HE染色及Legumain免疫组织化学染色Figure 1 Legumain expression in tissue microarray(TMA) containing colorectal cancer and paired normal colorectal tissue by HE and immunohistochemical staining
表1 大肠癌及癌旁正常组织Legumain的表达差异例(%)
Table 1 The difference of Legumain expression in colorectal cancer and paired normal colorectal mucosa cases(%)
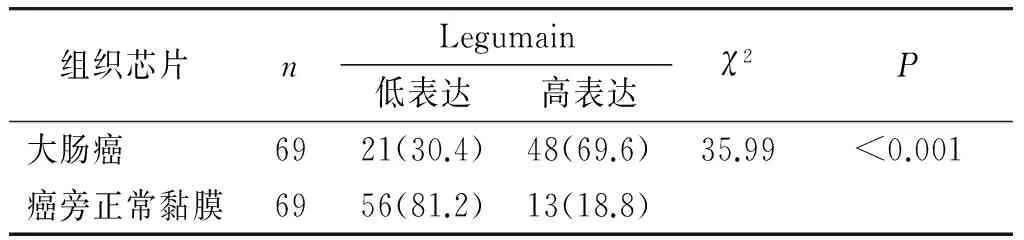
组织芯片nLegumain低表达高表达χ2P大肠癌6921(30.4)48(69.6)35.99<0.001癌旁正常黏膜6956(81.2)13(18.8)
2.2 大肠癌和癌旁正常组织Legumain mRNA的表达
应用RT-qPCR技术检测16对大肠癌及癌旁正常组织Legumain mRNA的表达,经过内参对样本Ct值进行标准化后,获得每一样本的相对ΔCt值,通过统计分析表明Legumain mRNA在大肠癌中的表达明显高于癌旁正常黏膜(P<0.000 1,见图2)。
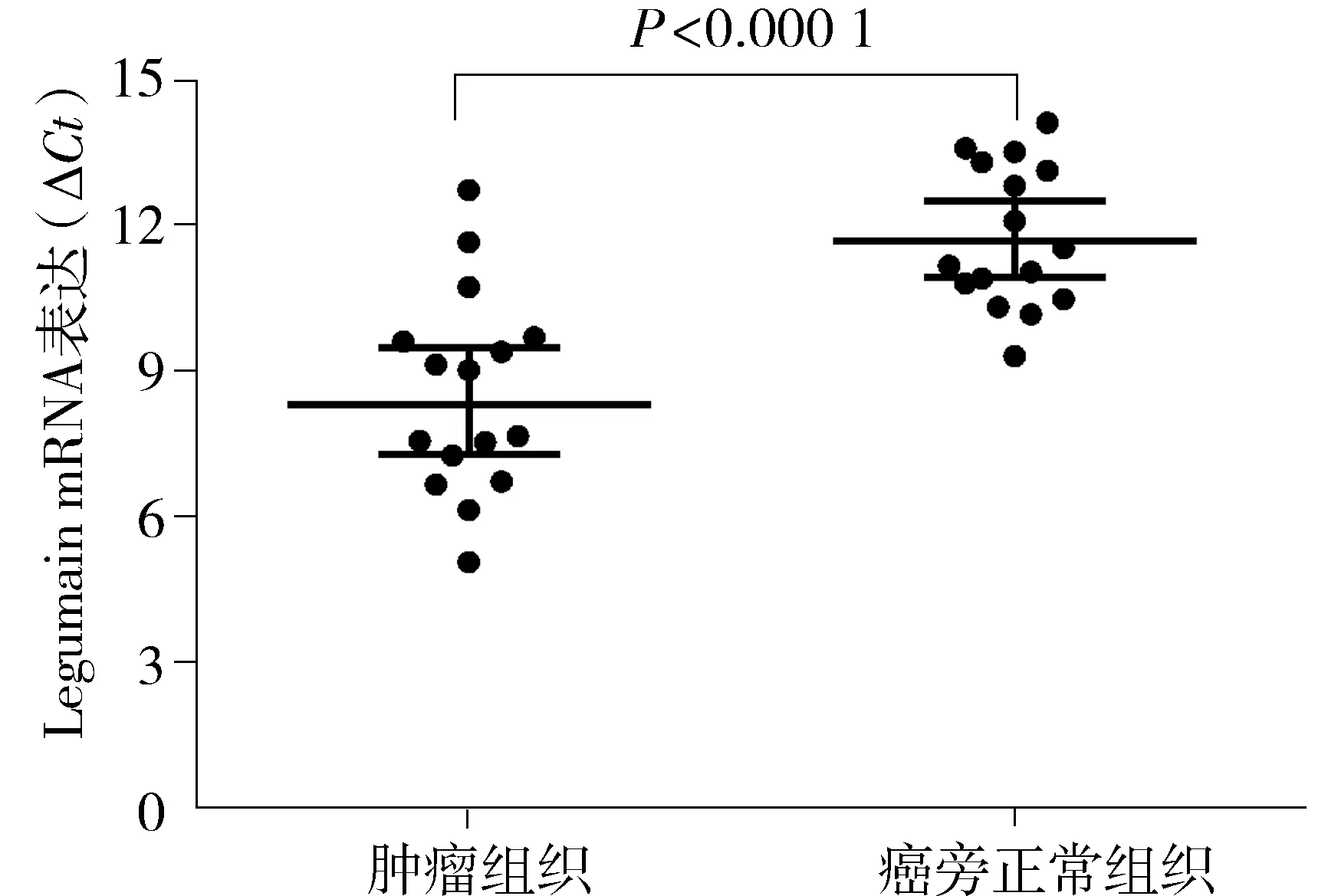
图2 大肠癌及癌旁正常组织Legumain mRNA的表达(RT-qPCR)Figure 2 Legumain expression at the mRNA level in colorectal cancer and paired normal colorectal mucosa by RT-qPCR
2.3 Legumain表达与临床病理参数的关系
大肠癌中Legumain的表达在肿瘤是否侵犯浆膜、淋巴结是否转移及不同的TNM分期之间的差异具有统计学意义(P<0.05),在不同患者性别、年龄、肿瘤大小及分化程度之间的差异均无统计学意义(P>0.05,见表2)。
3 讨论
大肠癌日益增高的发病率和死亡率逐渐引起人们重视,其死亡原因主要为大肠癌的转移和复发,肿瘤细胞从原发部位突破基底膜进入间质并侵入血管是肿瘤转移的关键步骤,肿瘤细胞可以通过分泌组织蛋白酶和基质金属蛋白酶来降解肿瘤基质促进肿瘤转移,Legumain作为半胱氨酸蛋白酶C13家族的新成员,是否参与了大肠癌的侵袭和转移过程,文献少见报道。本实验通过自制大肠癌及癌旁正常黏膜的组织芯片,通过免疫组织化学的方法检测大肠癌及癌旁组织Legumain的表达,发现相比正常组织,Legumain在大肠癌高表达(P<0.05),这与文献报道相一致[9]。
表2 大肠癌Legumain表达与各临床病理参数的相关性分析(例)
Table 2 Association between Legumain expression and clinicopathological parameters in colorectal cancers (cases)
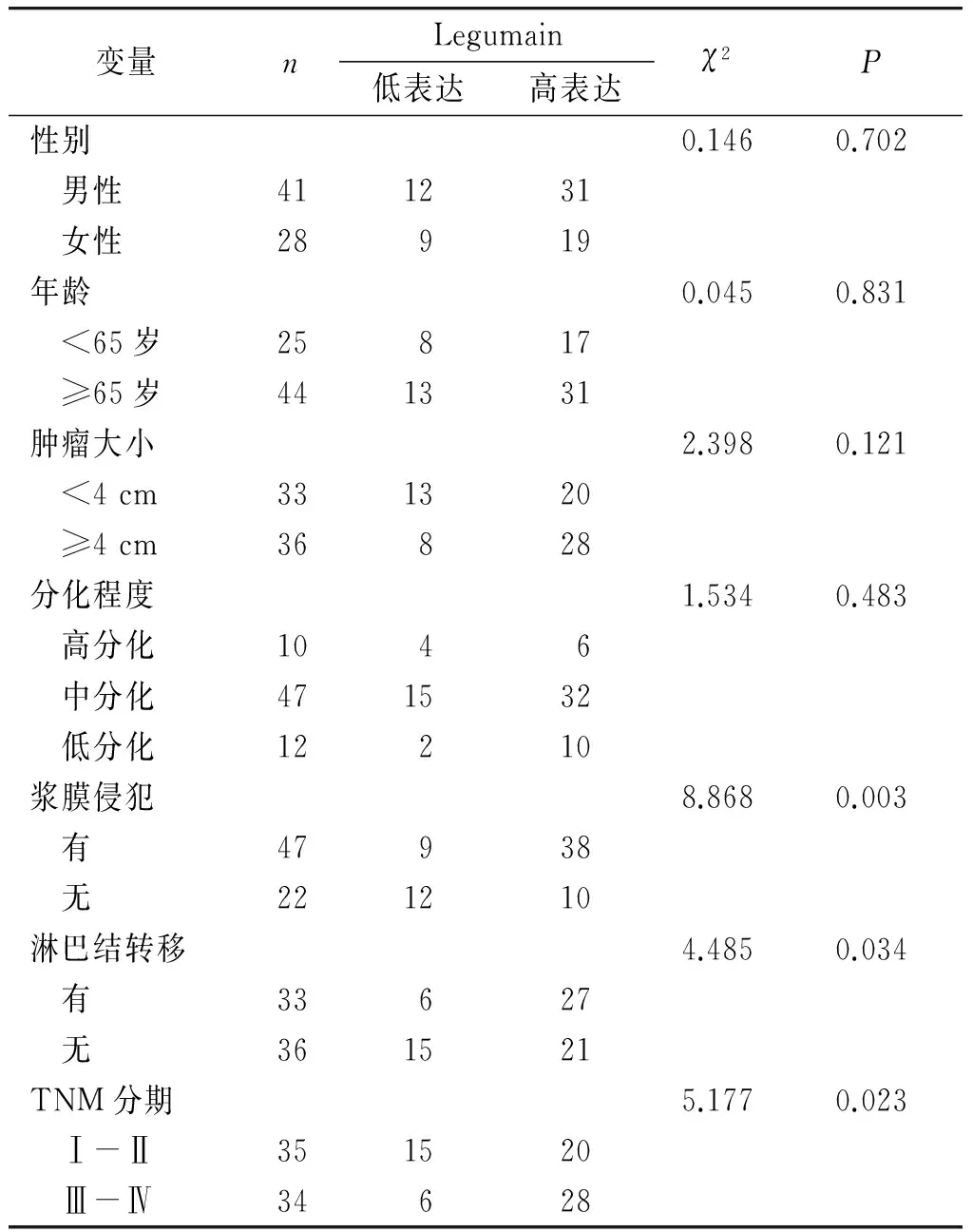
变量nLegumain低表达高表达χ2P性别0.1460.702 男性411231 女性28919年龄0.0450.831 <65岁25817 ≥65岁441331肿瘤大小2.3980.121 <4cm331320 ≥4cm36828分化程度1.5340.483 高分化1046 中分化471532 低分化12210浆膜侵犯8.8680.003 有47938 无221210淋巴结转移4.4850.034 有33627 无361521TNM分期5.1770.023 Ⅰ-Ⅱ351520 Ⅲ-Ⅳ34628
组织芯片具有高通量、经济的优点,但由于组织芯片上的标本面积较小,具有片面性的缺点,因此在免疫组化评分判定中不适合根据阳性强度和范围评分,我们前期用供体蜡块进行的免疫组化染色发现大肠癌Leguamin表达普遍高于25%,结合文献报道[10],将小于25%且染色呈淡黄色弥漫阳性的定为低表达,其余为高表达,这种免疫组化结果判定与受体蜡块免疫组化结果相一致。组织芯片上69例大肠癌标本中共有48例高表达Legumain,高表达Legumain的肿瘤细胞表现为肿瘤细胞质内出现棕黄色至棕褐色粗颗粒,有研究分别在乳腺癌[3]和前列腺癌[6]中通过免疫组化方法发现Legumain在胞质内阳性表达方式有两种:弥漫性阳性着色(diffuse cytoplasmic staining)和囊泡状阳性着色(vesicular staining pattern),且囊泡状阳性与患者的不良预后相关,此外,Haugen等[11]在结肠癌Legumain免疫组织化学染色切片上观察到约30%的标本肿瘤细胞核Legumain阳性,且核阳性与患者的不良预后相关,本实验并未观察到肿瘤细胞核呈阳性。组织芯片上69例癌旁正常组织均取自远离癌组织的远端切缘,术后证实未有癌累及,69例正常黏膜仅13例表现为阳性,但阳性部位较局限,强阳性仅表达于表面黏膜上皮细胞内。为进一步明确大肠癌Legumain的表达上调是否存在转录水平的调控,本实验通过RT-qPCR方法检测16对大肠癌与癌旁正常黏膜Legumain mRNA的相对表达差异,结果表明大肠癌mRNA明显高于癌旁组织(P<0.000 1)。
为进一步探讨Legumain在大肠癌中表达上调的临床意义,本实验分析了大肠癌Legumain表达与各临床病理参数的关系,结果表明大肠癌Legumain表达与浆膜是否侵犯、淋巴结是否转移以及不同TNM分期的肿瘤之间具有差异,差异有统计学意义(P<0.05),提示Legumain可能促进了大肠癌的侵袭和转移。在乳腺癌[12]和胃癌[5]的免疫组化研究中也同样发现Legumain表达在伴有或不伴有淋巴结转移的大肠癌之间表达具有差异,差异有统计学意义(P<0.05)。
Legumain在肿瘤组织内高表达与肿瘤组织的缺氧、局部pH降低有关,另外Yamane等[13]报道p53可以与Legumain基因结合,在转录水平上调Legumain的表达。在乳腺癌中也发现p53与Legumain的表达呈正相关[12]。但Legumain促进恶性肿瘤细胞侵袭及转移的机制目前仍不清楚,文献报道较少,目前认为有如下几种机制:①Legumain可通过水解活化组织蛋白酶和基质金属蛋白酶,降解肿瘤基质,促进肿瘤细胞的侵袭及转移。在对胃癌等的研究中也发现Legumain的表达与MMP-2、MMP-9的表达及活性呈正相关[10,14],但Legumain能否直接调控MMP-2的表达及活化仍需进一步研究。②通过与整合素结合促进肿瘤细胞与细胞外基质的黏附从而促进肿瘤的转移,有研究在迁移中的大肠癌、乳腺癌等恶性肿瘤细胞前端发现Legumain与整合素有重叠[2,12],Legumain可能通过整合素途径促进肿瘤细胞的迁移及转移。③促进肿瘤细胞增殖,Andrade等[15]在肝癌细胞中发现Legumain可以通过影响细胞周期,减少处于G2/M期细胞的比例,而促进肿瘤细胞的增殖。
综上所述,本研究证明大肠癌组织中Legumain表达在蛋白和基因水平上均明显上调,其上调表达与大肠癌的浆膜浸润、淋巴结转移和TNM分期相关,Legumain参与了大肠癌的侵袭和转移过程,可能为大肠癌的治疗提供新的思路。
[1] Kembhavi AA,Buttle DJ,Knight CG,etal.The two cysteine endopeptidases of legume seeds:purification and characterization by use of specific fluorometric assays[J].Arch Biochem Biophys,1993,303(2):208-213.
[2] Liu C,Sun CZ,Huang HN,etal.Over-expression of Legumain in tumors is significant for invasion metastasis and a candidate enzymatic target for prodrug therapy[J].Cancer Res,2003,63(11):2957-2964.
[3] Gawenda J,Traub F,Luck HJ,etal.Legumain expression as a prognostic factor in breast cancer patients[J].Breast Cancer Res Treat,2007,102(1):1-6.
[4] 李元伟.Legumain在人眼眶横纹肌肉瘤中的表达及其与肿瘤侵袭性的关系[D].天津:天津医科大学,2010.
[5] Li N,Liu QL,Su Q,etal.Effects of legumain as a potential prognostic factor on gastric cancers[J].Med Oncol,2013,30(3):621.
[6] Ohno Y,Nakashima J,Izumi M,etal.Association of legumain expression pattern with prostate cancer invasiveness and aggressiveness[J].World J Urol,2013,31(2):359-364.
[7] 吴桐.Legumain在葡萄膜黑色素瘤中的表达及其对患者预后影响的研究[D].天津:天津医科大学,2010.
[8] Terzic J,Grivennikov S,Karin E,etal.Inflammation and colon cancer[J].Gastroenterology,2010,138(6):2101-2114.
[9] Murthy RV,Arbman G,Gao J,etal.Legumain expression in relation to clinicopathologic and biological variables in colorectal cancer[J].Clin Cancer Res,2005,11(6):2293-2299.
[10] 冯倩,刘杞,向荣,等.Legumain在胃癌中的表达及其临床意义[J].第三军医大学学报,2014,36(3):232-235.
[11] Haugen MH,Boye K,Nesland JM,etal.High expression of the cysteine proteinase legumain in colorectal cancer-implications for therapeutic targeting[J].Eur J Cancer,2015,51(1):9-17.
[12] Wu M,Shao GR,Zhang FX,etal.Legumain protein as a potential predictive biomarker for Asian patients with breast carcinoma[J].Asian Pac J Cancer Prev,2014,15(24):10773-10777.
[13] Yamane T,Murao S,Katoose I,etal.Transcriptional regulation of the legumain gene by p53 in HCT116 cells[J].Biochem Biophys Res Commun,2013,438(4):613-618.
[14] 汤新跃.幽门螺杆菌感染性胃癌组织中Legumain、MMP-9的表达及其临床意义[J].现代中西医结合杂志,2015,24(12):1270-1275.
[15] Andrade V,Guerra M,Jardim C,etal.Nucleoplasmic calcium regulates cell proliferation through legumain[J].J Hepatol,2011,55(3):626-635.
Expression and clinical significance of Legumain in colorectal cancer
WANG Jianjun1,LI Xiaomin2*,HE Lei3,ZHOU Fangfang2,XU Zengxiang2, ZHONG Shuzhi1
(1DepartmentofHistologyandEmbryology,WannanMedicalCollege,Wuhu241002,China;2DepartmentofPathology,WannanMedicalCollege;3DepartmentofPathology,YijishanHospitalofWannanMedicalCollege;*Correspondingauthor,E-mail:lxm1980326@sina.com)
ObjectiveTo investigate Legumain expression and its relationship with clinicopathological parameters in colorectal cancer.MethodsExpression of Legumain was examined in tissue microarray(TMA) containing 69 samples of colorectal cancer and paired normal colorectal tissue using immunohistochemistry. The correlation between Legumain expression in colorectal tumor and clinicopathological parameters were analyzed. Additionally, the expression levels of Legumain mRNA were detected in 16 paired colorectal cancer tissues and adjacent normal counterparts by RT-qPCR.ResultsLegumain expression was significantly higher in colorectal cancer than in paired normal colorectal mucosa(P<0.05). Increased Legumain levels were significantly correlated with serosal invasion, lymph nodes metastasis and clinical stage(P<0.05).ConclusionLegumain is highly expressed in colorectal cancer, which may promote the invasion and metastasis of colorectal cancer.
colorectal cancer; Legumain; metastasis; immunohistochemistry
皖南医学院中青年自然科学基金资助项目(WK200830,WK201412)
王健君,男,1981-03生,硕士,讲师,E-mail:39001683@qq.com
2016-06-21
R735.34
A
1007-6611(2016)09-0837-04
10.13753/j.issn.1007-6611.2016.09.013

