黑木耳多糖提取的工艺研究
李凡姝,张焕丽,马 慧,崔晓彤,聂文文,李欢欢,肖志刚
(沈阳师范大学粮食学院,辽宁沈阳 110034)
黑木耳多糖提取的工艺研究
李凡姝,张焕丽,马慧,崔晓彤,聂文文,李欢欢,*肖志刚
(沈阳师范大学粮食学院,辽宁沈阳110034)
通过单因素试验研究了超声时间、超声温度、超声功率、水浴温度、水浴时间、料液比对黑木耳多糖提取率的影响,结果表明超声时间、超声温度、水浴温度、料液比对黑木耳多糖提取效果的影响相对明显,超声功率和水浴时间对黑木耳多糖提取效果的影响相对不明显。在正交试验结果上,通过极差分析、方差分析得到该试验最佳提取工艺组合。结果表明,超声波提取黑木耳多糖的最优工艺参数为水浴温度75℃,超声时间15 min,超声温度65℃,料液比1∶40;在此条件下,黑木耳多糖最佳提取率为10.622%。
黑木耳;多糖;超声波;提取
黑木耳,是我国重要食用菌之一,具有凉血、活血、益气强身等多种保健功能,是营养价值较高的食药用菌,多糖是其主要的活性成分之一[1-2]。多糖能治疗多种免疫缺损疾病,能抗肿瘤[3-4]、抗氧化[5-6]、降低胆固醇[7]、降血糖血脂、抗病毒[8]等。周国华等人[9]研究了黑木耳多糖的降血脂作用,分别用低、中、高3种不同浓度的黑木耳多糖给高血脂小鼠灌胃。结果显示,对照组小鼠的总胆固醇、血清甘油三酯、低密度脂蛋白均高于黑木耳多糖组小鼠,表明黑木耳多糖有降血脂作用。宗灿华等人[10]研究了黑木耳多糖对肿瘤的抑制作用,利用硝酸还原酶法测定小鼠血清NO含量。结果表明,黑木耳多糖的低、中、高剂量对肿瘤的抑制率分别为24.117%,32.148%,41.121%,说明黑木耳多糖含量越高,对肿瘤的抑制作用越显著。
本课题以黑龙江省海林林区优质黑木耳为原料,通过热水浸提协同超声波工艺破碎黑木耳细胞壁,使功能性成分多糖溶出透过细胞壁而分散到溶剂中。通过单因素试验测定不同提取条件对黑木耳多糖提取率的影响情况,正交试验确定黑木耳多糖最佳提取工艺参数。
1 试验方案设计
1.1原料与试剂
黑木耳,产自黑龙江省牡丹江市;葡萄糖、浓硫酸、苯酚等,均为国产分析纯。
锤式旋风磨,上海嘉定粮油仪器有限公司产品;DHG-9146A型电热鼓风干燥箱,上海精宏实验设备有限公司产品;WFZUV-2000型紫外分光光度计,尤尼柯(上海)仪器有限公司产品;格兰仕微波炉,佛山市格兰仕微波炉电器有限公司产品;布氏抽滤器,郑州长城科工贸有限公司产品。
1.2黑木耳样品预处理
黑木耳干燥(70℃,24 h)→粉碎→过筛(40目)→储存备用。
1.3黑木耳多糖提取工艺流程
取适量干木耳粉加水调配料液比→水浴浸提→微波/超声处理→真空抽滤→滤液稀释50倍→苯酚硫酸法显色→测定吸光度。
1.4多糖的测定方法
利用苯酚-硫酸法测定多糖含量,吸取2 mL稀释液,加入1 mL 6%的苯酚和5 mL浓硫酸,摇匀后放入100℃沸水中加热15 min,冷却后于490 nm波长下测定吸光度,计算黑木耳多糖化合物含量。根据回归方程得出提取液浓度C(mg/L),然后按多糖提取率公式计算出黑木耳多糖类化合物的提取率[11]。
多糖提取率=CV×1 000/m×0.9×50×100%.
式中:C——测量浓度,mg/mL;
V——提取液体积,mL;
m——原料干质量,g;
0.9——还原糖换算为多糖的系数;
50——提取液稀释倍数。
1.5标准曲线的测定方法
吸取葡萄糖标准溶液(0.1 mg/mL)0,0.2,0.4,0.6,0.8,1.0 mL各加水补至2.0 mL,然后加入质量分数为6%苯酚1 mL和浓硫酸5 mL,摇匀,静止5 min,于沸水浴中加热15 min,取出冷却至室温,于490 nm波长下以试剂空白为参比,测定吸光度。
1.6单因素试验设计
1.6.1水浴温度对黑木耳多糖提取率的影响
取1 g木耳粉6份,水浴温度分别采用50,60,70,80,90℃,水浴45 min,然后在超声功率140 W,超声温度60℃的条件下作用5 min,于490 nm下测定吸光度。
1.6.2水浴时间对黑木耳多糖提取率的影响
取1 g木耳粉6份,在水浴温度60℃,水浴时间分别为15,30,45,60,75,90 min,料液比1∶50,超声功率140 W,超声温度60℃的条件下作用5 min,于波长490 nm下测定吸光度。
1.6.3料液比对黑木耳多糖提取率的影响
取1 g木耳粉5份,以料液比1∶20,1∶30,1∶40,1∶50,1∶60比例加入蒸馏水,在60℃条件下水浴加热45 min,超声功率140 W,超声温度60℃条件下作用5 min,于波长490 nm下测定吸光度。
1.6.4超声温度对黑木耳多糖提取率的影响
取1 g木耳粉5份,料液比1∶50混合,在60℃条件下水浴加热45 min,随后在超声温度40,50,60,70,80℃,超声功率140 W的条件下作用5 min,于490 nm下测定吸光度。
1.6.5超声时间对黑木耳多糖提取率的影响
取1 g木耳粉6份,料液比1∶50混合,在60℃条件下水浴加热45 min,随后在超声温度60℃,超声功率140 W的条件下分别作用5,10,15,20,25,30 min,于波长490 nm下测定吸光度。
1.6.6超声功率对黑木耳多糖提取率的影响
取1g木耳粉6份,料液比1∶50混合,在60℃条件下水浴加热45 min,随后在超声功率分别为100,120,140,160,180 W的条件下,以超声温度60℃作用5 min,于波长490 nm下测定吸光度。
1.7正交试验设计
根据单因素试验结果选定4个主要影响因素,选取各因素的较优区域,进行四因素三水平L9(34)正交试验。
2 试验结果与讨论
2.1标准曲线
吸取葡萄糖标准溶液(0.1 mg/mL)0,0.2,0.4,0.6,0.8,1.0 mL各加水补至2.0 mL,测定吸光度。
苯酚硫酸法测定葡萄糖含量标准曲线见图1。

图1 苯酚硫酸法测定葡萄糖含量标准曲线
由图1可知,葡萄糖含量与吸光度的回归方程为Y=5.175X+0.047 5,R2=0.999 0。
2.2单因素试验
2.2.1水浴温度对黑木耳多糖提取率的影响
料液比1∶50,水浴时间45 min,超声功率140 W,超声温度60℃,超声时间5 min,分别采用水浴温度50,60,70,80,90℃提取黑木耳多糖。
水浴温度对黑木耳多糖提取率的影响见图2。

图2 水浴温度对黑木耳多糖提取率的影响
由图2可知,黑木耳多糖的提取率随水浴温度的上升而上升,当水浴温度大于80℃时提取率上升趋于平缓。这可能是因为在适宜温度范围内,黑木耳破碎后溶出的纤维素酶与果胶酶破坏了细胞壁,因而多糖溶出率上升;当温度大到一定程度时,酶失活,影响了黑木耳多糖提取率的继续上升。
2.2.2水浴时间对黑木耳多糖提取率的影响
料液比1∶50,超声功率140 W,超声温度60℃,超声时间5 min,水浴温度60℃,分别采用水浴时间15,30,45,60,75,90 min提取黑木耳多糖。
水浴时间对黑木耳多糖提取率的影响见图3。

图3 水浴时间对黑木耳多糖提取率的影响
由图3可知,随水浴时间的增加,黑木耳多糖提取率缓慢上升后下降。在75 min时提取率达到最大值,此时黑木耳多糖溶解最充分。
2.2.3料液比对黑木耳多糖提取率的影响
水浴温度60℃条件下加热45 min,超声功率140 W,超声温度60℃,超声时间5 min,分别以料液比1∶20,1∶30,1∶40,1∶50,1∶60提取黑木耳多糖。
料液比对黑木耳多糖提取率的影响见图4。

图4 料液比对黑木耳多糖提取率的影响
由图4可知,随料液比的增大黑木耳多糖提取率先上升后下降,可能是当超声波作用时,起初提取液过少液体较为黏稠不利于超声波空化作用的产生,也不利于超声波在水中的传播扩散,所以提取率相对较低,料液比增大到1∶40时超声提取效果最好。随后随溶剂体积增大,黑木耳多糖浓度降低,这可能是溶剂体积过大,减弱了超声波辐射效果,影响了反应体系的热力学作用和机械作用,降低了细胞壁的破碎程度,因此曲线呈抛物线型。
2.2.4超声温度对黑木耳多糖提取率的影响
料液比1∶50,水浴温度60℃下加热45 min,超声功率140 W,超声时间5 min,超声温度分别采用40,50,60,70,80℃提取黑木耳多糖。
超声温度对黑木耳多糖提取率的影响见图5。

图5 超声温度对黑木耳多糖提取率的影响
由图5可知,超声温度对黑木耳多糖提取率影响为先增大后减小,原因可能是在一定超声功率下,随超声温度升高,分子运动更加剧烈,加快了溶质的扩散和溶剂的渗透,有利于细胞内多糖的浸出;当超声温度过高时,酶的活性遭到破坏,所以黑木耳多糖提取率下降。
2.2.5超声时间对黑木耳多糖提取率的影响
料液比1∶50,水浴温度60℃下加热45 min,在超声温度60℃,超声功率140 W条件下分别作用5,10,15,20,25,30 min。
超声时间对黑木耳多糖提取率的影响见图6。

图6 超声时间对黑木耳多糖提取率的影响
由图6可知,黑木耳多糖提取率先缓慢上升后持续下降。在一定超声功率作用下,随超声时间的延长,细胞壁破碎程度增大,利于黑木耳多糖溶出,提高提取率;当超声时间大于10 min黑木耳多糖提取率开始下降,这可能是细胞内的淀粉糊化堵塞颗粒孔道,影响了黑木耳多糖溶出细胞壁。
2.2.6超声功率对黑木耳多糖提取率的影响
料液比1∶50,水浴温度60℃下加热45 min,超声温度60℃作用5 min,超声功率分别采用100,120,140,160,180 W提取黑木耳多糖。
超声功率对黑木耳多糖提取率的影响见图7。

图7 超声功率对黑木耳多糖提取率的影响
由图7可知,随着超声功率增大,黑木耳多糖提取率先增大后减小,这是因为超声功率不断增大,黑木耳内的分子运动加剧,细胞内水蒸气汽化产生的压力使细胞壁破坏程度加大,细胞内多糖的浸出率随之提高。但超声功率过大时,浸提出来的淀粉多糖会迅速糊化,进而堵塞黑木耳颗粒内的孔道,使细胞内剩余多糖的浸提变得相对困难。
2.3正交试验
根据单因素试验结果选定4个主要影响因素为超声时间(A)、超声温度(B)、料液比(C)、水浴温度(D)。试验过程中超声功率为140 W,水浴时间为45 min。
正交试验的因素与水平设计见表1,正交试验结果见表2。

表1 正交试验的因素与水平设计

表2 正交试验结果
通过极差分析可看出C>B>A>D,所以对黑木耳多糖提取影响的主次顺序为料液比>超声温度>超声时间>水浴温度,即料液比的影响最大,水浴温度影响最小,从正交试验中可以得到最佳工艺组合为A3B3C2D1,提取率为10.622%;由极差分析得到的最佳工艺组合为A1B3C2D1。因素D的极差最小,所以将此作为方差列进行方差分析。
黑木耳多糖提取率的方差分析结果见表3。
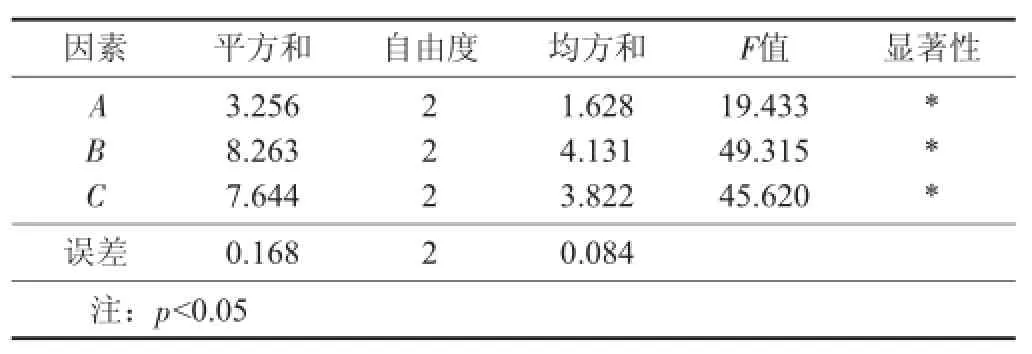
表3 黑木耳多糖提取率的方差分析结果
由方差分析可知,超声温度、料液比和超声时间对黑木耳多糖提取率的影响均达到显著水平(p< 0.05)。由F值可知,各因素对黑木耳多糖提取率的影响显著顺序为超声温度>料液比>超声时间,水浴温度为最不显著因素。
2.4验证试验
对直观分析得到的2组最佳工艺组合A3B3C2D1和A1B3C2D1分别进行黑木耳多糖提取率的测定。
验证试验见表4。

表4 验证试验
由表4可知,工艺组合A3B3C2D1的提取率高于A1B3C2D1,所以该试验的最佳工艺条件为A3B3C2D1。
3 结论
试验研究了黑木耳多糖提取的最佳工艺,单因素试验中分别研究了超声温度、超声时间、超声功率、水浴温度、水浴时间、料液比对黑木耳多糖提取率的影响。结果表明,超声时间、超声温度、料液比、水浴温度对黑木耳多糖提取率影响较大,而超声功率和水浴时间对多糖提取率影响不大。由正交试验结果可知,最佳工艺组合为A3B3C2D1;由极差分析可知,最佳工艺组合为A1B3C2D1;由方差分析可知,各因素对黑木耳多糖提取率影响的主次顺序依次为料液比>超声温度>超声时间>水浴温度;超声温度>料液比>超声时间,其都为显著性因素,水浴温度为最不显著因素。通过验证试验确定了最佳工艺组合为A3B3C2D1,即超声时间15 min,超声温度65℃,水浴温度75℃,料液比1∶40,最大提取率为10.622%。
[1]朱雪琼.黑木耳多糖的提取、功能及单糖组成的研究[D].南宁:广西大学,2014.
[2]韩春然,徐丽萍.黑木耳多糖的提取、纯化及降血脂作用的研究 [C].//东西方食品业高层论坛论文汇编.北[3]Jie Y,Sun R,Zhao Z,et al.Auricularia polytricha,polysaccharides induce cell cycle arrest and apoptosis in human lung cancer A549 cells[J].International Journal of Biological Macromolecules,2014,68(7):67-71.
京:中国食品科学技术学会,2007:54-58.
[4]Song G,Du Q.Structure characterization and antitumor activity of an α β-glucan polysaccharide from Auricularia polytricha[J].Food Research International,2012,45(1):381-387.
[5]Zhang H,Wang Z Y,Zhang Z,et al.Purified Auricularia auricular judae polysaccharide(AAP I-α) prevents oxidative stress in an ageing mouse model[J].Carbohydrate Polymers,2011,84(1):638-648.
[6]Sun Y X,Liu J C,Kennedy J F.Purification,composition analysis and antioxidant activity of different polysaccharide conjugates(APPs) from the fruiting bodies of Auricularia polytricha[J].Carbohydrate Polymers,2010,82(2):299-304.
[7]Shuang Z,Rong C,Yu L,et al.Extraction of a soluble polysaccharide from Auricularia polytricha,and evaluation of its anti-hypercholesterolemic effect in rats[J].Carbohydrate Polymers,2015,122(3):39-45.
[8]Nguyen T L,Chen J,Hu Y,et al.In vitro antiviral activity of sulfated Auricularia auricula,polysaccharides[J]. Carbohydrate Polymers,2012,90(3):1 254-1 258.
[9]周国华,于国萍.黑木耳多糖降血脂作用的研究 [J].现代食品科技,2005,21(1):46-48.
[10]宗灿华,于国萍.黑木耳多糖抑制肿瘤作用的研究 [J].中国医疗前沿,2007(12):5-7.
[11]李公斌.黑木耳多糖分子修饰及功能与应用研究 [D].哈尔滨:东北林业大学,2006.◇
Study of Auricularia auricula Polysaccharide Extraction Technology
LI Fanshu,ZHANG Huanli,MA Hui,CUI Xiaotong,NIE Wenwen,LI Huanhuan,*XIAO Zhigang
(College of Grain Science and Technology,Shenyang Normal University,Shenyang,Liaoning 110034,China)
Through the single factor experiments of ultrasonic time,ultrasonic temperature,ultrasonic power meter,water bath temperature,bath time,ratio of material to liquid on the Auricularia auricula polysaccharide extraction are studied.The results show that the effects of ultrasonic time,ultrasonic,temperature,water bath temperature,solid to liquid ratio on the extraction effect of Auricularia auricula polysaccharide is relatively obvious,ultrasonic power and water bath time on the effect of Auricularia auricula polysaccharide extraction effect is not obvious.The results show that the optimum process parameters of ultrasonic extraction of Auricularia auricula polysaccharides the temperature is 75℃,ultrasonic time 15 min,ultrasonic temperature of 65℃,ratio of solid to liquid 1∶40.In the condition of Auricularia auricula polysaccharides,extraction rate is 10.622%.
Auricularia auricula;polysaccharide;ultrasonic;extraction
TS201
Adoi:10.16693/j.cnki.1671-9646(X).2016.09.034
2016-07-25
辽宁省“百千万人才工程”资助项目(2013921038);沈阳市科技创新专项资金(F14-104-3-00);辽宁省高等学校优秀科技人才支持计划(第一层次)资助专项(LR2015062)。
李凡姝(1991— ),女,在读硕士,研究方向为生物化工。
肖志刚(1972— ),男,博士,教授,研究方向为粮食油脂及植物蛋白工程。

