不同厂家双氯芬酸钠缓释胶囊释放曲线比较研究
安佰平,柴龙龙,柳玉英
(1.山东省淄博市食品药品检验检测中心,山东淄博250086;2.山东理工大学,山东淄博250049)
不同厂家双氯芬酸钠缓释胶囊释放曲线比较研究
安佰平1,2,柴龙龙1,柳玉英2
(1.山东省淄博市食品药品检验检测中心,山东淄博250086;2.山东理工大学,山东淄博250049)
目的比较国内主要生产厂家生产的双氯芬酸钠缓释胶囊样品在4种溶剂中的释放曲线,为科学评价药品质量提供依据。方法分别以水、0.1 moL/L盐酸溶液、pH=5.0磷酸盐缓冲溶液、pH=6.8磷酸盐缓冲溶液各900 mL为释放介质,采用转篮法,转速为100 r/min,高效液相色谱法于276 nm波长处测定释放度及释放曲线,通过相似因子法评价溶出曲线的相似性。结果采用相似因子法评价,各厂家受试制剂之间释放曲线差异较大。结论相似因子评价法能够有效反映和控制产品的内在质量,指导厂家改进生产工艺,提高产品质量并为用药者选购药物提供参考。
双氯芬酸钠缓释胶囊;释放度;释放曲线;相似因子
溶出度试验是评价口服固体制剂内在质量的一种科学手段和方法。对于不同厂家的同一剂型固体制剂,溶出度可以揭示各制剂工艺的差别和内在品质的优劣,也可初步为判断体内生物利用度的高低、是否生物等效提供参考[1]。溶出曲线的测定已成为评价固体制剂内在质量的一种手段与方法[2-3],因此溶出度试验数据的准确测定和溶出曲线相似性的科学评价越来越受到药物制剂和药物分析工作研究的关注[4]。
双氯芬酸钠是第3代强效的非甾体类消炎镇痛药物。具有疗效好、不良反应轻微等特点,但因其口服普通片剂在胃内可迅速释放,导致局部药物浓度过高,对胃黏膜的刺激性很大,同时还会因血药浓度过高引起一系列不良反应[5]。其口服吸收迅速,生物半衰期较短,常需日服多次才能维持药效[6],所以临床多为肠溶片、缓释片或缓释胶囊等剂型。国内有7家药厂生产双氯芬酸钠缓释胶囊,释放度检查执行国家药品标准[7-8]。笔者采用2010年版《中国药典(二部)》、国家药品标准和《日本橙皮书》的释放条件对已上市双氯芬酸钠缓释胶囊进行释放曲线测定和对比,考察6批样品在4种不同释放介质中释放曲线的一致性。现报道如下。
1 仪器与试药
1.1仪器
RCZ-8M型溶出试验仪,RZQ-8C型溶出仪自动取样器(天津天大天发科技有限公司);CP225D型电子天平(德国赛多利斯公司);20AT型高效液相色谱仪(日本岛津公司)。
1.2试药
双氯芬酸钠对照品(中国药品生物制品检定所,批号为100334-200302);不同厂家双氯芬酸钠缓释胶囊共6批[参比制剂,A厂,批号为1402191;受试制剂,B厂(批号为11-140125),C厂(1批,批号为131001),D厂(批号为1404105),E厂(批号为1402214),F厂(批号为3121312001)];甲醇为色谱纯,冰醋酸、磷酸二氢钾、氢氧化钠均为分析纯。
2 方法与结果
2.1色谱条件[7]
色谱柱:Agilent ZORBAX SB-C18柱(150 mm× 4.6 mm,5 μm)八烷基键合硅胶为填充剂;流动相:甲醇-4%冰醋酸(70∶30);流速:1 mL/min;柱温:40℃;检测波长:276 nm。
2.2标准曲线制备
0.1moL/L盐酸溶液:精密移取双氯芬酸钠对照品贮备液(精密称取双氯芬酸钠对照品约25 mg,置100 mL容量瓶中,用70%甲醇溶解并定容至刻度,摇匀,即得,250 μL,500 μL,1 mL,5 mL,20 mL,置100 mL容量瓶中,用0.1 moL/L盐酸溶液稀释定容至刻度,分别进样分析,以峰面积(Y)对质量浓度(X)进行线性回归处理,得Y=44 877X-47.856,r=0.999 9(n=5)。结果表明,双氯芬酸钠质量浓度在0.625~25 μg/mL范围内与峰面积呈良好线性关系。
其他3种释放介质:精密移取上述双氯芬酸钠对照品贮备液1.0,1.0,5.0,5.0,5.0,5.0 mL,分别置200,100,100,25,10 mL容量瓶中,用水、pH=5.0磷酸盐缓冲溶液、pH=6.8磷酸盐缓冲液3种溶出介质稀释定容至刻度,分别进样分析,以峰面积(Y)对质量浓度(X)进行线性回归处理。得回归方程,水中,Y=45 693 X+ 4 614.4,r=1.000 0(n=6);pH=5.0磷酸盐缓冲溶液中,Y=45 763X+5 678.6,r=0.999 9(n=6);pH= 6.8磷酸盐缓冲溶液中,Y=45 824X+1 453.3,r= 0.999 9(n=6)。结果表明,双氯芬酸钠在3种溶出介质中与峰面积线性关系良好,双氯芬酸钠检测质量浓度线性范围均为1.25~125 μg/mL。
2.3释放曲线测定
溶出度测定采用2010年版《中国药典(二部)》附录转篮法,转速100 r/min,温度37℃。取本品6粒,分别置于6个溶出杯中,在上述时间点取溶液滤过,作为供试品溶液。同时,补充37℃各pH下相应的溶出介质。分别精密量取供试品溶液10 μL,注入高效液相色谱仪,记录色谱图,按标准曲线法以峰面积计算各时间点溶出量。
2.4不同溶剂中的释放情况
0.1moL/L的盐酸溶液:由于双氯芬酸钠在0.1 moL/L的盐酸溶液中降解严重,且考虑到缓释制剂在胃液中2 h排空,所以未进行多点测定释放曲线,仅在2 h时取样,计算1点释放量。6个企业6批样品在0.1 moL/L的盐酸溶液中释放量均低于10%[9]。结果见表1。

表10 .1 moL/L盐酸溶液中样品2 h释放量测定结果(X±s,%)
水、pH=5.0磷酸盐缓冲溶液、pH=6.8磷酸盐缓冲溶液:不同厂家生产的双氯芬酸钠缓释胶囊释放曲线见图1。

图1 不同溶剂中的释放曲线
2.53种释放介质中的f2因子比较
采用美国食品药物管理局(FDA)发布的《口服固体制剂溶出度试验技术指导原则》中推荐使用的相似因子(f2)法,比较参比制剂和国内其他厂家制剂的溶出行为。按下列公式计算相似因子(f2),f2大于等于50时,认为受试试剂与参比试剂溶出过程一致。各试剂与参比制剂双氯芬酸钠缓释胶囊释放曲线的f2比较,当50≤f2≤100,2种制剂的溶出曲线相似,f2越趋于100,曲线相似性越好。结果见表2。
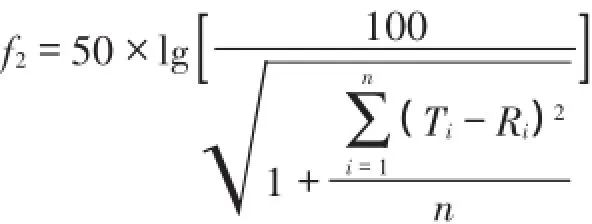

表2 不同企业样品释放曲线与参比制剂释放曲线相似性比较
3 讨论
3.1研究价值
药物的体外溶出度在某种意义上与体内生物利用度呈一定的相关性,从体外溶出数据可估计其药动学和生物利用度的特性[10]。因此,溶出曲线的研究得到了广泛的关注[11-15]。其分析数据能切实体现制剂在患者体内的溶出情况以及血药浓度,从而间接反映出其生物利用度和治疗效果[16]。
3.2释放介质选择
分别以水、0.1 moL/L的盐酸溶液、pH=5.0磷酸盐缓冲溶液(取0.2 mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH至5.0,即得)、pH=6.8磷酸盐缓冲溶液(取0.2 mol/L磷酸二氢钾溶液250 mL,加0.2 mol/L氢氧化钠溶液118 mL,用水稀释至1 000 mL,即得)[9]为释放介质。释放介质的选择参照《日本橙皮书》中双氯芬酸钠缓释胶囊的溶出试验方法项,释放介质的配制及溶出方法则按照2010年版《中国药典(二部)》附录及国家药品标准[7],选择4种释放介质作为测定介质,并在此基础上进行释放曲线比较。考虑到与含量测定其他考察项目等测定方法的一致性,且避免辅料的干扰,更能减少稀释样品带来的繁重工作,故同时参照后者双氯芬酸钠缓释胶囊的含量测定色谱条件对释放曲线进行测定,并对该方法进行了方法学研究。
3.3取样时间点选择
由于双氯芬酸钠在0.1 moL/L的盐酸溶液中降解严重,且考虑到缓释制剂在胃液中排空时间为2 h,所以未进行多点测定释放曲线,仅在2 h时取样,计算1点释放量。其他3种释放介质取样时间设为0.5,1,2,3,4,5,6,8,10,12,14 h时。
3.4参比制剂选择
因原研厂家诺华制药有限公司仅有双氯芬酸钠缓释片和肠溶片在中国上市,尚无缓释胶囊,所以选择在中国最早上市双氯芬酸钠缓释胶囊的A厂家产品作为参比制剂。由图1及表2可见,以pH=6.8磷酸盐缓冲液为释放介质各企业样品释放曲线均与参比制剂相似,以水为释放介质时释放曲线差异较大,仅有两家企业与参比制剂一致。可能的原因是,以水为释放介质时,释放介质的pH易受胶囊中的辅料和主药释放速度的影响,导致不同厂家产品的释放曲线不同;而以pH=6.8磷酸盐缓冲液为释放介质时,则pH不受影响。
3.5努力方向
从不同企业来看,仅有B厂的3条释放曲线均与参比制剂相似,其他均只有2条释放曲线相似。释放度试验相似度比较结果提示,各企业产品的内在品质尚存在较大差距,生产企业需深入研究原料药辅料及胶囊壳的质量和工艺流程,提高产品质量的均一性和稳定性。
[1]杨晓菊,谢沐风.不同厂家格列美脉片溶出度的比较[J].中国医药工业杂志,2008,39(10):758-761.
[2]谢沐风,张启明,陈洁,等.国外药政部门采用溶出曲线评价口服固体制剂内在品质的情况简介[J].中国药事,2008,22(3):257-261.
[3]谢沐风.简介日本“药品品质再评价”工程(溶出度研究系列一)[J].中国药品标准杂志,2005,6(6):42-46.
[4]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-311.
[5]金奕,程宗琦.双氯芬酸钠片剂与胶囊剂的体外溶出度分析[J].苏州大学学报(医学版),2006,26(6):1 101-1 102.
[6]林宁,肖学成,饶泽萍,等.双氯芬酸钠缓释胶囊的制备及其释药特性研究[J].华西药学杂志,2002,17(2):118-119.[7]WS1-(X-002)-2002Z-2011,国家药品标准[S].
[8]YBH01852010,国家药品标准[S].
[9]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:76.
[10]傅蓉,马明欣,潘强,等.国产卡托普利片溶出度对比分析[J].中国药师,2012,15(7):954-956.
[11]朱强,邓蓝进,陈永建,等.盐酸多奈哌齐口崩片的溶出曲线相似性研究[J].中南药学,2015,13(5):487-489.
[12]陈加飞,王平,赵昕,等.国产与原研洛索洛芬钠片的体外溶出曲线一致性的比较[J].国际检验医学杂志,2015,36(2):198-199.
[13]李国琼,肖文礼,杨贵方,等.厄贝沙坦氨氯地平片溶出度评价[J].西北药学杂志,2015,30(3):275-278.
[14]袁春平,黄后楷,张文芳,等.自研硝苯地平缓释片(I)与原研制剂体外释放度一致性评价[J].药物分析杂志,2013,33(8):1 416-1 423.
[15]陈芳晓,孙志,赖庆宽.不同厂家奥美拉唑肠溶制剂在不同溶出介质中的溶出曲线比较研究[J].中国药业,2014,23(4):33-34.
[16]田洁,郝爱鱼,赵丽元,等.不同厂家双嘧达莫片的溶出曲线比较研究[J].中国药物评价,2015,32(2):79-82.
Comparative Studies on Dissolution Profiles of Diclofenac Sodium Sustained Release Capsules from Different Pharmaceutical Manufacturers
An Baiping1,2,Chai Longlong1,Liu Yuying2
(1.Zibo Institute for Drug Control,Zibo,Shandong,China255086;2.Shandong University of Technology,Zibo,Shandong,China255086)
ObjectiveTo compare the similarity of dissolution curves of Diclofenac Sodium Sustained Release Capsules from major domestic drug enterprises in 4 solvents,and provide the basis for a comprehensive evaluation of the quality of Diclofenac Sodium Sustained Release Capsules.MethodsWater,0.1 moL/L hydrochloric acid solution,pH 5.0 phosphate buffer,pH 6.8 phosphate buffer 900 mL were used respectively as stripping media.The rotation speed was 100 r/min,and HPLC determination at 276 nm.The similarity of Dissolution curve was evaluated byf2similarity factor method.ResultsSimilarity factor was evaluated,the disslution curves of the same batch of test preparation exhibited obvious differences.ConclusionThe similarity factor evaluation method can effectively reflect and control the intrinsic quality of the product,instruct manufacturers to improve production processes and product quality.
Diclofenac Sodium Sustained Release Capsules;dissolution;dissolution curve;f2similarity factor
R927.11;R971+.1
A
1006-4931(2016)13-0034-03
安佰平(1983-),女,大学本科,主管药师,研究方向为药物分析;柳玉英(1964-),女,硕士研究生,教授,研究方向为药物分析,本文通讯作者,(电话)0533-7866116。
2016-02-06;
2016-03-18)

