纳米微囊介导的碱性成纤维细胞生长因子联合低氧诱导因子-1提高随意型皮瓣缺氧耐受的实验研究
王之学,肖继州,赵振霞,于强
(聊城市第二人民医院烧伤科,山东 聊城 252600)
纳米微囊介导的碱性成纤维细胞生长因子联合低氧诱导因子-1提高随意型皮瓣缺氧耐受的实验研究
王之学,肖继州,赵振霞,于强
(聊城市第二人民医院烧伤科,山东 聊城252600)
目的探讨以纳米微囊为载介导的碱性成纤维细胞生长因子(bFGF)联合低氧诱导因子-1(HIF-1)对大鼠随意性皮瓣缺氧耐受的作用。方法SD大鼠40只,背部设计6 cm×2 cm的随意性皮瓣。采用随机方法分为4组:A组为联合应用含bFGF和HIF-1的试验组;B组为单纯应用bFGF的基因对照组1;C组为单纯应用HIF-1的基因对照组2;D组为应用生理盐水的空白对照组。采用皮瓣下注射的方式,术后测量皮瓣成活面积,病理切片HE染色,皮瓣组织的bFGF和HIF-1免疫组化检测及皮瓣下毛细血管的数目密度统计。结果纳米微囊介导的试验组与其他对照组相比,皮瓣成活率更高,目的蛋白表达和皮瓣新生血管密度计数与对照组差异有统计学意义(P<0.05)。结论以纳米微囊为载体,联合应用bFGF和HIF-1的基因治疗能促进皮瓣血管的增生,显著提高大鼠随意性皮瓣的缺氧耐受,增加其成活率。
外科皮瓣;纳米囊;成纤维细胞生长因子;芳香烃受体核转位子;新生血管化,生理性;大鼠
皮瓣存活是保证皮瓣移植手术成功与否的最重要因素,其中皮瓣术后缺血性坏死是困扰外科学的一个难题。近年来,研究表明碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)及低氧诱导因子1(hypoxia-inducible factor,HIF-1)可直接或间接的促进血管的形成[1],提高皮瓣远端缺血部分的成活率。已有学者将碱性成纤维细胞生长因子成功的运用于皮瓣成活的研究中,结果表明碱性成纤维细胞生长因子能显著的促进新生血管的形成[2-3]。低氧诱导因子1是在机体缺血状态下表达的一类蛋白质,通过调控其他生长因子的表达来促进血管的再生,对缺血性皮瓣的存活具有重要的作用。师永红等[4]报道碱性成纤维细胞生长因子可通过信号通路PI3K/Akt和MEK1/ERK活化低氧诱导因子,增强其转录活性从而促进新血管的生成。碱性成纤维细胞生长因子和低氧诱导因子在新血管的生成中有着密切的关系。由于bFGF和HIF-1在体内易被蛋白酶分解,半衰期短,局部使用时不能发挥其生物学效应,而采用微囊系统可将控制其局部释放的问题。故本实验将碱性成纤维细胞生长因子和低氧诱导因子有机的结合在一起,以壳聚糖纳米微囊为载体观察提高大鼠随意型皮瓣缺氧耐受的情况。
1 材料与方法
1.1材料与设备Bio-RADModel酶标分析仪(美国),S-2700扫描电镜(日本),FJ-2300型计数仪,HJ-4磁力搅拌器,TH2-82型恒温振荡仪,真空干燥箱(上海),Span-80为Sigma公司分析纯,壳聚糖为Sigma公司,pTagRFP-Cl-Hu-bFGF和pEGFP-N2-Hu-HIF-1购自重庆碧基生物科技有限公司,ABC免疫组化试剂盒购组武汉博士德生物制品公司,鼠抗人碱性成纤维细胞生长因子及鼠抗人低氧诱导因子1购自武汉博士德生物制品公司,内参物甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)购自康成生物工程有限公司,分子量为146 kDa。其他试剂如无水乙醚、异丙醇、丙酮、戊二醇等均为国药分析纯,实验用水为超纯水。健康的SD大鼠40只(由济南市金丰实验动物繁育有限公司提供,SCXK(鲁)2014-0006),体重200~250 g,雌雄不限,随机分为A组为联合应用bFGF和HIF-1纳米微囊的实验组,B组为应用bFGF纳米微囊的对照组1,C组为应用HIF-1纳米微囊的对照组2,D组为应用生理盐水的空白对照组。
1.2纳米微囊的制备及鉴定
1.2.1bFGF和HIF-1双基因纳米微囊的制备
根据文献提供的方法制备壳聚糖纳米微囊[5]。称取50 mg壳聚糖,加入360 μL乙酸,加超纯水至2.5 mL,置37℃恒温箱内过夜,再加超纯水至245 mL,调节pH至5.5,加超纯水定容至250 mL容量瓶中,过滤除菌得壳聚糖溶液,浓度为0.2 g·L-1;各取pTagRFP-Cl-Hu-bFGF和pEGFP-N2-Hu-HIF-1 10 mg,溶解于100 mL 5 mmol·L-1的硫酸钠溶液中,配制成0.2 g·L-1的质粒溶液;将质粒溶液和壳聚糖溶液分别置于水浴上于55 ℃加热15 min,将两种溶液等体积混合,3 000 r·min-1速搅拌1 min,即得浓度为100 μg·L-1的双基因壳聚糖纳米微囊溶液,于4 ℃保存,备用。将制备好的纳米微囊直接放于原子力显微镜(SPI3800N)下观察见壳聚糖纳米微囊呈不规则球形,结构紧密,粒径约为100~200 nm,大小较均匀。再将纳米微囊用硫酸钠溶液(浓度为30 mmol·L-1)按1∶15稀释,取稀释液5 μL置云母片上,用氮气吹干,于原子力显微镜下观察纳米形态并测量直径。
1.2.2bFGF纳米微囊的制备
称取50 mg壳聚糖,加入360 μL乙酸,加超纯水至2.5 mL,置37 ℃恒温箱内过夜,再加超纯水至245 mL,调节pH至5.5,加超纯水定容至250 mL容量瓶中,过滤除菌得壳聚糖溶液,浓度为0.2 g·L-1;称取pTagRFP-Cl-Hu-bFGF 10 mg,溶解于100 mL 5 mmol·L-1的硫酸钠溶液中,配制成0.2 g·L-1的质粒溶液;将质粒溶液和壳聚糖溶液分别置于水浴上于55 ℃加热15 min,将两种溶液等体积混合,3 000 r·min-1速搅拌1 min,即得浓度为100 μg·L-1的双基因壳聚糖纳米微囊溶液,于4 ℃保存,备用。
1.2.3HIF-1纳米微囊的制备
称取50 mg壳聚糖,加入360 μL乙酸,加超纯水至2.5 mL,置37 ℃恒温箱内过夜,再加超纯水至245 mL,调节pH至5.5,加超纯水定容至250 mL容量瓶中,过滤除菌得壳聚糖溶液,浓度为0.2 g·L-1;取pEGFP-N2-Hu-HIF-1 10 mg,溶解于100 mL 55 mmol·L-1的硫酸钠溶液中,配制成0.2 g·L-1的质粒溶液;将质粒溶液和壳聚糖溶液分别置于水浴上于55 ℃加热15 min,将两种溶液等体积混合,3 000转速搅拌1 min,即得浓度为100 μg·L-1的双基因壳聚糖纳米微囊溶液,于4 ℃保存,备用。
1.3动物模型的制备及观察指标
1.3.1动物模型的制备
术前大鼠背部用8%硫化钠溶液脱毛处理,温水洗净。戊巴比妥钠按30 g·L-1腹腔注射麻醉大鼠,麻醉平稳后,将其放于手术平台上,四肢固定,取俯卧位,聚维酮碘溶液消毒,铺巾。于鼠背正中设计6 cm×2 cm的随意皮瓣(含脂膜肌层),纵轴与脊柱平行,在分别距离蒂部2、4 cm 处,做与蒂部平行的两条直线,此直线分别与皮瓣的边缘相交于四点,以此四点作为注射位点。A组皮瓣下每个注射位点注射100 μg·L-1的bFGF和HIF-1双基因纳米微囊(含bFGF和HIF-1),B组注射100 μg·L-1的bFGF纳米微囊(含bFGF),C组注射100 μg·L-1的HIF-1纳米微囊(含HIF-1),D组注射生理盐水1 mL。用3-0丝线原位间断缝合,切口边缘涂红霉素药膏。所有伤口均隔日换药,肌肉注射青霉素20万单位,1次/d,连续3 d。单笼喂养。
1.3.2大体外观察
在术后7 d内对大鼠皮瓣进行观察,主要观察3个部位,分别距离蒂部4~6 cm(远端),2~4 cm(中端),0~2 cm(蒂部)。分别从皮瓣的质地、颜色、组织弹性及毛发生长情况进行观察。皮瓣坏死的判断标准为:颜色变黑、质地坚硬、组织回缩及弹性差、无毛细管反应。
1.3.3皮瓣存活率的检测
皮瓣手术7 d后,存活区与坏死区已经很明显。首先用透明纸准确描绘各组皮瓣的形态,坏死区域用记号笔标记,对其进行照相,利用图像分析软件计算坏死面积与存活面积。计算公式为:皮瓣存活率=皮瓣存活面积/皮瓣总面积×100%。
1.3.4组织学检测
术后7 d将大鼠处死,取皮瓣组织(含筋膜层),用10%的福尔马林溶液固定,石蜡包埋,冰冻切片,HE染色,在光镜下观察肉芽组织层厚度,坏死、组织水肿及炎症细胞浸润等情况,并进行新生毛细管和成纤维细胞计数。
1.3.5免疫印迹检测
术后取存活皮瓣组织(0.5 cm×0.5 cm),加细胞裂解液,蛋白酶抑制剂,电泳分离,转膜,免疫杂交和显色后观察细胞内目的基因的表达情况。以恒定含量的GAPDH作为内参照物,标定各实验组蛋白表达情况。
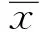
2 结果
2.1大体观察实验所用所有大鼠均存活至实验结束。术后2~3 d,所有组的皮瓣全部存活,远端皮瓣经毛细管充盈实验呈现阳性,边缘组织有少量渗血;4~5 d时,所有组大鼠随意皮瓣的远端色泽均有变暗,推测可能出现组织坏死。实验组皮瓣远端色泽较所有对照组颜色浅;实验组及对照组1中大鼠皮瓣的中段肤色正常及毛细血管充盈实验呈阳性,对照组2与实验组及对照组1有轻微差异,空白对照组中段皮瓣颜色及充盈实验结果与其他组有差异,且个别部位出现青紫。6~7 d时,所有组大鼠远端皮瓣的颜色均有加深、变暗;实验组中段及近端的皮瓣都存活,且肤色正常,毛细管充盈实验显阳性,对照组1中皮瓣颜色较实验组颜色稍深,中段及近端的毛细管充盈实验均显示阳性,对照组2中皮瓣中段颜色较对照组1更深,毛细管充盈实验显示弱阳性,空白对照组远端皮瓣有轻度肿胀,皮纹变浅,中段也较其他组颜色深,毛细管充盈实验显若阴性,近端皮瓣存活良好。
2.2皮瓣存活按照1.3.3项中检测皮瓣存活率的方法检测,利用S-2700扫描电镜计算各组小鼠坏死面积和存活面积,计算皮瓣存活率。汇总四组大鼠皮瓣成活率结果:A组为(85.663±2.34)%,B组为(69.113±3.55)%,C组为(63.224±2.78) %,D组为(42.886±3.01) %。经过SPSS统计软件计算得出,组间秩和检验的P=0.006,说明四组间皮瓣存活率差异有统计学意义。实验组与各对照组的两两比较结果显示:A组与B组组间比较P=0.004,差异有统计学意义,即可以认为A组的皮瓣存活率优于B组;A组与C组间比较P=0.009,差异有统计学意义,即可以认为A组的皮瓣存活率优于C组;A组与D组间比较P=0.000,差异有统计学意义,即可以认为A组的皮瓣存活率优于D组。
2.3组织学观察及新生血管计数A组近端皮瓣下无明显炎性浸润,无组织水肿,皮下纤维增生明显;中段皮瓣下有轻度水肿,皮下纤维组织有增生,炎性细胞有部分浸润;远端皮下有明显水肿,皮下纤维增生明显,有大量炎性细胞浸润。B、C组组织学差异不明显,皮瓣近端有轻度水肿,轻度的炎性细胞浸润,皮下纤维有增生;中段皮下组织有大量炎性细胞浸润,组织水肿明显,成纤维增生不明显;远端皮肤全层坏死,组织结构崩解,皮下出现弥漫性炎性细胞浸润。D组为空白组对照,近端皮下有大量炎性细胞弥漫性浸润,组织结构崩解,组织水肿,且成纤维细胞增生明显减少。由FJ-2300型计数仪计算各组皮瓣下血管断面数密度,4组大鼠结果分别为(35.57±5.23)、(24.92±3.13)、(21.97±3.25) %、(13.74±4.61) 个/mm2,经SPSS软件分析四组间比较P<0.01,说明各组间新生血管计数差异有统计学意义。实验组与各对照组的两两比较结果显示:A组与B组间比较P=0.0167,差异有统计学意义,即可以认为A组的新生血管计数优于B组;A组与C组间比较P=0.0167,差异有统计学意义,即可以认为A组的新生血管计数优于C组;A组与D组间比较P=0.0167,差异有统计学意义,即可以认为A组的新生血管计数优于D组。
2.4蛋白印迹检测术后7 d,细胞裂解液中检测bFGF和HIF-1在实验组中表达结果显示为阳性,对照组1、2显示为弱阳性,空白对照组为阴性,结果见图1、2。
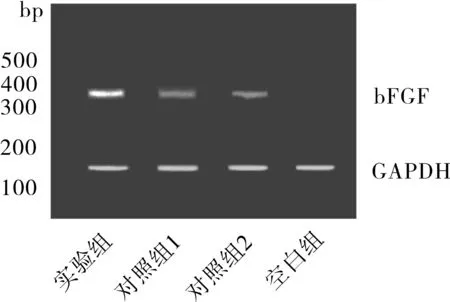
图1 bFGF与GAPDH检测结果

图2 HTF-1与GAPDH检测结果
3 讨论
血管的形成是一个复杂的过程,包括血管内皮细胞的激活、细胞外基质的降解管腔的形成等过程[5],其中bFGF被认为是最重要的血管生成因子之一[3,6]。bFGF促进血管内皮细胞的分裂、增殖以及迁移,作用于血管生成的多个环节。刘丹、王璐等[7-8]在鼠背部设计随意性皮瓣,原味缝合后皮下注射bFGF,结果显示可明显提高皮瓣存活率。HIF-1是低氧时表达的一种蛋白,对伤口的愈合、新血管的再生起着重要的作用。周盛源等[9]通过将bFGF基因导入BMSCs,建立了损伤模型后实验对比发现导入bFGF实验组损伤修复效果明显优于对照组。通过人乳腺癌细胞为对象,研究了bFGF和HIF-1在肿瘤新血管生成过程中的密切关系,发现bFGF以剂量和时间依赖性的方式诱导HIF-1的表达,并且通过MEKI/ERK和PI-3K/Akt两条通路发挥作用[9]。
由于bFGF属于生物活性蛋白,对热和酸敏感,在体内不稳定易被蛋白酶分解,导致生物学效应不能充分发挥;HIF-1在正常氧状态下易被体内细胞浆的泛素蛋白水解系统降解,应用药物的缓释制剂可解决以上的问题。王璐等[10]研究局部注射bFGF复合明胶微囊对大鼠背部任意皮瓣存活的影响,结果发现bFGF明胶微囊可提高皮瓣的成活率。基因治疗是目前研究的热点领域,但目前多采用病毒载体转染,如腺病毒、逆转录病毒载体等,虽取得了一定成功,但是一个病毒载体只能转染一个目的基因,转染效率较低,并且在表达时间、免疫反应及安全性等方面存在诸多问题。Leong等[10]在1998年创立了纳米微囊包裹非病毒载体基因转移技术。壳聚糖是纳米微囊结果,可将基因包裹在内部。Corski等[11]采用壳聚糖DNA纳米载体转染人骨髓间充质干细胞、肾肉瘤细胞,发现壳聚糖DNA纳米微囊在基因转运中具有毒性小及细胞依赖性的特点。
我们设计了随意皮瓣动物模型,将纳米微囊载体介导的bFGF联合HIF-1直接注射于大鼠皮下组织。研究发现纳米胶囊载体可以较好的控制bFGF和HIF-1的释放。本实验通过对各组皮瓣成活率的比较发现,实验组的皮瓣成活率最高,与其他对照组差异有统计学意义(P<0.05);通过对成活皮瓣进行常规病理切片HE染色的组织学检查发现实验组大鼠皮瓣的色泽、质地及组织弹性均比其他对照组要好;同时血管密度检测发现实验组的新生血管断面的数密度要显著高于其他对照组。蛋白印迹法检测细胞目的基因的表达发现实验组bFGF和HIF-1蛋白的表达比其他对照组更明显。以上结果表明,应用bFGF联合HIF-1的基因治疗要比单纯应用bFGF或HIF-1的效果理想,能显著促进皮瓣新生血管的形成,改善皮瓣供血,从而增加大鼠随意皮瓣的成活率。
[1]Kaufnan T,Angel ME.The salutary effects of the bed on the survival of experiment flaps[J].Ann PlastSurg,1985,14(1):64-73.
[2]Zakine G,Martinod E,Fornes P, et al.Growth factors improve latissimusdolrsi muscle vascularization and trophicity after cardiomyoplasty[J].Ann ThoracSurg, 2003,75(2): 549-554.
[3]郭立云,孙洁莹,孙恒,等.碱性成纤维细胞生长因子对碱烧伤兔眼角膜新生血管的影响[J].山东医药,2014,45:7-9.
[4]师永红,王玉湘.PI-3K和MEK1/ERK信号通路在碱性纤维母细胞生成因子诱导乳腺癌细胞低氧诱导因子活化中的作用及机制[J].中华医学杂志,2004,84(22):1899-1903.
[5]冯学泉,吴静超,徐新女,等.碱性成纤维细胞生长因子与信号转导和转录活化因子3在人胶质瘤细胞凋亡中的关系[J].中华医学杂志,2014,52(12):939-942.
[6]解学关,张梅,丁明胜,等.血管内皮生长因子和碱性成纤维细胞生长因子缓释微球联合高压氧对超长随意皮瓣成活的影响[J].中国综合临床,2014,30(11):1152-1156.
[7]刘丹,杨大平,岳叶丽,等.ADSC-bFGF对大鼠背部带蒂皮瓣存活率的实验研究[J].中国美容医学,22(8):829-832.
[8]王璐,郭树忠.bFGF微囊对大鼠背部任意皮瓣存活的影响[J].中国美容医学,2009, 18(9):1283-1286.
[9]周盛源,朱巍,陈雄生,等.转基因骨髓间充质干细胞修复严重韧带损伤的实验观察[J].中华医学杂志,2014,94(19):1494-1498.
[10] Leong K,Mao H.DNA-polycationnanospheres as non-viral gene delivery vehicles[J].Controlled Release,1998,53(1-3):183-193.
[11] Corski DH,Beckett MA.Blockage of the vascularendothelial growth factor stress response increase the antimuor effects of ionizing radiation[J].Cancer Res, 1999,59(14):3374-3378.
An experimental study on nanoparticle mediatedapplication with bFGF and HIF-1 to increase hypoxia toleranceof random skin flap
WANG Zhixue,XIAO Jizhou,ZHAO Zhenxia,et al
(DepartmentofBurn,TheSecondRenminHospital,Liaocheng,Shandong252600,China)
ObjectiveTo investigate the impact of basic fibroblast growth factor(bFGF) and hypoxia-induced factor -1(HIF-1) mediated by nanoparticleon hypoxia tolerance of random skinflap in rats.MethodsWe designedone random skin flap of 6cm×2cm on the back of SD rat(n=40).Then rats were randomized into four groups:group A as the experimental group with application of bFGF and HIF-1;group Bas the first control group with soleapplication ofbFGF;group C as the second control group with sole application of HIF-1 and group D as blank control group with application of normal saline only.ResultsThe exprimental group which was mediated bynanoparticle,compared with the other control groups,achieved higher survival rate of skin flap.ConclusionsGene therapy with bFGF and HIF-1 mediated by nanoparticle can promote the neovascularization in skinflap,enhance the hypoxia tolerance and increase the survival rate of random skin flap of rats.
Surgical flaps;Nanocapsules;Fibroblast growth factors;Aryl hydrocarbon receptor nuclear translocator;Neovascularization,physiologic;Rats
10.3969/j.issn.1009-6469.2016.09.008
2016-03-18,
2016-06-21)

