丁草胺降解菌的分离优化
国增超
(齐鲁医药学院生化教研室 山东淄博 255213)
丁草胺降解菌的分离优化
国增超
(齐鲁医药学院生化教研室 山东淄博 255213)
通过富集、驯化培养及平板划线等微生物分离技术,从长期生产丁草胺的山东省某农药厂附近的土壤中分离得到了三株以丁草胺为唯一碳源或氮源的降解菌株,分别标记为SD-1、SD-2和SD-3。通过革兰氏染色可以判断,SD-1被染成蓝紫色为革兰氏阳性球菌,SD-2被染成蓝紫色为革兰氏阳性杆菌,SD-3被染成红色为革兰氏阴性杆菌.随后,通过糖发酵及IMVIC等生理生化实验对菌株的基本生理生化特征进行了鉴定.同时,通过单因子优化实验确定了三株丁草胺降解菌的最适生长温度均为28℃,最适pH均为7.0,所需的最适丁草胺浓度SD-1为100 mmol/L,SD-2和SD-3均为300 mmol/L.
丁草胺 生物降解 富集 分离
丁草胺是一种高效内吸传导型苯乙酰胺类除草剂,尤其是对禾本科杂草有较好的除草效果,因其具有杀草活性高、选择性强、用量少等优点,丁草胺及其复配制剂每年均大量生产,已逐步成为我国用量最大的除草剂之一[1]。
但是丁草胺在农业生产中广泛应用的同时,不可避免的在植株、土壤和水体等系统中残留,对环境造成严重污染。其不仅对光合细菌、固氮细菌等微生物的生长有抑制作用[2-3],破坏了生态系统的正常运转,而且严重影响了农产品的质量和人们的身体健康。陈小军[4]等针对丁草胺在水稻上的降解动态与残留情况进行了分析研究,结果发现,在水稻田以常规剂量2.571g/hm2和高剂量3.857g/ hm2施用35%丁·苄可湿性粉剂后,水稻植株中的残留量为0.1738~0.2230mg/kg,在稻米中的残留量为0。0154~0.0342 mg/kg,在米糠中的残留量为0.0107~0.0297mg/kg。虽然检测中的丁草胺含量均符合国家标准,但是随着丁草胺用量的日益扩大,丁草胺在生态环境中的安全问题逐渐引起了人们的关注[5-10]。
土壤和水环境中的丁草胺可以通过光解的方式进行降解。但是,有研究表明,丁草胺抗光解的性能比较好[11],并且其在土壤中的光解速率和深度随土壤和水体pH值的增大而加快[6],这样在对丁草胺进行降解的同时,也破坏了水体和土壤的酸碱平衡。与光解相比,微生物代谢在除草剂降解中具有投资少、处理效率高、运行成本低、无二次污染等优势。因此,针对残留丁草胺的处理降解目前主要集中在微生物降解研究上。赵淑莉等[13]用高效液相色谱对除草剂丁草胺在水溶液中的微生物降解进行了研究。结果表明,接种微生物后丁草胺的降解速率明显加快,说明微生物是丁草胺降解的主要因素。李春艳等[14]用富集培养技术从长期施用丁草胺的稻田土壤中分离得到1株能够降解丁草胺的细菌,并对其培养条件进行了优化,可使丁草胺降解率达90.85%以上。
本研究以长期生产丁草胺的山东省某农药生产厂附近的污水及土壤为材料,对丁草胺降解菌进行了分离优化,并对其生理生化特征进行了初步研究,拟在为丁草胺的降解提供优良菌株资源,对丁草胺污染土壤的生物修复具有重要的现实意义。
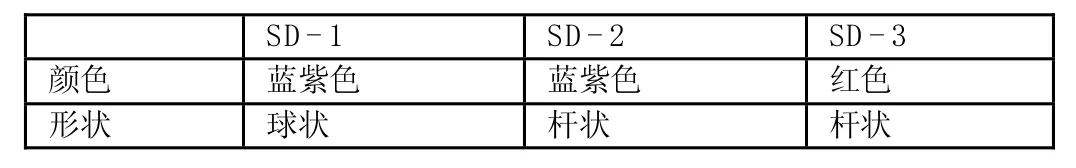
表1 革兰氏染色结果Table 1 Gram stain results

表2 生理生化特征Table 2 characteristics of physiological and biochemical
1 材料与方法
1.1 实验材料
从生产丁草胺的山东省某农药厂附近采集的土壤作为样品。
土壤的理化性质:碱性,有刺激性气味,颗粒状黑色,溶于水后分上、中、下三层。
1.2 培养基
富集培养基:蛋白胨1.0g,葡萄糖5.0g,K2HPO4 1.0g,KH2PO4 1.0g,NaCl 2.5g,加去离子水至1000ml,pH调至7.0,121℃,灭菌30min。
无机盐培养基:MgSO4 0.5g,FeSO4 0.018g,K2HPO4 1. 31g,NaNO3 3.0g,
KCL 0.5g,加去离子水至1000ml,pH调至7。0,121℃,灭菌30min。
牛肉膏蛋白胨培养基:牛肉膏5.0g,蛋白胨1.0g,琼脂粉20g,NaCl 2.5g,
加去离子水至1000ml,pH调至7.2,121℃,灭菌30min。
糖发酵培养基:蛋白胨2.0g,葡萄糖10。0g,溴百里酚蓝3ml,NaCl 5.0g
K2HPO4 0.2g,加去离子水至1000ml,pH调至7.2,121℃,灭菌30min。
蛋白胨水培养基:胰蛋白胨10.0g,pH调至7.4,121℃,灭菌30min。
葡萄糖蛋白胨水培养基:葡萄糖10.0g,蛋白胨10.0g,加去离子水至1000ml,pH调至7.2,121℃,灭菌30min。
1.3 试验方法
1.3.1 菌株的富集与分离
取10g土样溶于1000ml蒸馏水中,混匀,从上、中、下三层各取10ml样品分别接入100ml的富集培养基中。在28℃下摇床培养4d左右后取出,发现培养基变浑浊,再将上述培养液各取10ml加入到含有丁草胺的无机盐培养基中,在28℃下摇床培养,然后每隔7天接入新鲜的含丁草胺的无机盐培养基并逐步提高丁草胺的浓度,如此进行驯化富集培养约2个月。然后分别取培养液接种于牛肉膏蛋白胨培养基上,挑取生长较好的菌落回接于含有丁草胺的无机盐培养基中,待溶液出现浑浊,接种于牛肉膏蛋白胨培养基上培养,待出现菌落后,各挑取一株生长速度快,比较大的菌落进行划线分离,于4℃冰箱中保存备用。

表3 pH对丁草胺降解菌的影响Table 3 the impact of pH

表4 温度对丁草胺降解菌的影响Table 4 the impact of temperature

表5 丁草胺浓度对丁草胺降解菌的影响Table 5 the impact of butachlor concentration
1.3.2 革兰氏染色
对分离纯化的菌株进行革兰氏染色,其中染成红色的为革兰氏阴性菌,染成蓝紫色的为阳性菌,在显微镜下进行观察。
1.3.3 纯化菌株的生理生化特征鉴定[15]
糖发酵试验
此实验利用细菌分解糖的产物不同进行菌株的鉴定。有的细菌分解糖产酸产气,有的细菌分解糖只产酸不产气。
将分离纯化的三株丁草胺降解菌分别接种于含有糖发酵培养基的三只试管中,再取一个只含有糖发酵培养基而不接种任何菌株的试管和一个已接种了大肠杆菌且含有糖发酵培养基的试管分别作为对照和比较,在上述试管中分别放入一个装满培养液的小试管。将上述装置放于28℃恒温培养箱中培养2d,观察并记录结果。
吲哚试验
含有色氨酸酶的细菌能分解蛋白胨中的色氨酸产生吲哚,吲哚与对二甲基苯甲醛结合形成红色化合物。
将分离纯化的三株丁草胺降解菌分别接种于含有蛋白胨水培养基的三只试管中,再取一个只含有蛋白胨水培养基而不接种任何菌株的试管和一个已接种了大肠杆菌且含有蛋白胨水培养基的试管分别作为对照和比较。将上述装置放于28℃恒温培养箱中培养2d,取出后加入乙醚并充分振荡,使吲哚溶于乙醚中,然后慢慢加入吲哚试剂5滴,观察有无玫瑰红色出现。
伏普试验
有些细菌可利用葡萄糖产生丙酮酸,丙酮酸脱羧变成乙酰甲基甲醇,此物再碱性条件下能被空气中的氧气氧化成二乙酰,二乙酰与蛋白胨中精氨酸的胍基作用生成红色化合物。
将分离纯化的三株丁草胺降解菌分别接种于含有葡萄糖蛋白胨水培养基的三只试管中,再取一个只含有葡萄糖蛋白胨水培养基而不接种任何菌株的试管和一个已接种了大肠杆菌且含有葡萄糖蛋白胨水培养基的试管分别作为对照和比较。将上述装置放于28℃恒温培养箱中培养2d。
1.3.4 单因子优化试验测丁草胺降解菌的最适生长条件
pH对丁草胺降解菌的影响
将三株丁草胺降解菌等量稀释并接种于pH分别为6,7,8,9,丁草胺浓度为100mmol/L的选择培养基中,在28℃震荡培养箱中培养4d,然后分别去1ml培养液稀释10倍后,取1ml稀释液涂布于牛肉膏蛋白胨固体培养基上,28℃恒温培养箱中培养3d。计算各培养皿中单菌落数。
温度对丁草胺降解菌的影响
将三株丁草胺降解菌等量稀释并接种于pH为7,丁草胺浓度为100mmol/L的选择培养基中,分别在15℃、20℃、28℃、33℃的震荡培养箱中培养4d,然后分别取1ml培养液稀释10倍后,取1ml稀释液涂布于牛肉膏蛋白胨固体培养基上,28℃恒温培养箱中培养3d。计算各培养皿中单菌落数。
丁草胺浓度对其降解菌生长的影响
将三株丁草胺降解菌等量稀释并接种于pH为7,丁草胺浓度分别为50 mmol/L 、100mmol/L、300mmol/L、500mmol/L的液体培养基中,分别在20℃、28℃、33℃的震荡培养箱中培养4d,然后分别取1ml培养液稀释10倍后,取1ml稀释液涂布于牛肉膏蛋白胨固体培养基上,28℃恒温培养箱中培养3d。计算各培养皿中单菌落数。
2 结果及分析
2.1 革兰氏染色
经过多次分离纯化,得到三株以丁草胺为唯一碳源或氮源生长的菌株,分别标记为SD-1、SD-2、SD-3。革兰氏染色后的结果如表1所示。SD-1被染成蓝紫色为革兰氏阳性球菌,SD-2被染成蓝紫色为革兰氏阳性杆菌,SD-3被染成红色为革兰氏阴性杆菌。
2.2 生理生化特征鉴定
本实验对分离纯化的三株菌株的生理生化特征进行了鉴定,结果如表2所示。由实验现象可知,三株菌株都能利用葡萄糖产生丙酮酸,但是丙酮酸的去路不同。SD-1和SD-3分解葡萄糖产生的丙酮酸通过脱羧、氧化生成了二乙酰,二乙酰与蛋白胨中精氨酸的胍基作用生成红色化合物;而SD-2分解葡萄糖产生的丙酮酸又进一步分解成了甲酸。由吲哚试验可知,SD-1不含色氨酸酶,SD-2与SD-3两株菌株含色氨酸酶。
2。3 不同因素对菌株生长的影响
微生物降解农药的能力与温度、pH以及农药的浓度都有一定的关系。因此,本实验针对底物浓度、温度以及pH对菌株的影响进行了研究。结果表明,在温度及底物浓度都恒定的条件下,当pH=7时,三株菌株的数量最多,生长最快(表3)。说明中性条件是降解菌的最适生长条件。在pH、底物浓度等都相同的条件下,菌株数目虽温度的升高,呈现出先增多后减少的趋势,并且当温度为28℃时,菌株数目最多(表4)。因此,降解菌最适宜的生长温度在28℃左右。进一步对底物浓度的研究发现(表5),当丁草胺的浓度为100mmol/L时,SD-1的数量最多,生长最快;当丁草胺的浓度升高为300mmol/L时,SD-2和 SD-3的数量最多。但当丁草胺浓度继续升高时,三株菌的数量均呈下降趋势。
3 结论
丁草胺因其杀草活性高,选择性强等特点,已逐渐成为我国用量最多的三大除草剂之一[16]。目前,国外所报告的对丁草胺有降解作用的微生物主要有毛霉菌属、毛壳球菌、青霉菌属等[18],但我国关于丁草胺降解菌的报道较少,主要有节杆菌属等[8]。本研究通过富集、驯化培养等微生物分离技术,从长期生产丁草胺的山东省某农药厂附近的土壤中分离得到了三株以丁草胺为唯一碳源或氮源的降解菌株。通常情况下,微生物降解农药的能力与浓度、pH及温度等都有一定的关系,在自然环境中的降解能力还会受到其他微生物的影响。本研究通过单因子优化实验对三株丁草胺降解菌所需的最适丁草胺浓度、最适pH及最适温度等进行了确定。中性条件以及温度在28℃左右时,三株降解菌的生长力最强;SD-1最适宜生长的丁草胺浓度为100mmol/L,而SD-2和 SD-3最适宜的丁草胺浓度为300mmol/L,但当丁草胺浓度继续升高时,三株菌的数量均呈下降趋势。
本研究所进行的单因子优化实验等操作是在实验室条件下进行的,菌株是否能够在田间自然环境下对土壤中的丁草胺进行降解以及降解率如何则需要将菌株接种到污染土壤中实际测定其修复能力[19-21]。另外,后续研究还将进一步对菌株的16srRNA基因序列进行分析,以准确确定菌株所属种属,并进一步对其进行降解率的研究。
[1]吴新杰,岳永德,花日茂,等.丁草胺高效降解细菌的分离[J]. 应用与环境生物学报,2000,6(6):593-596.
[2]Zager M Y. Effects of benthiocarb and butachlor on growth and nitrogen fixation by cyanobacteria [J].Bull Environ Contam Toxicol, 1990, 45(2):232-234.
[3]Lee K M. Effects of butachlor on the growth of purplenon sulfur bacteria[J]. Misaengmul Hakhoechi,1991,29(2):130-135.
[4]陈小军,程东美,徐汉虹,等.丁草胺在水稻上的降解动态与残留分析[J].华中农业大学学报,2009,28(3):286-290.
[5]冯慧敏,何红波,武叶叶,等.黑土环境中乙草胺的微生物降解特征研究[J].土壤通报,2008,39(2):379-343.
[6]郑和辉,叶常明.甲草胺和丁草胺等除草剂在多介质环境中环境行为综述[J].环境科学进展,1999,7(3):1-10.
[7]李川,古国榜,柳松.丁草胺高效真菌的分离及性能研究[J].农业环境科学学报,2004,23(3):611-614.
[8]田芹,周志强,江树人,等.丁草胺在环境中降解行为的研究进展[J].农药,2004,43(5):205-208.
[9] Zheng H, Ye C. Photodegration of acetochlor and butachlor in waters containing humic acid and inorganic ion [J]. Bull Environ ContamToxicol, 2001, 67: 601-608.
[10] Yu Y L, Chen Y X, Luo Y M. Rapid degradation of butachlor in wheat rhizosphere soil [J]. Chemosphere, 2003, 50: 771-774.
[11]楚小强,庞国辉,方华,等.丁草胺降解菌的分离鉴定及降解特性的研究[J].农业环境科学学报,2009,28(1):145-150.
[12]赵淑莉,谭文捷,何绪文.除草剂丁草胺的分析测定及其微生物降解产物研究[J].农业环境科学学报,2005,24(5):989-993.
[13]李春艳,李艳春,成小松,等.一株丁草胺降解菌的分离鉴定及培养条件优化[J].环境科学学报,2010,30(2):347-353.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:267-273.
[15]胡笑形.我国农药工业的现状与发展方向[J].农药,1998,37(6):7-10.
[16]Cheng H R, Jiang N. Extremely rapid extraction of DNA from bacteria and yeasts[J]. Biotechnology Letters, 2006, 28: 55-59.
[17]Karen M K, Sherry L H, Douglas C N. Novel, attached, sulfuroxidizing bacteria at shallow hydrothermal ventspossess vacuoles not involved in respiratory nitrate accu-mulation[J]. Appl Environ Microbiol, 2004, 70: 7487-7496.
[18]Hsu K Y, Lin H J, Lin J K, et al. Mutagenicity study of butachlor and its metabolites using salmonella typhimurium[J]. Microbiol Immunol Infect, 2005, 38(6): 409-416.
[19]Beestman G B, Deming J M. Dissipation of acetanilide herbicides fromsoils [J]. Agronomy Journal, 1974,66(2):308-311.
Isolation and optimization of Butachlor Degradation Bacteria
GUO Zeng-chao
(Department of Biochemistry, Qilu Medical University, Zibo, Shandong, 255213)
Three butachlor-degrading strains named SD-1, SD-2 and SD-3 were isolated from the soil samples that obtained from the pesticide factory by enrichment culture, domestication selection and plate streaking. SD-1and SD-2 were dyed blueviolet, while the SD-3 was dyed red by the Gram stain. According to the Carbohydrate and IMVIC experiment, the morphologic and physiobiochemical characteristics of the bacteria were identified. Then, by the single factor optimize experiment, the optimal temperature of the three strains were 28℃ and the optimal pH were 7, the optimal butachlor density of the SD-1 was 100mmol/ L, while the SD-2 and SD-3 were 300 mmol/L.
Butachlor;Biodegradation;Enrichment;Isolation
Q5
A
1674-2060(2016)02-0006-03
国增超(1987—),男,助教,硕士生,主要从事微生物分离纯化方面的研究。

