铯对印度芥菜和菊苣植物螯合肽和金属硫蛋白含量的影响
何娇,何玉,黄楚乔,韩娜,陶宗娅,*,吴国,罗学刚
1.四川师范大学生命科学学院,成都610101
2.生物质材料教育部工程研究中心,西南科技大学,绵阳621010
铯对印度芥菜和菊苣植物螯合肽和金属硫蛋白含量的影响
何娇1,何玉1,黄楚乔1,韩娜1,陶宗娅1,*,吴国1,罗学刚2
1.四川师范大学生命科学学院,成都610101
2.生物质材料教育部工程研究中心,西南科技大学,绵阳621010
以133Cs作为污染源,溶液培养印度芥菜和菊苣幼苗,研究植物螯合肽(phytochelatins,PCs)、金属硫蛋白(metallothionein, MT)等含巯基肽类物质与Cs+胁迫毒理的内在联系。采用改良水培法培养印度芥菜和菊苣长至两片真叶,置于含铯[ρ(Cs+)0~200 mg·L-1]的营养液中培养一段时间后取样,测定幼苗地上部和根系生物量,采用火焰原子吸收分光光度法测定Cs+富集量,5,5’-二六硝基苯甲酸(DTNB)比色法测定PCs和MT含量。结果显示:随着Cs+浓度[ρ(Cs+)25~200 mg·L-1]增加,印度芥菜和菊苣地上部和根系生物量显著降低(P<0.05),印度芥菜的生物量降低幅度小于菊苣;Cs+的富集量均显著增加,印度芥菜对Cs+富集量大于菊苣,印度芥菜地上部、菊苣根系分别是Cs+的主要蓄积部位;非蛋白巯基肽类(non-protein thiol,NPT)、植物螯合肽(PCs)、谷胱甘肽(glutathione,GSH)和金属硫蛋白(MT)含量变化均呈现先升后降的趋势,均表现为根系>地上部,印度芥菜>菊苣。当ρ(Cs+)100 mg·L-1时NPT、PCs、GSH和MT达最大值。结果表明,菊苣对Cs+处理敏感,印度芥菜具有较强的吸收和转运Cs+的能力,Cs+处理诱导合成PCs、GSH和MT含量显著增加,这是印度芥菜对Cs+耐性较强的主要原因。
铯(Cs+);印度芥菜;菊苣;非蛋白巯基肽类;植物螯合肽;谷胱甘肽;金属硫蛋白
何娇,何玉,黄楚乔,等.铯对印度芥菜和菊苣植物螯合肽和金属硫蛋白含量的影响[J].生态毒理学报,2016,11(3):272-280
He J,He Y,Huang C Q,et al.Effect of Cs+on phytochelatins and metallothionein in seedlings ofBrassica junceaandCichorium intybus[J].Asian Journal of Ecotoxicology,2016,11(3):272-280(in Chinese)
铯(cesium,Cs)在自然界的本底含量很低,属于微量元素,是植物的非必需营养元素,低浓度Cs+可维持细胞电解质平衡,高浓度的Cs+则具有一定的毒害效应[1]。随着铯在科技、工业、医疗等领域的广泛应用,土壤铯的本底值逐年递增,尤其是2011年日本福岛第一核电站爆炸,导致大范围的农田、水体、大气受到严重的放射性核素铯(137Cs和134Cs)的污染。137Cs半衰期为30.17年,被认为是生物学上最危险的放射性核素之一[2]。大量放射性核素铯在土壤中累积,易残留在农作物和果蔬中进入食物链,对动物和人类健康构成极大的潜在伤害[3]。目前,尚未发现Cs+对植物代谢和生长发育的有益作用,但高浓度Cs+对植物生长有抑制作用[4]。Cs+及其同位素对植物的毒性机制主要在于其性质与钾(potassium,K)相似,是K+的竞争性抑制剂,也是K+通道蛋白的阻断剂。Cs+进入植物细胞后取代K+,同时与K+竞争蛋白质结合位点,导致植物体内需要K+的相关代谢组分失去活性[5]。有关土壤铯污染对植物毒性的研究主要集中于植物生长[3]、生物量[6]、光合作用[7]、抗氧化酶活性[8]、富集能力[9]等方面,而利用植物修复技术治理铯污染土壤已成为近年的研究热点。
植物对金属的忍耐机制之一是耐性,即植物通过生理生化代谢,避免自身在高浓度金属胁迫下受到伤害,其途径包括金属转运、螯合形成胶体或沉淀及区域化等[10]。研究表明,螯合作用是植物细胞对金属的解毒机制之一,其机理主要是通过植物螯合肽(phytochelatins,PCs)和金属硫蛋白(metallothionein,MT)与金属离子结合,形成硫肽复合物,降低游离态金属离子浓度,从而提高植物对金属的耐性[11]。PCs为非基因编码产物,是由植物螯合肽合酶催化谷胱甘肽(glutathione,GSH)合成的小分子巯基化合物,广泛存在于高等植物和真核藻类中。刘俊祥等[12]发现,5 mg·L-1镉(cadmium,Cd2+)溶液处理多年生黑麦草幼苗6 d后,其根、叶中的Cd2+含量达到2.59 mg·g-1和0.24 mg·g-1,PCs含量比对照组(CK)显著增加12.49%和50.12%;齐君等[13]研究发现,250 mg·L-1铬(chromium,Cr3+)溶液处理耐铬性强的青菜幼苗5 d后,其叶片发黄、边缘卷曲,PCs含量比对照(CK)显著增加30.9%;表明镉、铬胁迫下黑麦草和青菜幼苗PCs合成机制被启动,以缓解镉、铬胁迫损伤。
MT是一类由基因编码合成的富含半胱氨酸的低分子量蛋白质,可与多种金属离子结合,广泛存在植物、微生物、高等动物和人类的多种器官组织中。MT参与维持生物体内必需金属元素的平衡和非必需金属的解毒,还参与活性氧清除、调节细胞生长等过程[14]。Yang等[15]研究表明,将外源MT基因ZjMT转入枣树中表达,发现转ZjMT基因的枣树对钠(sodium,Na+)和Cd2+的耐性增强;Sekhar等[16]也发现转MT基因CcMT1的大肠杆菌对Cu2+、Cd2+的耐性和富集能力显著增强。这些研究都集中于植物和微生物对Cd、铜(copper,Cu)、Na等的响应,关于Cs+影响下印度芥菜和菊苣2种植物忍耐机制的研究尚未见报道。
印度芥菜(Brassica junceaL.)又称春菜,是十字花科芸苔属植物,对Cd、锌(zinc,Zn)、Cu等多种金属具有较强的富集能力,是目前公认的利用植物修复清除土壤重金属和放射性物质的主要模式植物[17]。Su等[18]研究发现,在Cs+浓度为50~600 mg· L-1溶液中培养印度芥菜23 d,根、叶中铯累积量最高达6 794 mg·kg-1和12 251 mg·kg-1,可见印度芥菜对铯具有很强的耐性和蓄积能力。菊苣(Cichorium intybuL.)又称苦苣、苦菜,是菊科菊苣属多年生草本植物。菊苣为药食两用植物,根可提制菊粉,促进消化,叶可调制生菜;菊苣根和叶具有清热解毒、利尿消肿、健胃等功效,还可用作粗饲料或牧草[19]。菊苣具有很强的耐寒、耐旱和抗病虫害等特性[20]。詹金熹等[8]发现,用Cs+浓度为160 mg·L-1的溶液培养菊苣,其幼苗生长代谢异常,过氧化损伤严重。唐永金等[21]用含Cs+500 mg·kg-1的土壤培养菊苣幼苗70 d,其发芽率、存活率、叶绿素含量低于对照,胁迫伤害显著,表明菊苣耐铯能力较弱。
本文采用溶液培养法,以化学性质与137Cs相似的稳定性核素133Cs作为污染源,模拟环境137Cs污染,培养印度芥菜和菊苣幼苗,通过测试分析幼苗生物量,Cs+富集量,PCs、MT和GSH含量,探索含巯基肽类物质的量变与Cs+毒性的内在联系,为修复植物的选育提供实验依据。
1 材料与方法(Materials and methods)
1.1 试材及处理
印度芥菜和菊苣种子(购自湖北武汉安谷农业科技有限公司),经75%酒精消毒10 min,蒸馏水冲洗后,放入铺有湿润纱布的白磁盘上萌发,25℃、避光培养2 d(期间保持纱布湿润)。将萌发种子转移至纸杯(纸杯去底,纱布兜底);再套入一次性塑料杯,其内盛装1/6 Hoagland营养液,培养室温度25℃、光/暗(14 h/10 h),培养5 d,每日更换1次营养液,至长出两片真叶时进行处理。
将以纱布兜底的育苗纸杯转移至装有不同浓度Cs+溶液[ρ(Cs+)0 mg·L-1(CK)、25 mg·L-1、50 mg· L-1、100 mg·L-1和200 mg·L-1]的一次性塑料杯中,处理培养2 d后,测定幼苗Cs+含量、植物螯合肽(PCs)含量和金属硫蛋白(MT)含量;处理培养9 d后,测定生物量。处理液均使用1/6 Hoagland营养液配制,每处理重复3次。
1.2 生物量测定
将不同处理的印度芥菜和菊苣幼苗用去离子水洗净,将幼苗地上部和根系分开,置培养皿中,110℃杀青10 min,后将温度调至80℃,继续烘干至恒重,称重,以g·plant-1DW表示(DW表示干重)。
1.3 Cs+含量测定
采用火焰原子分光光度法[22]。将植株地上部和根系分开,去离子水冲洗,置20 mmol·L-1EDTANa2浸泡20 min,吸水纸吸干植株上的附着水,置于105℃杀青10 min,65~70℃烘干至恒重,烘干样品用于测定Cs+含量,以mg·g-1DW表示。
1.4 非蛋白巯基肽(NPT)总量测定
采用DTNB法[23]:称取植物鲜样1.000 g置研钵中,加入6 mL预冷的(4℃)5%磺基水杨酸溶液,冰浴研磨至匀浆,4℃下10 000 r·min-1离心20 min,上清液用于NPT测定,DTNB为显色剂,在412 nm测定光吸收值(A412),以mmol·g-1FW表示(FW表示鲜重)。
1.5 谷胱甘肽含量(GSH)测定
采用DTNB法[24]:称取植物鲜样1.000 g置研钵中,加入6 mL预冷的(4℃)50 mg·L-1三氯乙酸溶液(含5 mmol·L-1Na2-EDTA),冰浴研磨至匀浆,4℃下10 000 r·min-1离心20 min,上清液用于GSH测定,以mmol·g-1FW表示。
1.6 植物螯合肽(PCs)含量计算
采用差减法[25]:植物螯合肽(PCs)含量=非蛋白巯基肽(NPT)总量-谷胱甘肽(GSH)含量
1.7 金属硫蛋白(MT)含量测定
采用DTNB法[26-27]:称取植物鲜样1.000 g置研钵中,加入6 mL预冷的(4℃)0.1 mol·L-1的Tris-HCl缓冲液(pH 8.6),冰浴研磨至匀浆,冰箱(4℃)过夜抽提;4℃下10 000 r·min-1离心10 min,收集上清液;90℃水浴加热3 min,降至室温,10 000 r·min-1离心10 min,收集上清液;加入3倍体积的无水乙醇,-20℃过夜沉淀;10 000 r·min-1离心10 min;取沉淀加入5 mL 0.1 mol·L-1Tris-HCl缓冲液溶解数小时;10 000r·min-1离心10 min,收集上清液用于测定MT含量,以mmol·g-1FW表示。
1.8 数据分析
采用SPSS 18.0软件进行方差分析、LSD检验及显著性检验,Origin 9.0制图。
2 结果与讨论(Results and discussion)
2.1 生物量的变化
图1可知,随着Cs+浓度[ρ(Cs+)25~200 mg·L-1]增加,印度芥菜和菊苣地上部和根系生物量显著降低(P<0.05)。与对照组(CK)比较,印度芥菜地上部生物量降低5.00%~13.98%,根系降低4.99%~14. 25%;菊苣地上部和根系分别降低10.93%~39.55%和11.90%~31.43%;印度芥菜单位干重明显大于菊苣,菊苣幼苗生物量降低幅度>印度芥菜。表明外源铯处理对2种植物生长产生显著的抑制效应,印度芥菜耐铯能力强于菊苣。
2.2 铯(Cs+)富集量的变化
表1可见,随着Cs+[ρ(Cs+)25~200 mg·L-1]增加,2种植物地上部和根系Cs+富集量显著增加(P< 0.05),变化趋势一致。与CK比较,印度芥菜地上部和根系Cs+富集量增加243.2倍~505.2倍和121.2倍~385倍,菊苣地上部增加251.0倍~550倍,根系增加121.2倍~140倍;地上部与根系Cs+富集量相互比较,印度芥菜地上部高于根系31.14%~99.85%,菊苣则为根系高于地上部0.54~1.91倍;2种植物相互比较,地上部Cs+富集量为印度芥菜>菊苣,且整体高于菊苣3.85倍~4.32倍,根系亦呈现类似趋势;印度芥菜TF值>1,平均高于菊苣约3.39倍。结果表明,印度芥菜吸收和富集Cs+并从根系转移到茎叶的能力强于菊苣,2种植物的Cs+富集能力存在显著差异。
2.3 含巯基肽类含量的变化
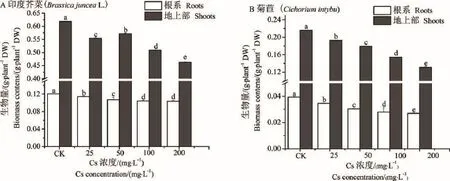
图1 Cs+处理对印度芥菜和菊苣幼苗生物量的影响
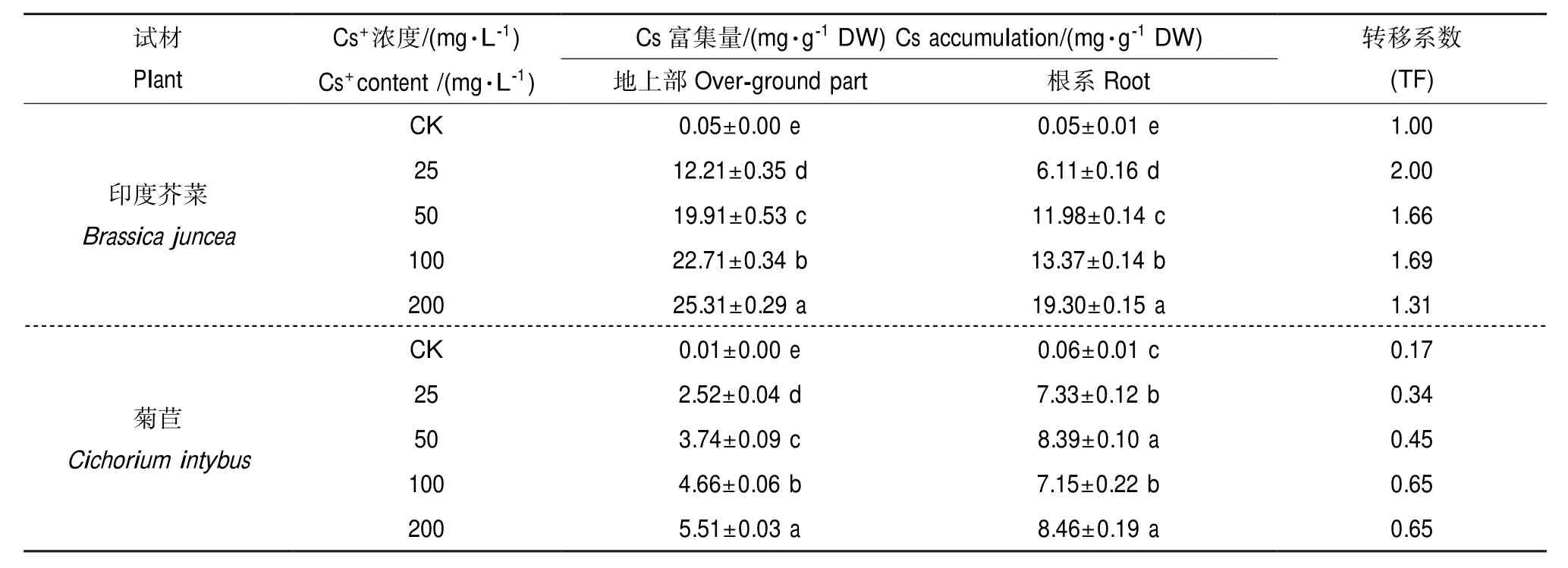
表1 印度芥菜和菊苣幼苗Cs+富集量。Table 1 Effect of Cs+treatment on Cs accumulation in overground and roots ofBrassica junceaandCichorium intybus

图2 Cs+处理下印度芥菜和菊苣幼苗含巯基肽类含量的变化
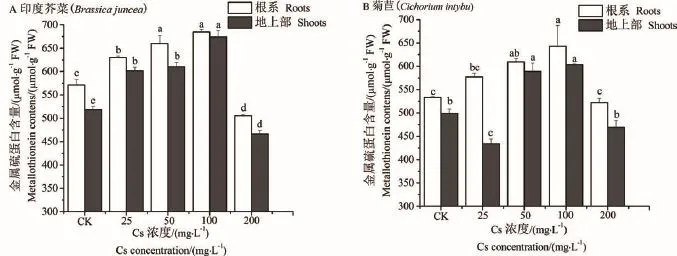
图3 Cs+处理下印度芥菜和菊苣幼苗金属硫蛋白含量的变化
图2显示,随着ρ(Cs+)增加,2种植物非蛋白巯基肽(NPT)、植物螯合肽(PCs)和谷胱甘肽含量(GSH)含量均呈现先升高后降低的变化趋势;当ρ(Cs+) 100 mg·L-1时,其地上部和根系NPT、PCs和GSH含量均达最大值;与CK比较,印度芥菜地上部增加22.2%~30.7%,根系增加19.3%~65.5%,菊苣地上部和根系分别增加17.7%~70.7%和16.1%~41.3.0%;当ρ(Cs+)200 mg·L-1时,2种植物的含巯基肽类含量均不同程度降低。可见,Cs+处理下印度芥菜和菊苣诱导合成的NPT、PCs和GSH均呈现根系>地上部,印度芥菜>菊苣,表明印度芥菜对Cs+处理的响应相对快速且显著。
2.4 金属硫蛋白(MT)含量的变化
图3可知,随着ρ(Cs+)的升高,印度芥菜和菊苣的MT含量先升后降,处理组与CK组的差异显著(P<0.05)。当ρ(Cs+)100 mg·L-1时,MT含量最高,印度芥菜地上部和根系MT含量增加19.93%和30.16%,菊苣地上部和根系增加20.54%和20.87%;当ρ(Cs+)200 mg·L-1时,2种植物的MT含量均显著降低。可见,相对较低浓度Cs+[ρ(Cs+)≤100 mg· L-1]处理可诱导印度芥菜和菊苣MT合成量显著增加,均表现为根系>地上部,印度芥菜>菊苣,即Cs+处理下印度芥菜诱导合成MT的能力较强。
3 讨论(Discussion)
铯是植物生长发育的非必需营养元素,当土壤铯含量达到一定剂量时,可导致高粱[21]、小麦[28]、苏丹草[29]等生长发育受到抑制。本研究表明,外源铯处理下印度芥菜和菊苣生物量均显著下降(图1),菊苣受到的抑制程度>印度芥菜。相同处理下印度芥菜铯的富集量>菊苣,印度芥菜对铯的转移系数(TF) >1,菊苣TF<1(表1),表明十字花科植物印度芥菜吸收和转运铯及耐铯能力均强于菊科植物菊苣,这与范仲学等[30]的研究结果一致。
植物体内的螯合剂主要有非蛋白巯基肽(NPT)、植物螯合肽(PCs)、谷胱甘肽(GSH)和金属硫蛋白(MT)等含巯基肽类物质,其所含有的巯基(-SH)能够与金属离子螯合形成硫肽复合物,降低金属离子在植物体内的有效浓度。Sanità等[31]认为,NPT、PCs等巯基化合物能够络合金属并将其转运至液泡,缓解植物的金属毒害,称为植物体的“第一道防线”。当第一道防线不能完全解除金属毒害时,植物细胞会产生一系列生理生化反应以适应金属胁迫伤害,其中最先表现的是细胞内活性氧(ROS)的累积,随后“第二道防线”开始启动,植物体内多种抗氧化酶活性升高,缓解高浓度金属胁迫引起的植物过氧化损伤[32]。本研究表明,随着Cs+浓度升高,印度芥菜和菊苣地上部和根系的NPT、PCs和GSH含量均先增加后降低,ρ(Cs+)100 mg·L-1时达到最大值(图2),这可能是在Cs+胁迫下该2种植物启动自身防御机制,诱导合成PCs和GSH,并与Cs+螯合形成硫肽复合物,在植物细胞内形成区室化,阻断Cs+取代K+的竞争性抑制作用,有效地保护细胞和功能组分的天然结构[33]。2种植物根系NPT、PCs和GSH含量均高于地上部,可能由于根系是首先接触或受到Cs+胁迫的植物器官;随着Cs+上运,2种植物地上部诱导合成晚于根系,积累量也相应地低于根系,这与吴慧芳[34]的研究结果一致。Cs+处理下印度芥菜诱导合成的NPT、PCs和GSH含量均高于菊苣,说明印度芥菜具有较强的含巯基多肽物质的诱导合成能力,这是印度芥菜耐铯性强的原因之一。
Guo等[35]研究表明,逆境(金属离子、脱落酸、盐以及过氧化作用等)条件下植物MT含量增加,且MT的表达具有组织器官特异性和发育阶段特异性[36]。MT不仅与金属的解毒机制相关,还能调节植物体内必需金属元素Zn、Cu等的平衡,保护机体免受过氧化损伤及DNA损伤[37]。本研究表明,随着Cs+浓度升高,2种植物地上部和根系MT含量呈现先升高后下降的趋势,且当ρ(Cs+)100 mg·L-1时MT含量达最大值(图3),说明2种植物在受到铯胁迫时均能启动自身MT合成机制。2种植物根系MT含量高于地上部,是由于根系首先接触到外源铯,其次可能是由于MT的特异性表达,这与Rupesh等[38]研究结果一致。Rupesh等[38]证实,诱导合成MT的基因CmMet-2在小叶鹰嘴豆根系表达量高于地上部,根系MT含量高于地上部。本研究显示,Cs+处理下诱导合成的MT含量为印度芥菜>菊苣,这是印度芥菜耐铯强的原因之二。
Cs+处理下,印度芥菜通过合成较多的PCs和MT来缓解铯毒害,这可能是印度芥菜耐铯胁迫能力强的原因。本研究可为不同种类植物耐铯差异的研究提供实验依据,但关于铯处理下植物PCs和MT诱导合成机理及其调控机制有待进一步研究。
综上所述:(1)外源铯[ρ(Cs+)25~200 mg·L-1]处理对印度荠菜和菊苣幼苗生长具有抑制作用,其生物量均显著下降(P<0.05),当ρ(Cs+)200 mg·L-1时受到的抑制作用最大,对菊苣的抑制程度>印度芥菜;(2)印度芥菜对Cs+富集量>菊苣;印度芥菜地上部是Cs+的主要蓄积部位(TF>1),体现出超富集植物的显著特征;菊苣根系是Cs+的主要蓄积部位(TF<1);(3)相对较低浓度Cs+[ρ(Cs+)≤100 mg·L-1]处理均提高2种植物的含巯基多肽物质(NPT、PCs、GSH和MT)的含量,说明2种植物在铯胁迫时可能启动PCs、GSH和MT合成机制,通过与Cs+的螯合作用而缓解Cs+毒害。Cs+处理下,印度芥菜诱导合成PCs、GSH和MT含量显著增加,这是印度芥菜具有较强耐铯性的主要原因。
(References):
[1] 卢靖,王颖松,蒋育澄,等.金属铯的生物化学研究进展[J].稀有金属,2006,30(5):682-687
Lu J,Wang Y S,Jiang Y C,et al.Progress in biochemical studies on metal cesium[J].Chinese Journal of Rare Metals,2006,30(5):682-687(in Chinese)
[2] Hampton C R,White P J.Cesium toxicity inArabidopsis [J].Plant Physiology,2004,136(3):3824-3837
[3] 刘红娟,唐泉,单健,等.环境中放射性铯的迁移进展研究[J].环境科学与管理,2014,39(12):50-54
Liu H J,Tang Q,Shan J,et al.Migration of radiocesium in environment[J].Environmental Science and Management,2014,39(12):50-54(in Chinese)
[4] Nishikiori T,Watanabe M,Koshikawa M K,et al.Uptake and translocation of radiocesium in cedar leaves following the Fukushima nuclear accident[J].Science of the Total Environment,2015,502(502C):611-616
[5] Eri A,Parisa A,Ryoung S.Cesium inhibits plant growth through jasmonate signaling inArabidopsis thaliana[J]. International Journal of Molecular Sciences,2013,14(3): 4545-4559
[6] 任少雄,王丹,闻方平,等.4种植物对133Cs和88Sr污染土壤的修复研究[J].西北植物学报,2012,32(7):1433-1439
Ren S X,Wang D,Wen F P,et al.Phytoremediation of four plant species in133Cs and88Sr contaminated soil[J]. Acta Botanica Boteali-Occidentalia Sinica,2012,32(7): 1433-1439(in Chinese)
[7] 徐静,唐运来,王建宝,等.Cs对菠菜叶片光合作用影响的研究[J].核农学报,2015,29(5):986-994
Xu J,Tang Y L,Wang J B,et al.Study on the effects of cesium on photosynthesis of sprinach[J].Journal of Nuclear Agricultural Sciences,2015,29(5):986-994(in Chinese)
[8] 詹金熹,陶宗娅,罗学刚,等.菊苣幼苗对铯、镉的生理响应[J].农业环境科学学报,2013,32(5):902-909
Zhan J X,Tao Z Y,Luo X G,et al.The physiological response ofCichorium intybusL.seedlings to treatments with cesium and cadmium[J].Journal of Agro-Environment Science,2013,32(5):902-909(in Chinese)
[9] 宋志东,唐永金.水体铯污染的生物效应与修复植物筛选[J].环境工程学报,2015,9(4):1856-1862
Song Z D,Tang Y J.Biological effects of cesium contamination and screening of plants for phytoremediation of cesium contaminated water[J].Chinese Journal of Environmental Engineering,2015,9(4):1856-1862(in Chinese)
[10] Clemens S.Toxic metal accumulation,responses to exposure and mechanisms of tolerance in plants[J].Biochimie, 2006,88(11):1707-1719
[11] Ernst W H O,Krauss G J,Verkleij J A C,et al.Interaction of heavy metals with the sulphur metabolism in angiosperms from an ecological point of view[J].Plant Cell and Environment,2008,31(1):123-143
[12] 刘俊祥,许新桥,钱永强,等.多年生黑麦草抗氧化酶和植物络合素对Cd2+胁迫的应答[J].生态学杂志, 2013,32(7):1787-1793
Liu J X,Xu X Q,Qian Y Q,et al.Responses of antioxidative enzymes and phytochelatins inLolium perenneto Cd2+stress[J].Chinese Journal of Ecology,2013,32(7): 1787-1793(in Chinese)
[13] 齐君,吕金印,李鹰翔,等.Cr3+胁迫对青菜中植物络合素含量及AsA-GSH代谢关键酶活性的影响[J].农业环境科学学报,2012,31(7):1303-1309
Qi J,Lv J Y,Li Y X,et al.Effects of chromium stress on content of phytochelatins and the activities of key enzymesofascorbate-glutathionecycleinBrassica chinesnsisL.[J].Journal of Agro-Environment Science, 2012,31(7):1303-1309(in Chinese)
[14] Yan L,Yi C Y,Guang Y S,et al.Cloning and characterization ofHbMT2a,a metallothionein gene fromHevea brasiliensisMuell.Arg differently responds to abiotic stress and heavy metals[J].Biochemical&Biophysical Research Communications,2015,461(1):95-101
[15] Yang M,Zhang F,Wang F,et al.Characterization of a Type 1 metallothionein gene from the stresses-tolerant plantZiziphus jujube[J].International Journal of Molecular Sciences,2015,16(8):16750-16762
[16] Sekhar K,Priyanka B,RRwddy V D,et al.Metallothionein 1(CcMT1)of pigeonpea(Cajanus cajanL.)confers enhanced tolerance to copper and cadmium inEscherichia coliandArabidopsis thaliana[J].Environmental and Experimental Botany,2011,72(2):131-139
[17] 孙涛,张玉秀,柴团耀.印度芥菜(Brassica junceaL.)重金属耐性机理研究进展[J].中国生态农业学报,2011,19(1):226-234
Sun T,Zhang Y X,Chai T Y.Research progress on tolerance of Indian mustard(Brassica junceaL.)to heavy metal[J].Chinese Journal of Eco-Agriculture,2011,19(1): 226-234(in Chinese)
[18] Su Y,Sridhar B B M,Han F X,et al.Effect of bioaccumulation of Cs and Sr natural isotopes on foliar structure and plant spectral reflectance of Indian mustard(Brassica Juncea)[J].Water Air and Soil Pollution,2007,180(1): 65-74
[19] 罗燕,白史且,彭燕,等.菊苣种质资源研究进展[J].草业科学,2010,7(7):123-132
Luo Y,Bai S Q,Peng Y,et al.Research progress on germplasm resources ofCichorium intybus[J].Pratacultural Science,2010,7(7):123-132(in Chinese)
[20] 王俭珍,崔健.牧草菊苣及其利用潜力Ⅱ利用价值和开发潜力[J].草业科学,2010,27(2):150-156
Wang J Z,Cui J.Use potential of a forage chicory:ⅡUtilization value and exploitive potential[J].Pratacultural Science,2010,27(2):150-156(in Chinese)
[21] 唐永金,罗学刚,曾峰,等.不同植物对高浓度Sr、Cs胁迫的响应与修复植物筛选[J].农业环境科学学报, 2013,32(5):960-965
Tang Y J,Luo X G,Zeng F,et al.The responses of plant to high concentrations of strontium,cesium stress and the screening of remediation plants[J].Journal of Agro-Environment Science,2013,32(5):960-965(in Chinese)
[22] 董顺福,韩丽琴,赵文秀,等.火焰原子吸收分光光度法测定酸枣仁中金属元素的含量[J].安徽农业科学, 2009,37(20):9328-9329
Dong S F,Han L Q,Zhao W X,et al.Content determination of mental elements in spine date seeds by flame atomic absorption spectrophotometry[J].Journal of Anhui Agricultural Sciences,2009,37(20):9328-9329(in Chinese)
[23] Duan G L,Hu Y,Liu W J,et al.Evidence for a role of phytochelatins in regulating arsenic accumulation in rice grain[J].Environmental and Experimental Botany,2011, 71(3):416-421
[24] 李玲,李娘辉,蒋素梅.植物生理学模块实验指导[M].北京:科学出版社,2009:100-103
Li L,Li N H,Jiang S M.Plant Physiology Experiment Instruction[M].Beijing:Science Press,2009:100-103(in Chinese)
[25] 宋相帝,吕金印,邸丽俊,等.铬胁迫对青菜(Brassica chinensisL.)植物螯合肽含量及抗氧化特性的影响[J].农业环境科学学报,2011,30(5):843-848
Song X D,Lv J Y,Di L J,et al.Effect of chromium stress on the content of phytochelatins and antioxidative characteristics inBrassica chinensisL.[J].Journal of Agro-Environment Science,2011,30(5):843-848(in Chinese)
[26] 王黎,于立博,刘继文.新疆部分植物金属硫蛋白含量测定[J].新疆医科大学学报,2012,35(11):1486-1489
Wang L,Yu L B,Liu J W.The determination of the plant metallothione in part of plants in Xinjiang[J].Journal of Xinjiang Medical University,2012,35(11):1486-1489(in Chinese)
[27] 吴云辉,王俊坤,孙继鹏,等.DTNB比色法测定金属硫蛋白含量[J].食品科学,2013,34(16):196-199
Wu Y H,Wang J K,Sun J P,et al.Colormetric determination of metallothionein using DTNB[J].Food Science, 2013,34(16):196-199(in Chinese)
[28] 安冰,唐运来,陈梅,等.小麦抗氧化能力对Cs+富集响应的研究[J].核农学报,2011,25(2):348-352
An B,Tang Y L,Chen M,et al.Responses of antioxidant capacity to Cs+bioconcentration in wheat[J].Journal of Nuclear Agricultural Sciences,2011,25(2):348-352(in Chinese)
[29] 闻方平,王丹,徐长合,等.苏丹草对133Cs和88Sr胁迫响应及吸收积累特征研究[J].辐射研究与辐射工艺学报,2009,27(4):212-217
Wen F P,Wang D,Xu C H,et al.Study on the stress responses and the characteristics of uptake and accumulation of sorghum sudanense to133Cs and88Sr[J].Journal of Radiation Research and Radiation Processing,2009,27 (4):212-217(in Chinese)
[30] 范仲学,徐世明.植物吸收环境中137Cs的研究概况[J].核农学通报,1995,16(5):247-248
Fan Z X,Xu S M.Research overview on plant uptake of137Cs from environment[J].Bulletin of Agriculturae Nucleatea,1995,16(5):247-248(in Chinese)
[31] Sanità d T L,Pawlik-Skowrońska B,Vurro E,et al.First and second line mechanisms of cadmium detoxification in the lichen photobiontTrebouxia impressa(Chlorophyta) [J].Environmental Pollution,2008,151(2):280-286
[32] Apel K,Hirt H.Reactive oxygen species:Metabolism,oxidative stress,and signal transduction[J].Annual Review of Plant Biology,2004,55(1):373-399
[33] 付倩,赖金龙,尹燚,等.铯对印度芥菜幼苗生长的影响及其亚细胞分布和化学形态[J].西北植物学报, 2015(11):2235-2242
Fu Q,Lai J L,Yin Y,et al.Effect of cesium on seedling growth,its subcellular distribution and chemical forms in Brassica junceaL.[J].Acta Botanica Boreali-Occidentalia Sinica,2015(11):2235-2242(in Chinese)
[34] 吴惠芳,龚春风,刘鹏,等.锰胁迫下龙葵和小飞蓬根叶中植物螯合肽和类金属硫蛋白的变化[J].环境科学学报,2010,30(10):2058-2064
Wu H F,Gong C F,Liu P,et al.Phytochelatins and metallothionein-like protein inSolanum nigrumL.andConyza canadensisL.roots and leaves under Mn stress[J].Acta Scientiae Circumstantiae,2010,30(10):2058-2064(in Chinese)
[35] Guo W J,Bundithya W,Goldsbrough P B.Characterization of theArabidopsismetallothionein gene family:Tissue-specific expression and induction during senescence and in response to copper[J].New Phytologist,2003,159 (2):369-381
[36] Sigel H,Sigel A,Sigel R K O,et al.Metallothioneins and Related Chelators[M].London:Royal Society of Chemistry Publishing,2009:107-149
[37] Loebus J,Leitenmaier B,Meissner D,et al.The major function of a metallothionein from the aquatic fungus Heliscus lugdunensisis cadmium detoxification[J].Journal of Inorganic Biochemistry,2013,127(29):253-260
[38] Singh R K,Anandhan S,Singh S,et al.Metallothioneinlike gene fromCicer microphyllumis regulated by multiple abiotic stresses[J].Protoplasma,2011,248(4):839-847◆
Effect of Cs+on Phytochelatins and Metallothionein in Seedlings of Brassica juncea and Cichorium intybus
He Jiao1,He Yu1,Huang Chuqiao1,Han Na1,Tao Zongya1,*,Wu Guo1,Luo Xuegang2
1.Life Science College,Sichuan Normal University,Chengdu 610101,China
2.Engineering Research Center of Biomass Materials(SWUST),Ministry of Education,Mianyang 621010,China
13 November 2015 accepted 11 March 2016
This study seeks to investigate the relationship between Cs toxicity and the content of phytochelatins (PCs)and metallothionein(MT)inBrassica junceaandCichorium intybu.We subjected seedlings at the two-leaf stage to different doses of Cs+[ρ(Cs+)0-200 mg·L-1]for two to nine days.Next,we analyzed the dry biomass,and the content of Cs+,PCs and MT in the over-ground and the root.The results show that the dry biomass of over-ground and root decreased in both plants when Cs+concentration increased(P<0.05).However,the decrease of dry biomass induced by Cs+followed the order asCichorium intybu>Brassica juncea.With the increase in Cs+concentration,the accumulation content of Cs in both plants increased significantly(P<0.05).The capacity for accumulation for Cs+showed that:Brassica juncea>Cichorium intybu.The root ofCichorium intybuis the main accumulation organ for Cs+,but the over-ground is the main accumulation organ inBrassica juncea.With the increase of Cs+,the content of non-protein thiol(NPT),PCs,gultathione(GSH),and MT first increasd and then decreasd,and the content of both plants maximized when the concentration of Cs+reached 100 mg·L-1.Further analysis shows that the roots had a higher content of NPT,GSH and MT than over-ground in both plants,andBrassica junceahad a higher content thanCichorium intybu.Our findings show that Cs+tolerance inBrassica junceawas higher than that inCichorium intybu.Cs+can induce the synthesis of PCs,GSH,and MT inBrassica junceawhen the plants have accumulated excessive Cs+.
Cs+;Brassica juncea;Cichorium intybus;non-protein thiol;phytochelatins;gultathione;metallothionein
2015-11-13 录用日期:2016-03-11
1673-5897(2016)3-272-09
X171.5
A
10.7524/AJE.1673-5897.20151113001
简介:陶宗娅(1957-),女,博士,教授,研究方向为植物逆境生理生化与分子生物学,发表学术论文40余篇。
国家核设施退役及放射性废物治理重点项目(14ZG6101);四川师范大学校级青年项目(14qn07);四川省教育厅大学生创新创业训练计划项目(201510636076)
何娇(1990-),女,四川凉山人,硕士研究生,研究方向为植物逆境生理生化,E-mail:305508974@qq.com;
*通讯作者(Corresponding author),E-mail:t89807596@163.com

