2-巯基噻唑啉与过氧化氢酶的相互作用机理研究
黄鸣,邹路易,*,滕跃,杜宪正,房晓燕
1.江南大学环境与土木工程学院江苏省厌氧生物技术重点实验室,无锡214122
2.临沂市农业环境保护监测站,临沂276001
2-巯基噻唑啉与过氧化氢酶的相互作用机理研究
黄鸣1,邹路易1,*,滕跃1,杜宪正1,房晓燕2
1.江南大学环境与土木工程学院江苏省厌氧生物技术重点实验室,无锡214122
2.临沂市农业环境保护监测站,临沂276001
2-巯基噻唑啉是一种被广泛应用的抗腐蚀剂和光亮剂,然而它的一些残留物会对环境造成损坏,为探究2-巯基噻唑啉的毒性作用,采用光谱学技术和分子对接技术来考察2-巯基噻唑啉和过氧化氢酶的相互作用影响,其中酶活性实验表明2-巯基噻唑啉会抑制过氧化氢酶的活性,分子对接结果显示2-巯基噻唑啉会结合在过氧化氢酶的活性位点处,并最终导致过氧化氢酶空间结构和微环境的变化,根据荧光测试结果,表明2-巯基噻唑啉和过氧化氢酶之间的猝灭方式为静态猝灭。通过测量不同温度下的结合位点数、结合常数以及热力学常数,显示2-巯基噻唑啉与过氧化氢酶主要通过氢键和范德华力相结合。该研究从分子水平上考察了2-巯基噻唑啉对蛋白质的毒性作用,对于阐明污染物的毒性机理具有重要意义。
2-巯基噻唑啉;过氧化氢酶;多种光谱技术;分子对接
黄鸣,邹路易,滕跃,等.2-巯基噻唑啉与过氧化氢酶的相互作用机理研究[J].生态毒理学报,2016,11(3):258-264
Huang M,Zou L Y,Teng Y,et al.Interaction mechanism between 2-mercaptothiazoline and catalase[J].Asian Journal of Ecotoxicology,2016,11(3): 258-264(in Chinese)
过氧化氢酶(catalase,CAT)是一种大量存在于肝脏中的氧化还原酶,能催化H2O2分解成H2O和O2,从而清除在细胞中的H2O2,使其不再进一步产生毒性很大的羟基自由基,是一种重要的肝脏保护酶[1]。近来有研究报道过氧化氢酶和某些肿瘤、糖尿病、衰老及氧化应激有关,但其机理尚不明确[2-3]。
2-巯基噻唑啉(2-mercaptothiazoline,2-MT)是一种杂环有机化合物,可作为一种抗腐蚀剂,光亮剂,橡胶抗氧化剂广泛应用于各种工业生产中[4],据报道,该物质存在于江河、城市径流等环境中,因此,2-巯基噻唑啉及其残留物会对环境造成危害[5]。2-巯基噻唑啉对实验动物的毒性作用已有较多的报道,其对哺乳动物的甲状腺具有显著毒性[6]。然而从分子水平评价2-巯基噻唑啉对免疫系统关键酶的毒性影响尚未见报道,本文采用多种光谱技术和分子对接法研究了2-巯基噻唑啉对过氧化氢酶的毒性作用机理,通过探讨2-巯基噻唑啉对过氧化氢酶的活性和骨架结构的影响,以及两者之间的结合位点,结合常数和作用力类型,本研究可以将为评价2-巯基噻唑啉的毒性提供基础数据和参考。
1 材料与方法(Materials and methods)
1.1 实验材料
过氧化氢酶(取自牛肝)购于美国Sigma公司,配制成1.0×10-5mol·L-1的储备液,放置在0~4℃的冰箱中保存。2-巯基噻唑啉购于国药集团化学试剂有限公司,配制成1.0×10-3mol·L-1的储备液于0~4℃的冰箱中保存。0.2 mol·L-1磷酸缓冲盐溶液(pH 7.4)作为缓冲溶液,购于国药集团化学试剂有限公司。其他试剂均为分析纯,实验用水为超纯水。
1.2 试验方法
1.2.1 过氧化氢酶活性测定
过氧化氢酶活性可以利用分光光度法测定过氧化氢溶液在240 nm处的吸光度的变化,过氧化氢酶活性抑制率可以通过以下公式计算得到[7]:

ΔA1和ΔA0是在2-巯基噻唑啉分别存在和不存在时,过氧化氢溶液在240 nm处2 min内吸光度的变化值。
1.2.2 紫外可见吸收光谱
UV-6100双光路紫外可见分光光度计(上海美谱达仪器有限公司),用于紫外可见吸收光谱的测量,狭缝宽度为2 nm,扫描范围为200~240 nm。
1.2.3 荧光光谱
RF-5301PC分子荧光分光光度计(日本Hitachi公司)用于所有荧光光谱的测量,激发波长为280 nm,激发和发射光狭缝均为5 nm,扫描范围为280~500 nm。
同步荧光测量的波长差Δλ分别为15 nm(扫描范围为260~340 nm)和60 nm(扫描范围为300~400 nm),激发和发射光狭缝均为5 nm。
1.2.4 圆二色谱
MOS-450/AF-CD圆二色谱仪(法国Bio-Logic公司)用来测定CD光谱值,宽带为4 nm,扫描范围为200~260 nm,扫描速度为1 nm·2s-1。
1.2.5 分子对接
分子对接利用AutoDock 4.2软件完成,过氧化氢酶的分子结构(1TGU.pdb)从Protein Data Bank数据库获得[8],2-巯基噻唑啉分子的3D结构从网站(http://zink.docking.org/)下载[9]。利用AutoDock软件探索了2-巯基噻唑啉的中心位置和可旋转键,对过氧化氢酶进行去水、加氢、加电荷的操作,在过氧化氢酶分子上设置模拟范围后,选取LGA的计算方法进行分子对接的模拟计算,最后选取结合自由能最低的构象用于后续分析。
2 结果与讨论(Results and discussion)
2.1 2-巯基噻唑啉对过氧化氢酶活性影响
2-巯基噻唑啉对过氧化氢酶的活性影响见图1[10],从图中可以看出,对于每一组染毒时间,随着2-巯基噻唑啉浓度的增加,过氧化氢酶的活性是降低的。另外,当2-巯基噻唑啉不存在的时候,可以发现,染毒时间对过氧化氢酶的活性没有影响,但是,当2-巯基噻唑啉存在时,染毒时间就会影响过氧化氢酶的活性。对于浓度为3×10-5mol·L-1和1× 10-4mol·L-1的2-巯基噻唑啉,当染毒时间达到120 min时,发现过氧化氢酶的相对活性分别下降至最初的(0 min)78.6%和84.3%,由此我们可以得出,2-巯基噻唑啉的浓度和染毒时间都会对过氧化氢酶的活性产生显著影响。

图1 2-巯基噻唑啉对过氧化氢酶的活性影响图

图2 不同浓度2-巯基噻唑啉下过氧化氢酶的紫外可见吸收光谱图

图3 过氧化氢酶的同步荧光光谱图
2.2 过氧化氢酶空间结构变化的研究
2.2.1 紫外可见吸收光谱
紫外可见吸收光谱是一种可以用来探索蛋白质骨架结构变化的方法,我们可以从图2中看出,在205 nm处过氧化氢酶有很强的一个吸收峰,随着2-巯基噻唑啉的浓度不断增加,过氧化氢酶的最大吸收峰的值不断降低,并伴有红移,表明2-巯基噻唑啉对过氧化氢酶的骨架结构有影响,并使过氧化氢酶的骨架变得松散[11]。
2.2.2 同步荧光光谱
同步荧光能够灵敏地反映生色团微环境的变化[12]。通过固定激发与发射的波长差(Δλ),采用同步扫描激发和发射器,就可以得到同步荧光光谱图,它可以用来判断蛋白质的结构变化,当固定波长差(Δλ)分别为15 nm和60 nm时,扫描得到的同步荧光光谱给出的分别是酪氨酸和色氨酸的特征信息[13-14]。图3a显示随着2-巯基噻唑啉浓度的增加,发射峰的位置几乎没有发生明显的移动,由此可以看出2-巯基噻唑啉与过氧化氢酶作用之后对酪氨酸残基所处的微环境作用影响不大。图3b可以看出随着2-巯基噻唑啉浓度的增加,发射峰有了明显的红移(335.5~343.6 nm),红移说明了过氧化氢酶的结构发生了变化,色氨酸微环境的亲水性增强。

图4 2-巯基噻唑啉和过氧化氢酶作用后的CD光谱图
2.2.3 圆二色谱
圆二色谱可以较准确地反映蛋白质二级结构的变化。从图4中可以看出,过氧化氢酶的CD光谱在208 nm和222 nm处有2个负峰,它反映的是蛋白质α螺旋的特征信息[15]。然后我们利用CDPro软件可以得出过氧化氢酶分子中α螺旋,β折叠以及无规则卷曲的含量。从表1可以看出随着2-巯基噻唑啉浓度的增大,α螺旋降低了0.7%,β折叠增加了0.4%,这就说明2-巯基噻唑啉过氧化氢酶二级结构产生了一定的影响,使其二级结构发生改变[16]。
2.2.4分子对接
为了确定2-巯基噻唑啉在过氧化氢酶上的具体结合位置,本实验采用分子对接的方法来对两者的结合位置进行模拟。图5a为2-巯基噻唑啉在过氧化氢酶分子上最可能的结合位置,从图中可以看出2-巯基噻唑啉结合在过氧化氢酶D链的活性位点附近,这可能会影响过氧化氢酶的催化活性。图5b为两者结合位点的局部图,分子对接结果表明2-巯基噻唑啉与过氧化氢酶的主要作用力为氢键和范德华力,在2-巯基噻唑啉分子上的H原子与过氧化氢酶A链GLU70氨基酸残基上的OE1原子间存在氢键作用,在二者的结合的过程中也存在静电力和疏水力,但氢键和范德华力起主要作用。

图5 2-巯基噻唑啉与过氧化氢酶的结合位置(a)和两者结合的局部(b)图(虚线表示氢键作用)

表1 2-巯基噻唑啉对过氧化氢酶二级结构含量变化的影响Table 1 Effects of 2-MT on the percentage of secondary structural elements in CAT at 291 K
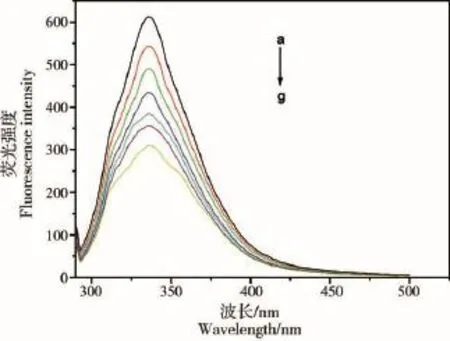
图6 2-巯基噻唑啉对过氧化氢酶荧光强度的影响

图7 在不同温度下2-巯基噻唑啉与过氧化氢酶作用后的Stern-Volmer图
2.3 过氧化氢酶与2-巯基噻唑啉的结合特性
2.3.1 荧光猝灭
过氧化氢酶在330 nm处具有较强的荧光峰(见图6),随着2-巯基噻唑啉浓度的增加,过氧化氢酶的荧光峰强度不断下降,说明2-巯基噻唑啉对过氧化氢酶的荧光具有猝灭作用,二者之间存在相互作用。荧光猝灭分为静态猝灭和动态猝灭。本实验根据Stern-Volmer方程进一步判断荧光猝灭的类型[17]。

式中F0和F分别为未加入和加入猝灭剂时的荧光强度,KSV为Stern-Volmer猝灭常数,kq为猝灭速率常数,τ0为无猝灭剂存在时荧光分子的平均寿命(其值为10-8s[18]),[Q]为猝灭剂的浓度。
当猝灭常数随着温度的升高而增大,则猝灭类型为动态猝灭。当猝灭常数随着温度的升高而减小,则为静态猝灭。从表2可以看出KSV随着温度的升高而下降,可以判断2-巯基噻唑啉对过氧化氢酶的猝灭类型为静态猝灭。而且,动态猝灭常数的最大值为2.0×1010L·mol-1·s-1[19],在本实验中,不同温度下的Kq值都远大于2.0×1010L·mol-1·s-1,从而进一步验证了2-巯基噻唑啉对过氧化氢酶的猝灭类型为静态猝灭。
2.3.2 结合常数
对于静态猝灭,小分子和蛋白质的结合常数和结合位点数可以通过以下公式得到[20]:

式中F0,F和[Q]与公式(2)的表示一致,Ka为结合常数,n为结合位点数。
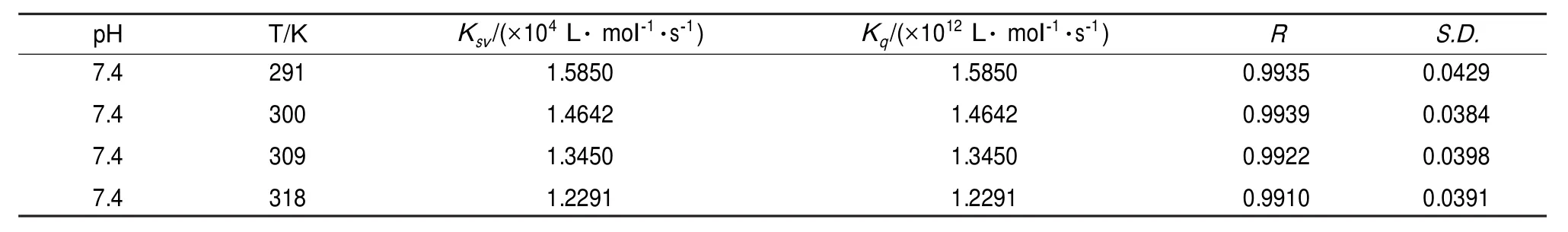
表2 在不同温度下2-巯基噻唑啉与过氧化氢酶相互作用的Stern-Volmer猝灭常数Table 2 Stern-Volmer quenching constants for the interaction of 2-MT with CAT at different temperatures
由表中数据可知,在不同温度下的Ka和n值,n值约为1,表明二者的结合位点数为1,即二者以约1:1的比例结合,Ka值反映了二者之间的作用力较强[21]。
2.3.3 作用力判断
小分子与生物大分子之间的作用力包括很多类型,包括氢键、范德华力、静电引力、疏水作用力等,在本试验中模拟的是生物体内环境,因此条件比较温和温度变化不大,反应的焓变ΔHo可视作常数,可以根据热力学公式计算出小分子与生物大分子作用间的相关热力学参数。

其中K等同于公式(3)中的Ka,R为理想气体常数。
Ross等[22]根据大量的试验结果,总结出了小分子与生物大分子作用的有关热力学参数可以简单判断其相互作用类型:若ΔHo>0及ΔSo>0主要表现为疏水作用;ΔHo<0及ΔSo>0要表现为静电作用;ΔHo<0及ΔSo<0主要表现氢键或者范德华作用。
根据表3所示的结合常数Ka,带入公式(4)(5)计算,并以lnK对T-1作图8求得二者结合过程的热力学函数列于表3。从表3数据可以看出ΔGo值为负值,说明2-巯基噻唑啉与过氧化氢酶的结合作用是自发进行[23],ΔHo和ΔSo值均为负值说明2-巯基噻唑啉与过氧化氢酶之间主要通过氢键和范德华力相互结合。
本文利用了光谱和分子对接技术研究了2-巯基噻唑啉对过氧化氢酶的分子毒性作用机理,结果表明,2-巯基噻唑啉通过氢键和范德华力自发地与过氧化氢酶按1:1的比例相结合,结合在过氧化氢酶的活性位点处附近,从而导致过氧化氢酶的空间结构发生改变,并对过氧化氢酶的活性产生抑制作用。该研究为从分子水平上考察2-巯基噻唑啉的毒性作用机理,也为2-巯基噻唑啉的环境风险评价提供了重要依据。

图8 2-巯基噻唑啉与过氧化氢酶作用的van't Hoff图

表3 过氧化氢酶和2-巯基噻唑啉体系的结合常数与热力学参数Table 3 Binding constants and relative thermodynamic parameters of the 2-MT-CAT system
(References):
[1] Gaetani G F,Ferraris A M,Rolfo M,et al.Predominant role of catalase in the disposal of hydrogen peroxide within human erythrocytes[J].Blood,1996,87(4):1595-1599
[2] Gonenc A,Hacisevki A,Aslan S,et al.Increased oxidative DNA damage and impaired antioxidant defense system in patients with gastrointestinal cancer[J].European Journal of Internal Medicine,2012,23(4):350-354
[3] Noguer M A,Cerezo A B,Navarro E D,et al.Intake of alcohol-free red wine modulates antioxidant enzyme activities in a human intervention study[J].Pharmacological Research,2012,65(6):609-614
[4] Abbehausen C,de Paiva R E F,Formiga A L B,et al. Studies of the tautomeric equilibrium of 1,3-thiazolidine-2-thione:Theoretical and experimental approaches[J]. Chemical Physics,2012,408(1):62-68
[5] Khramov A,Voevodin N N,Balbyshev V N,et al.Solgel-derived corrosion-protective coatings with controllable release of incorporated organic corrosion inhibitors[J]. Thin Solid Films,2005,483(1):191-196
[6] Kawasaki Y,Umemura T,Saito M,et al.Toxicity study of a rubber antioxidant,2-mercaptobenzimidazole,by repeated oral administration to rats[J].The Journal of Toxicological Sciences,1998,23(1):53-68
[7] Chi Z X,Liu R T,Zhang H.Potential enzyme toxicity of oxytetracycline to catalase[J].Science of the Total Environment,2010,408(22):5399-5404
[8] Cao Z Z,Liu R T,Yang B J.Potential toxicity of sarafloxacin to catalase:Spectroscopic,ITC and molecular docking descriptions[J].Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy,2013,115(1): 457-463
[9] Irwin J J,Sterling T,Mysinger M M,et al.ZINC:A free tool to discover chemistry for biology[J].Journal of Chemical Information and Modeling,2012,52(7):1757-1768
[10] 陈海燕,海热提,李千婷.废塑料资源化产品对土壤中过氧化氢酶和脲酶活性的影响[J].生态毒理学报, 2009,4(6):874-880
Chen H Y,Hai R T,Li Q T.Effect of waste plastics recycling products on activities of soil catalase and urease[J]. Asian Journal of Ecotoxicology,2009,4(6):874-880(in Chinese)
[11] Wu Y H.Study on the interaction between salicylic acid and catalase by spectroscopic methods[J].Journal of Pharmaceutical and Biomedical Analysis,2007,44(3): 796-801
[12] Wang Y,Chen S,Yang D,et al.Stem cell transplantation: A promising therapy for Parkinson's disease[J].Journal of Neuroimmune Pharmacology,2007,2(3):243-250
[13] Teng Y,Ji F Y,Li C,et al.Interaction mechanism between 4-aminoantipyrine and the enzyme lysozyme[J]. Journal of Luminescence,2011,131(12):2661-2667
[14] Guo M,Lu W J,Li M H,et al.Study on the binding interaction between carnitine optical isomer and bovine serum albumin[J].European Journal of Medicinal Chemistry,2008,43(10):2140-2148
[15] Lu J Q,Jin F,Sun T Q,et al.Multi-spectroscopic study on interaction of bovine serum albumin with lomefloxacin-copper(II)complex[J].International Journal of Biological Macromolecules,2007,40(4):299-304
[16] Huang B X,Kim H Y,Dass C.Probing three-dimensional structure of bovine serum albumin by chemical crosslinking and mass spectrometry[J].Journal of the American Society for Mass Spectrometry,2004,15(8):1237-1247
[17] 刘保生,王晶,薛春丽,等.头孢噻肟钠和氯霉素与牛血清白蛋白相互作用的荧光光谱分析[J].发光学报, 2011,32(6):628-635
Liu B S,Wang J,Xue C L,et al.Fluorescence analysis of the interaction between cefotaxime sodium and chloramphenicol as well as bovine serum albumin[J].Chinese Journal of Luminescence,2011,32(6):628-635(in Chinese)
[18] 屈凌波,白希希,冉瑜,等.光谱法比较喜树碱与溶菌酶、过氧化氢酶的相互作用[J].分析测试学报,2012, 31(6):644-650
Qu L B,Bai X X,Ran Y,et al.Spectroscopic comparison of the interactions of camptothecin with lysozyme and catalase[J].Journal of Instrumental Analysis,2012,31(6): 644-650(in Chinese)
[19] 冯喜增,白春礼,林璋,等.吖啶橙与牛血清蛋白的相互结合反应[J].分析化学,1998,26(2):154-157
Feng X Z,Bai C L,Lin Z,et al.The interaction between acridine orange and bovine serum albumin[J].Chinese Journal of Analytical Chemistry,1998,26(2):154-157(in Chinese)
[20] Paramaguru G,Kathiravan A,Selvaraj S,et al.Interaction of anthraquinone dyes with lysozyme:Evidences from spectroscopic and docking studies[J].Journal of Hazardous Materials,2010,175(1):985-991
[21] 傅丽君,钟开新,李华亮.波尔多液对土壤过氧化氢酶活性与构象的影响[J].生态毒理学报,2009,4(4):584-590
Fu L J,Zhong K X,Li H L.Effect of Bordeaux mixture on soil catalase activity and conformation characteristics [J].Asian Journal of Ecotoxicology,2009,4(4):584-590 (in Chinese)
[22] Ross P D,Subramanian S.Thermodynamics of protein association reactions:Forces contributing to stability[J]. Biochemistry,1981,20(11):3096-3102
[23] Chi Z X,Liu R T,Teng Y,et al.Binding of oxytetracycline to bovine serum albumin:Spectroscopic and molecular modeling investigations[J].Journal of Agricultural and Food Chemistry,2010,58(18):10262-10269◆
Interaction Mechanism between 2-Mercaptothiazoline and Catalase
Huang Ming1,Zou Luyi1,*,Teng Yue1,Du Xianzheng1,Fang Xiaoyan2
1.Jiangsu Key Laboratory of Anaerobic Biotechnology,School of Environmental and Civil Engineering,Jiangnan University,Wuxi 214122,China
2.Linyi Agricultural Environmental Protection Monitoring Station,Linyi 276001,China
12 September 2015 accepted 11 November 2015
2-Mercaptothiazoline(2-MT)is a kind of widely used corrosion inhibitor and brightener.The residue of 2-MT in the environment is potentially harmful.To evaluate the toxicity of 2-MT at the protein level,the effects of 2-MT on catalase(CAT)were investigated by multiple spectroscopic techniques and molecular modeling.The enzyme activity experiment indicated that the CAT activity was inhibited by 2-MT.Molecular docking results revealed that 2-MT bound into the CAT active site,which further led to some secondary structure and micro-environmental changes of CAT.According to the fluorescence results,the quenching mechanism of fluorescence of CAT by 2-MT was a static quenching procedure.The number of binding sites n,the binding constant k and the thermodynamic parameters at different temperatures were also measured.The results indicated that 2-MT can interact with CAT to form a complex mainly by van der Waals'interactions and hydrogen bonds.In this paper,we studied the toxic mechanism between 2-mercaptothiazoline and protein at the molecular level,which will consequently be significantto learn the toxic effect of pollutants.
2-mercaptothiazoline;catalase;multi-spectroscopic techniques;molecular docking
2015-09-12 录用日期:2015-11-11
1673-5897(2016)3-258-07
X171.5
A
10.7524/AJE.1673-5897.20150912001
简介:邹路易(1964-),男,副教授,硕士生导师,主要研究方向为环境污染防治。
国家自然科学基金(21307043)
黄鸣(1991-),男,硕士研究生,研究方向为环境毒理学,E-mail:1074982512@qq.com
*通讯作者(Corresponding author),E-mail:lyzou@jiangnan.edu.cn

