比较两种RAD54启动子调控的全酵母发光细胞对化学诱变原的评价效果
田永杰,徐秀举,陆益新,王超,周天祺,李湘鸣
扬州大学医学院预防医学教研室,扬州225001
比较两种RAD54启动子调控的全酵母发光细胞对化学诱变原的评价效果
田永杰,徐秀举,陆益新,王超,周天祺,李湘鸣*
扬州大学医学院预防医学教研室,扬州225001
通过分子生物学技术构建2种不同RAD54启动子调控的yEGFP重组报告载体pRAD54-yEGFP和pRAD54S-yEGFP,前者启动子DNA为1.8 kb,后者为0.5 kb,分别转入W303-1A酵母细胞,构建2种启动子调控的发光酵母细胞,用不同化学诱变原作用后,用流式细胞仪和多功能发光仪测定酵母的发光强度。结果发现2种启动子调控的酵母细胞的发光强度均与化学诱变原(甲磺酸甲脂、4-硝基-N-氧化喹啉和5-氟尿嘧啶)有明显的剂量效应关系,但是W303-1A/RAD54-yEGFP剂量效应关系较为明显,产生的最大诱导倍数(5.96、2.19和2.71)明显高于W303-1A/RAD54S-yEGFP所产生的最大诱导倍数(2.53、1.50和1.91),可能与启动子序列中转录因子的数量以及转录因子间协同增效作用有关。同时发现,流式细胞仪测定效果明显优于发光仪测定效果。所以在构建RAD54启动子调控重组酵母细胞筛选诱变时,选用全启动子序列效果较好。
化学诱变原;RAD54启动子;酵母细胞;绿色荧光蛋白;剂量效应关系
田永杰,徐秀举,陆益新,等.比较两种RAD54启动子调控的全酵母发光细胞对化学诱变原的评价效果[J].生态毒理学报,2016,11(3):251-257
Tian Y J,Xu X J,Lu Y X,et al.The comparison of bioassay for chemical mutagens between the two RAD54 promoters regulating whole fluorescent yeast cells[J].Asian Journal of Ecotoxicology,2016,11(3):251-257(in Chinese)
DNA毒性化合物(化学诱变物,简称诱变物)是指一大类可对生物大分子遗传物质产生毒性的化合物。这类化合物所造成的环境污染潜在性危害较大,因为其多数具有致癌性。随着我国经济的发展,新化学物在不断的出现,需要评价致突变性的化学物数量剧增,但是现行标准的体外致突变实验费时、成本高,远不能满足需求,迫切需要发展快速的高通量方法。因此,建立高效、快速、自动化、敏感、相对可靠、高通量地筛选这类化合物的评价方法,具有十分重要的现实意义。
酿酒酵母细胞的RAD54基因位于第七号染色体上,编码区全长约3 613 bp,开放性阅读框(ORF)为2 694 bp[1],通过对GenBank中RAD54基因组的检索发现RAD54基因的上游是SUT1基因,下游是YRB30基因,在RAD54基因和SUT1基因之间分别是两者的启动区,大小约1.8 kb。RAD54蛋白是致DNA断裂诱变原诱导的一种特异性表达的酵母蛋白,对该基因突变会使细胞对X-射线等致DNA断裂诱变原的敏感性大大增加。有学者认为该基因与DNA的损伤后的同源重组修复有关,因为许多化学诱变原均会诱导酵母细胞RAD54基因高效表达[2]。进一步研究发现,当化学诱变原作用于酵母细胞造成双股DNA断裂时,会使许多有关DNA修复基因的表达量大大增加[3]。因此,许多学者利用分子生物学技术,将RAD54启动子与报告基因相融合,构建成重组酵母细胞,用于高通量筛选化学诱变原[4-6]。但是,由于RAD54基因的启动子范围目前仍然没有完全研究清楚,在构建重组酵母细胞,用于快速高通量筛选化学诱变原,所选用的启动区范围均不相同。有的选用RAD54基因和SUT1基因之间的全部序列作为启动子[7-9];有的则选用-500 bp以下的DNA序列作为启动子[10-11]。启动子不同对化学诱变原的筛选敏感性则不同。两者何者用于对化学诱变原的筛选效果较好,目前国内外未见报道。因此,研究比较2种启动子对化学诱变原筛选的敏感性,对选用何种重组酵母细胞对化学诱变进行筛选,具有现实的指导意义。
1 材料与方法(Materials and methods)
1.1 材料
质粒pLZ-yEGFP,大肠杆菌DH5α,酵母W303-1A(基因型:MATα,leu 2-3,112 ura3-1,trp1-1,his3-11,15 ade2-1)由本实验室保存(扬州大学医学院卫生毒理学实验室);限制性内切酶和T4连接酶购自TaKaRa公司;所用质粒提取试剂盒和纯化试剂盒来自AxyGen公司;用普通琼脂糖凝胶DNA纯化回收试剂盒购自天根生化科技(北京)有限公司;倒置荧光显微镜(尼康Ti-U)由日本Nikon公司生产;多功能酶标仪(Bio-Tek Synergy2)由美国伯腾公司生产;引物由中科华大博科生物科技有限公司合成。
1.2 方法
1.2.1 RAD54全启动子调控的yEGFP报告载体的构建
1.2.1.1 RAD54全启动子克隆
根据文献[12]报道的方法提取酵母基因组,根据GenBank所报道的RAD54启动子序列以酵母基因为模板,PCR扩增RAD54启动子。由于RAD54启动子较长,加之在(242 bp和1 393 bp)处有Hind III酶切位点,故采用分段的方法扩增RAD54启动子。首先扩增上1/2片段,引物设计为上游5′-AAAAAGCTT GAAGTTTAGATGAGTAAGGAA-3′,下游为5′-TAGGGATCCTAATACGGTATAACGTAAACC-3′,引物两端分别增设3个保护碱基及Hind III和BamH I两酶切位点(下划线所示);RAD54启动子下1/2片段引物设计为上游5′-TTAGGATCCCTATAAGGGTTCCTTCGGGAGGA-3′,下游5′-TCTACCGGTCAGTTATAAGGAAATATATATG-3′,引物两端分别增设BamH I和Age I两酶切位点(下划线所示)和保护碱基。
上1/2片段的PCR产物经DNA试剂盒回收纯化后,与pLZ-yEGFP一并用Hind III和BamH I酶切,将其与载体pLZ-yEGFP用T4连接酶相连,将所构建的载体命名为pRAD54-1-yEGFP;下1/2片段的PCR产物经纯化,与pRAD54-1-yEGFP一并用BamH I和Age I进行双切,并用T4连接酶相连,从而构建成RAD54全启动子调控的yEGFP酵母报告载体,将其命名为pRAD54-yEGFP(见图1)。
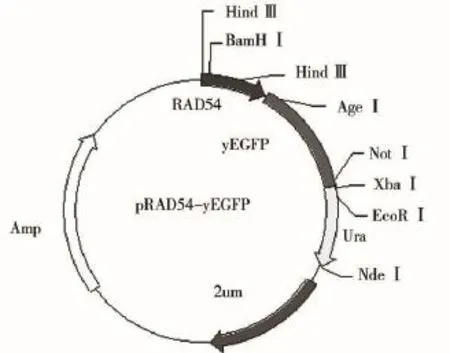
图1 pRAD54-yEGFP酵母报告载体
1.2.1.2 -500 bp RAD54启动子的克隆
划线接种pRAD54-yEGFP菌液于LB/AMP平板,37℃培养18~20 h。再挑取单克隆于5~6 mL的LB/AMP培养液中,37℃振荡培养过夜,用Axy-Gen试剂盒提取质粒,将pRAD54-yEGFP载体用Hind III进行酶切。酶切产物经1.0%琼脂糖电泳分析,用DNA纯化试剂盒切胶回收载体片段。经T4连接酶连接,连接产物转化于感受态DH5α,用LB/ Amp平板筛选出阳性转化子。挑取10个转化子克隆于LB/Amp培养液中,小量提取质粒进行酶切鉴定,测序,将所构建载体命名为pRAD54S-yEGFP(见图2)。
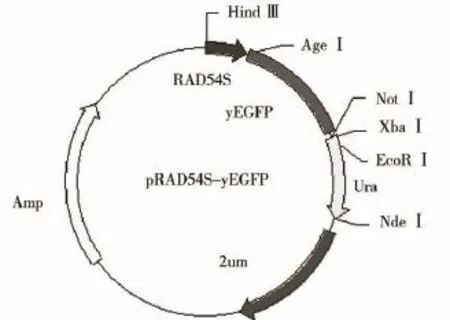
图2 pRAD54S-yEGFP酵母报告载体
1.2.2 RAD54和RAD54S启动子调控的重组yEGFP酵母细胞的建立
用醋酸锂方法分别将pRAD54-yEGFP和pRAD54S-yEGFP转化于感受态酵母细胞W303-1A,用SD/-ura选择性培养板筛选阳性克隆。提取酵母DNA,对重组酵母细胞进行PCR鉴定,引物分别选用yEGFP的上下游引物。在所挑取4个转化子克隆中发现有3个克隆中有yEGFP目的基因(约700 bp)(图片省略)。说明RAD54和RAD54S启动子调控的重组yEGFP发光酵母细胞的构建成功。
1.2.3 实验研究
根据文献[13-15]报道化学诱变原作用最佳时间为10~16 h,故用以下不同DNA作用水平的诱变原对细胞作用12 h,进行剂量效应研究。
(1)使DNA发生烷基化的诱变原:甲磺酸甲脂(methylmethanesulfonate,MMS),其终浓度为400、200、100、25、6.25、1.56和0 μg·mL-1。(2)使DNA发生断裂的诱变原:4-硝基-N-氧化喹啉(4-nitroquinoline-noxide,4-NQO),其终浓度为5、1.25、0.32、0.08、0.04、0.02和0 μg·mL-1。(3)抑制DNA合成酶或拓扑异构酶的诱变原:5-氟尿嘧啶(5-fluorouracil,5-F),其终浓度为500、250、62.5、16、4、1和0 μg·L-1。(4)非基因毒性物质:秋水仙碱(colchicine),其终浓度为250、125、62.5、31、16、4和0 μg·L-1。刀豆氨酸(canavanine)和四环素(tetracycline),其终浓度分别为100、50、25、6.25、1.6、0.4和0 μg·mL-1。以上各剂量组均设3个复孔,对照(0)均选用各自化学物的溶剂。
1.2.4 统计方法
用Excel软件对资料进行分析处理。多功能发光仪所测发光度用相对发光度表示(发光强度/ OD600);流式细胞仪测定10 000个细胞的平均发光强度[16];各剂量组复孔结果用均数±标准差表示;用诱导倍数描述剂量效应关系;诱导倍数为受试物浓度组所产生的发光度与空白对照发光度之比,其超过1.5倍并存在明显的剂量效应关系,可判断受试物为阳性[17]。
2 结果(Results)
2.1 荧光显微镜下观察
图3为2种不同RAD54启动子调控的重组酵母细胞经过MMS的诱导后,在荧光显微镜下观察结果,2种细胞均发出清晰、耀眼的荧光,呈散状分布,与对照明显不同。但是,在相同的放大倍数和相同的激发波长下,肉眼不能发现2种细胞的发光数量和亮度有明显差异。
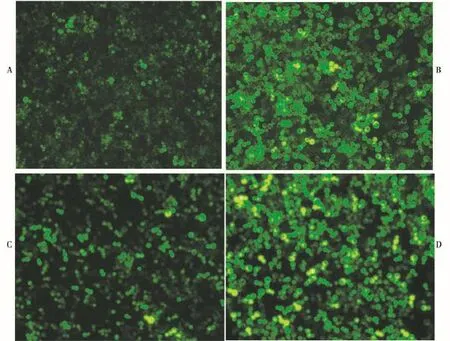
图3 在荧光显微镜下观察重组酵母细胞W303-1A/RAD54-yEGFP和W303-1A/RADS54-yEGFP
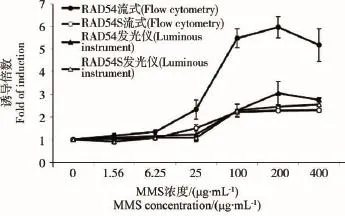
图4 MMS诱导浓度和重组酵母细胞发光度的剂量效应关系
2.2 DNA烷基化诱变原的评价
选用MMS作为这类化学物的代表。图4可见W303-1A/RAD54-yEGFP和W303-1A/RAD54S-yEGFP酵母细胞经MMS作用12 h后,细胞的发光度与MMS均有明显的剂量效应关系,并在200 μg· mL-1时效应达高峰。W303-1A/RAD54-yEGFP剂量效应较明显关系,最大诱导倍数达5.96,而W303-1A/RAD54S-yEGFP最大诱导倍数为2.53。同时也可看到,流式细胞仪测定方法的敏感性优于发光仪。
2.3 DNA发生断裂诱变原的评价
图5为使DNA发生断裂的诱变原4-NQO与2种RAD54启动子调控的yEGFP酵母细胞的剂量效应关系,从流式细胞仪所测结果来看,W303-1A/ RAD54-yEGFP与4NQO有明显的剂量效应关系,在0.04 μg·mL-1以上浓度组,诱导倍数均超过1.5,最高为2.19,而W303-1A/RAD54S-yEGFP虽然亦有剂量效应关系,但不及前者明显,最大诱导倍数仅为1.78。从用发光仪检测结果来看,W303-1A/RAD54-yEGFP在0.32 μg·mL-1以上组有一定的剂量效应关系,最大诱导倍数为1.74;虽然W303-1A/RAD54S-yEGFP在0.32 μg·mL-1以上浓度组诱导倍数明显升高,但是,由于细胞毒性的原因,其OD 600和yEGFP发光度已降至本底水平,分别为0.138和740,所以这种升高实际上是细胞毒性所致。
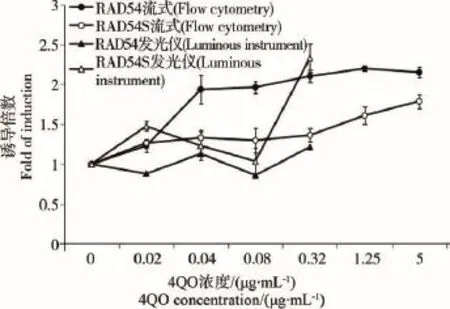
图5 4-硝基-N-氧化喹啉(4NQO)浓度和重组酵母细胞发光度的剂量效应关系
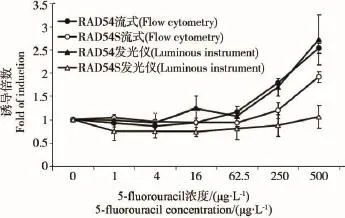
图6 5氟尿嘧啶诱导浓度和重组酵母细胞发光度的剂量效应关系
2.4 抑制DNA合成酶或拓扑异构酶诱变原的评价
图6所示为抑制DNA合成酶诱变原5-F对2种RAD54启动子调控的发光酵母细胞的实验结果,可见经12 h作用后,经流式细胞仪和发光仪测定,发现W303-1A/RAD54-yEGFP与5-F有剂量效应关系,最大诱导倍数分别为2.53和2.71,而W303-1A/RAD54S-yEGFP经用流式细胞仪检测发现有剂量效应关系,最高诱导倍数为1.91,但是,在用发光仪检测时,未发现有剂量效应关系。
2.5 非基因毒性化学物的评价
选用秋水仙碱、刀豆氨酸和四环素对细胞有毒性的非基因毒性化合物进行特异性研究,经用流式细胞仪和发光仪检测,以及荧光显微镜观察,均未发现2种细胞的发光度与对照有明显的差别(资料省略),说明两者均有较好的特异性。
3 讨论(Discussion)
当化学物使DNA损伤或合成阻断时,可同时诱导多个基因的转录表达,以提高细胞的修复能力。RAD54编码涉及发生DNA重组损伤修复的ATP酶,当外来诱变物使DNA发生重组后,RAD54可大量表达[18]。因此,国外许多学者将RAD54启动子与某些报告基因相融合,构建成重组酵母细胞,用于快速、高通量筛选化学诱变原,但是,所选启动子的大小却不尽相同。Cole等[8]将RAD54阅读框上游406 pb碱基(-406 bp)与Lac Z报告基因相融合,发现Lac Z基因的表达量,与DNA的损伤有关,并进一步研究发现在-406 bp内有一29 bp的DNA损伤调控序列(Damage Regulatory Sequence,DRS),对化学诱变原的反应起着至关重要的作用,它的缺失将会失去对诱变原的响应。所以,有些学者为了克隆方便,多选用-500 bp以内含有DRS的DNA序列作为启动子[2,10,19]。但是,也有学者选用RAD54开放性阅读框(ORF)上游和SUT1基因之间的全部序列(-1.8 kb区)作为启动子[8-9,20]。因此,比较2种启动子的敏感性,对指导诱变原的筛选具有十分重要的现实意义。
启动子是指一段能被RNA聚合酶特异性识别和结合,能正确有效地起始转录的一段DNA调控序列,一般位于基因5’端上游区域。在真核类基因的转录起始阶段,激活转录因子与基因上游的调控位点结合从而激活基因的转录。在真核基因的表达调控中,多数真核基因具有2个或2个以上的转录调控位点,单个位点的转录激活效率最低,多个调控位点对基因转录具有协同性[21]。本研究发现-1.8 kb区启动子所构建的重组酵母细胞,对诱变原的敏感性明显优于-500 bp所调控的酵母细胞。这是因为酵母高频转录基因的内含子中存在一些可能的转录正调控位点,如在RAD54启动子中有数个正向转录因子(ABF1 12个,TAF 11个,GCN4 4个,ADR1 2个,REB1 1个),而RAD54S中正向转录因子结合位点较少(ABF1 4个,TAF 3个,GCN4 1个)。2种启动子所调控的重组酵母细胞在对化学诱变原的评价敏感度上的差异这可能与正向转录因子的数量以及转录因子的协同增效作用有关[22-23]。
对诱变原的筛选敏感性除了与启动子的选择有关外,还与所使用的方法或仪器有关。发现用流式细胞仪的敏感性优于发光仪,这主要是流式细胞仪可以定量地观察一定细胞数量的发光强度,而发光仪所测的发光强度,受到细胞数量不同的影响,需要用OD 600进行校正[24],而当化合物对细胞的毒性较大时,会使OD 600低于0.300以下,从而造成较大的误差(如图5),因为,OD 600在大于0.300以上时,才能较好反映细胞的数量。
虽然用yEGFP作为报告基因有许多优点,但是,其发射峰位于培养基、组织培养器材及细胞成分等产生的荧光背景范围之内,许多凋亡的细胞也可产生荧光,故具有较高的“背景噪声”,所以,在进行荧光定量研究时,最好与倒置荧光显微镜结合起来,但是,用倒置荧光显微镜进行定性效果较好,因为,镜下所观察的发光强度通常受激发光的强度、曝光时间、放大倍数等因素的影响。
(References):
[1] Emery H S,Schild D,Kellogg D E,et al.Sequence of RAD54,aSaccharomyces cerevisiaegene involved in recombination and repair[J].Gene,1991,104(1):103-106
[2] Schmuckli-Maurer J,Heyer W D.Meiotic recombination in RAD54 mutants ofSaccharomyces cerevisiae[J]. Chromosoma,2000,109:86-93
[3] Samarajeewa D A,Sauls P A,Sharp K J,et al.Efficient detection of unpaired DNA requires a member of the Rad54-like family of homologous recombination proteins [J].Genetics,2014,198(3):895-904
[4] Siede W,Obermaier S,Eckardt F.Influence of different inhibitors on the activity of the RAD54 dependent step of DNA repair inSaccharomyces cerevisiae[J].Radiation and Environmental Biophysics,1985,24(1):1-7
[5] Walsh L,Schmuckli-Maurer J,Billinton N,et al.DNA-damage induction of RAD54 can be regulated independently of the RAD9-and DDC1-dependent checkpoints that regulate RNR2[J].Current Genetics,2002,41:232-240
[6] Kwon Y,Chi P,Roh D H,et al.Synergistic action of the Saccharomyces cerevisiaehomologous recombination factors Rad54 and Rad51 in chromatin remodeling[J].Molecular Genetics and Genomics,1999,260:551-558
[7] Tan T L,Kanaar R,Wyman C,et al.Rad54,a Jack of all trades in homologous recombination[J].DNA Repair, 2003,2(7):787-794
[8] Cole G M,Schild D,Lovett S T,et al.Regulation of RAD54-and RAD52-lacZ gene fusions inSaccharomyces cerevisiaein response to DNA damage[J].Molecular and Cellular Biology,1987,7(3):1078-1084
[9] Mazin A V,Mazina O M,Bugreev D V,et al.Rad54,the motor of homologous recombination[J].DNA Repair, 2010,9(3):286-302
[10] Cole G M,Mortimer R K.Failure to induce a DNA repair gene,RAD54,inSaccharomyces cerevisiaedoes not affect DNA repair or recombination phenotypes[J].Molecular and Cellular Biology,1989,9(8):3314-3322
[11] Zhang X P,Janke R,Kingsley J,et al.A conserved sequence extending Motif III of the motor domain in the Snf2-family DNA translocase Rad54 is critical for ATPase activity[J].PLOS ONE,2013,8(12):1-11
[12] 邢福国,张培军,谭训刚,等.酵母基因组的提取[J].食品科学,2007,28(3):210-211
Xing F G,Zhang P J,Tan X G,et al.The extraction of the yeast genome[J].Food Science,2007,28(3):210-211 (in Chinese)
[13] 王磊,罗方妮,谢云斌,等.RNR3调控的重组绿色荧光蛋白酵母细胞对化学诱变原的高通量筛选[J].毒理学杂志,2013,27(4):252-257
Wang L,Luo F N,Xie Y B,et al.The high throughput screening of mutagens based on the recombinant yEGFP yeast cells regulated by RNR3[J].Journal of Toxicology, 2013,27(4):252-257(in Chinese)
[14] 葛宜枝,王瑞鲲,王磊,等.RNR3调控重组Lac Z基因酵母细胞对化学诱变原的筛选[J].基础医学与临床, 2014,34(5):680-682
Ge Y Z,Wang R K,Wang L,et al.Screening of chemical mutagenesis by RNR3 Lac Z gene yeast cells[J].Basic& Clinical Medicine,2014,34(5):680-682(in Chinese)
[15] 谢云斌,罗方妮,王磊,等.RNR2调控的重组绿色荧光蛋白酵母细胞的构建及其对化学诱变原的高通量筛选[J].中国药理学与毒理学杂志,2013,27(3):398-403
Xie Y B,Luo F N,Wang L,et al.Construction of recombinant yEGFP yeast cells regulated by RNR2 and high throughput screening for chemical mutagens[J].Chinese Journal of Pharmacology and Toxicology,2013,27(3): 398-403(in Chinese)
[16] 赵泓,刘凡.流式细胞仪[J].安徽农学通报,2006,12 (12):39-41
Zhao H,Liu F.Flow cytometry[J].Anhui Agricultural Science Bulletin,2006,12(12):39-41(in Chinese)
[17] 王瑞鲲,葛宜枝,陆益新,等.筛选化学诱变原的RNR3调控重组Lac Z基因酵母细胞的建立[J].癌变畸变突变,2014,26(3):213-221
Wang R K,Ge Y Z,Lu Y X,et al.Development of recombinant Lac Z gene yeast cell regulated by RNR3 promoter for screening chemical mutagens[J].Carcinogenesis;Teratogenesis&Mutagenesis,2014,26(3):213-221 (in Chinese)
[18] Boronat S,Pina B.Development of RNR3-and RAD54-GUS reporters for testing genotoxicity inSaccharomyces cerevisiae[J].Analytical and Bioanalytical Chemistry, 2006,386(6):1625-1632
[19] Gonzalez-Alvarez M,Alzuet G,del Castillo L,et al. Genotoxic potential of N-(benzothiazolyl)sulfonamide copper(II)complexes on yeast cells transformed with yEGFP expression constructs containing the RAD54 or RNR2 promote[J].European Journal of Inorganic Chemistry,2006,19:3823-3834
[20] Billinton N,Barker M G,Michel C E,et al.Development of a green fluorescent protein reporter for a yeast genotoxicity biosensor[J].Biosensors&Bioelectronics,1998, 13:831-838
[21] Ptashne M,Gann A.Transcriptional activation by recruitment[J].Nature,1997,386(6625):569-577
[22] Carey M.The enhanceosome and transcriptional synergy [J].Cell,1998,92(1):5-8
[23] Carey M,Kolman J,Katz D A,et al.Transcriptional synergy by the Epstein-Barr virus transactivator zebra[J]. Journal of Virology,1992,66(8):4803-4813
[24] Griffith K L,Wolf R E Jr.Measuring beta-galactosidase activity in bacteria:Cell growth,permeabilization,and enzyme assays in 96-well arrays[J].Biochemical and Biophysical Research Communications,2002,290(1):397-402◆
Oxidative Damage and Cell Cycle Arrest in Rat C6 Astroglial Cells Induced by Tri-ortho-cresyl Phosphate
Tian Yongjie,Xu Xiuju,Lu Yixin,Wang Chao,Zhou Tianqi,Li Xiangming*
Preventive Medicine Department,Yangzhou Medical College,Yangzhou University,Yangzhou 225001,China
13 November 2015 accepted 4 May 2016
Two yEGFP yeast reporter vectors,pRAD54-yEGFP and pRAD54S-yEGFP,regulated by two RAD54 promoters,were constructed by a molecular biological technique.The DNA lengths of the two promoters are 1.8 and 0.5 kb.These two vectors were transformed into W301-A yeast cells to construct the whole fluorescent yeast cells regulated by the two RAD54 promoters,which were named as W303-1A/RAD54-yEGFP and W303-1A/ RAD54S-yEGFP.After that,the whole yeast cells were treated by different chemical mutagens(methylmethanesulfonate,4-nitroquinoline-noxide and 5-fluorouracil)and their fluorescent densities were measured on a flow cytometer and a multifunctional luminous instrument.The fluorescent densities from the two types of yeast cells both exhibit significant dose effect relationships with methylmethanesulfonate,4-nitroquinoline-noxide and 5-fluorouracil concentration.The dose effect relationships of W303-1A/RAD54-yEGFP are more obvious.The maximum fold ofinduction of W303-1A/RAD54-yEGFP are 5.96,2.19 and 2.71,while those of W303-1A/RAD54S-yEGFP are 2.53,1.50 and 1.91.Such differences may be related to the number and synergy of transcription factors.Meanwhile,the results from flow cytometry are more sensitive than that of the multifunctional luminous instrument. When constructing a recombinant yeast cell regulated by RAD54 promoter for screening mutagens,it is suggested to choose the whole sequence of the RAD54 promoter.
chemical mutagen;RAD54 promoter;yeast cell;yEGFP;dose effect relationship
2015-11-13 录用日期:2016-05-04
1673-5897(2016)3-251-07
X171.5
A
10.7524/AJE.1673-5897.20151113003
简介:李湘鸣(1957-),教授,硕士生导师,主要研究方向为现代分子生物学技术在预防医学中的应用。
国家自然科学基金(81041111)
田永杰(1989-),男,硕士研究生,研究方向为分子毒理学,E-mail:354097170@qq.com;
*通讯作者(Corresponding author),E-mail:847264344@qq.com

