微藻对壬基酚的响应及去除能效研究
孙凯峰,刘莉莉,孙东,刘伟杰,何宁,段舜山,*
1.暨南大学水生生物研究中心,广州510632
2.环境保护部华南环境科学研究所,广州510655
3.安徽大学江淮学院,合肥230039
微藻对壬基酚的响应及去除能效研究
孙凯峰1,2,刘莉莉1,3,孙东1,刘伟杰1,何宁1,段舜山1,*
1.暨南大学水生生物研究中心,广州510632
2.环境保护部华南环境科学研究所,广州510655
3.安徽大学江淮学院,合肥230039
分离筛选11种微藻开展微藻对NP暴露的响应特征和去除能效研究。NP对叶绿素a含量的96 h半抑制效应浓度(EC50)介于0.60~3.33 mg·L-1之间,EC50由小到大依次为:短棘盘星藻<羊角月牙藻<小球藻<衣藻<斜生栅藻<肥壮蹄形藻<卷曲纤维藻<二尾栅藻<惠氏微囊藻<四尾栅藻<蛋白核小球藻。除斜生栅藻、羊角月牙藻、肥壮蹄形藻、卷曲纤维藻之外,微藻的生长速率与EC50呈显著的正相关关系。EC50与细胞粒径、表面积以及体积总体上呈负相关关系,与微藻对NP的最大去除速率和半饱和常数呈正相关关系。NP的藻类去除过程符合一级反应动力学方程,且NP的半衰期与微藻起始总表面积呈显著的负相关关系。NP对微藻群落的影响与其浓度相关,其选择性干扰效应主要与微藻耐受性相关。NP耐受性高的种类多表现出高生长速率和去除能力。
壬基酚;微藻;急性毒性;生物去除
孙凯峰,刘莉莉,孙东,等.微藻对壬基酚的响应及去除能效研究[J].生态毒理学报,2016,11(3):226-236
Sun K F,Liu L L,Sun D,et al.Bioremoval of nonylphenol and variable responses of freshwater algae under nonylphenol exposure[J].Asian Journal of Ecotoxicology,2016,11(3):226-236(in Chinese)
壬基酚(nonylphenol,NP)是化学工业和有机合成工业中重要的中间体,广泛应用于塑料产品、洗涤剂、杀菌剂以及纺织业生产中。除合成过程中原料废渣直接排放外(约占0.5%),环境中NP主要来源于其前体物质NP聚氧乙烯醚(nonylphenol ethoxylates,NPEs)的天然降解或生物分解。近年来的研究表明,环境中的NP能够干扰水生动物正常内分泌物质的合成、释放、转运代谢和结合,并能改变内分泌系统的功能,破坏正常内分泌系统平衡和调控作用,成为公认的具有雌激素效应的内分泌干扰物(endocrine disrupting compounds, EDCs)之一[1-4]。环境中NP残留的调查研究多数认为,水环境中NP主要来源于人类活动直接排放或经过污水处理系统后排入。西班牙某城市污水处理厂出水口NP的浓度是(21.9±35)μg·L-1,而进水口浓度竟高达(102±150)μg·L-1[5]。NP在不同国家和地区水样、沉积物中的含量情况如表1所示。尽管存在调查方法和检测手段的差异,NP在水环境中的含量已远远超过美国国家环保局(EPA)2005年推荐的标准。

表1 壬基酚(NP)在环境中的分布和含量情况Table 1 Distribution of nonylphenol(NP)in water environment around the world
NP对浮游植物的毒性效应研究证实,NP暴露能够引起藻类叶绿素含量降低、抑制细胞分裂、改变细胞形态或细胞器形态及内含物增多等多种生理活性变化,进而导致藻细胞死亡。同时,低浓度NP暴露,藻类抗氧化系统中谷胱甘肽转移酶、抗坏血酸氧化酶和超氧化物歧化酶等活性显著提高;造成线粒体膜内外H+自由通过,破坏了正常氧化磷酸化所需的质子动力势[18-19]。环境内分泌干扰物三丁基锡[20]、四溴联苯醚[21]、六溴十二烷[22]、四溴双酚A[23]等对海洋微藻的毒性效应研究也有相应的报道,受试微藻对环境内分泌干扰物暴露的敏感性强弱存在显著的种间差异。AP的藻类去除研究表明[24-26],微藻对AP的去除过程不仅存在AP的被动吸附过程,同时也存在藻类对AP的主动转运过程。藻细胞壁由脂类、多糖、磷酸化蛋白等成分组成,表现出一定的疏水性特征,AP的强疏水性(NP的lgKow=4.48;OP的lgKow=4.12)也促使其快速吸附到细胞壁上。而后,NP可扩散溶入细胞壁脂类分子,也可能与糖类等分子结合,或进入胞内与胞内官能团结合。另外,也有研究表明,进入藻细胞内的NP存在不同程度的降解过程。可以推测,微藻对内分泌干扰物响应的差异不仅与化合物的结构有关,而且与化合物在藻细胞表面的吸附和富集特征有关。本文以环境内分泌干扰物NP为研究对象,对比研究NP的毒性效应在微藻的种属、形态等因子影响下的差异性,探明NP毒性效应与微藻种类、形态等的相关关系,并对NP的藻类去除能效进行探讨。揭示NP对水域生态系统浮游植物的选择性干扰效应规律,为NP的藻类生物去除技术和NP的生态毒性监测的指示生物筛选提供藻种资源和基础理论支持。
1 材料与方法(Materials and methods)
1.1 实验材料
NP(C9H19C6H4OH):优级纯,购自上海晶纯实业有限公司。实验用NP以丙酮为溶剂制备高浓度储备液。
实验藻种:分离自暨南大学明湖,经纯化培养保存于BG-11培养基中。实验选取惠氏微囊藻(Microcystiswesenbergii)、斜生栅藻(Scenedesmus obliquus)、四尾栅藻(Scenedesmus quadricanda)、二尾栅藻(Scenedesmus bicauda)、蛋白核小球藻(Chlorella pyrenoidosa)、小球藻(Chlorellasp.)、衣藻(Chlamydomonassp.)、短棘盘星藻(Pediastrum boryanum)、羊角月牙藻(Selenastrum capricornutum)、肥壮蹄形藻(Kirchneriella obesa)、卷曲纤维藻(Ankistrodesmus convolutus)为研究对象。受试微藻的形态学参数见附表1。微藻采用人工气候培养箱(CC275TL-2H, Xutemp)静置培养,每天摇瓶3次。培养条件设定为:温度(23±1)℃,光照强度80 μmol·(m2·s)-1,光周期为12 L:12 D。
1.2 实验方法
NP对微藻生长的干扰效应参考OECD(2006)的要求设定:将指数生长期的藻细胞浓缩后接种到50 mL玻璃管(Schott Duran,Germany)中,藻液终体积为35 mL。NP浓度为:0.10、0.16、0.25、0.40、0.63、1.00、1.59、2.52、4.00、6.30、10.06 mg·L-1,对照组和实验组丙酮体积(V/V)为0.1%,每组3个平行。短棘盘星藻起始细胞密度为0.7×105个·L-1,其余种类细胞密度约为2×105个·L-1。
微藻对培养基中NP的去除能效的实验安排如下:
(1)培养基中NP含量随时间变化趋势:藻类培养基中添加1 mg·L-1的NP,丙酮体积为总体积的1‰。混合均匀后分装到150 mL三角瓶中并依次间隔10 min接种处于指数生长期的11种微藻,然后再次分装40 mL加入NP后的藻液到50 mL玻璃管中进行试验,分别于0 min、10 min、30 min、1 h、6 h、12 h、24 h按照接种顺序取样5 mL,经0.45 μm的有机微孔滤膜过滤并收集滤液。滤膜用丙酮(1‰)清洗3次并合并滤液到带盖的螺口离心管(10 mL)中,并每组设3个平行,对照组为不接种微藻的BG-11培养基。
(2)微藻培养液中不同起始浓度NP的去除:藻类培养基中NP起始浓度分别为100、200、400、600、800、1 000 μg·L-1,丙酮体积为总体积的0.1%。依次间隔10 min接种处于指数生长期的微藻,摇匀后分装40 mL到50 mL玻璃管(Schott Duran,Germany)中进行试验,每组设3个平行,对照组为不接种微藻的BG-11培养基。60 min时按照接种顺序取5 mL藻液经0.45 μm的有机微孔滤膜过滤,滤膜用丙酮(1‰)清洗3次并合并滤液到带盖的螺口离心管中(10 mL),4℃冰箱保存。
细胞密度、叶绿素a含量、比生长速率、96 h急性毒性半效应浓度(EC50)等的测定和计算参考文献[27]方法进行。
培养液中NP的半衰期(Half life,T1/2):培养液中NP的时间变化采用Ct/C0表征,其中Ct代表t时刻NP的含量,而C0代表起始NP的含量。通过拟合Ct/C0随时间变化曲线计算NP的半衰期。
微藻对不同起始浓度NP的去除速率采用Michaelis-Menten方程进行拟合:
V=Vmax×SN/(KS+SN)
其中,V表示去除速率;Vmax表示最大去除速率;SN表示培养液中的NP浓度;Ks半饱和常数(1/2最大去除速率时的NP浓度)。
NP的萃取和HPLC分析:5 mL过滤后水样加入0.5 mL二氯甲烷,振荡混匀后静置10 min后分离下层液体到液相进样瓶中,萃取过程重复3次。氮气吹干后加入甲醇定容到1 mL。采用安捷伦1200系列高效液相色谱测定,荧光检测器(激发光波长228 nm,发射光波长305 nm)。色谱分离采用安捷伦C18柱(4.6 mm×250 mm,直径5 μm),温度为25℃。进样量20 μL,流动相采用75%的乙腈水溶液,流速为0.8 mL·min-1。NP标准曲线设置为50、100、200、400、600、800、1 000 μg·L-1,助溶剂丙酮体积为总体积的1‰。
1.3 数据统计与分析
实验数据采用Origin 8.0整理和制图,采用SPSS13.0软件包进行统计分析,单因素方差分析(One way-ANOVA)用来检查处理之间的差异性,P< 0.05和P<0.01分别认为显著和极其显著。藻类96 h-EC50值通过拟合NP对微藻生长的抑制率%与NP浓度的回归方程计算。
GIR%=(Cck-CNP)/Cck×100%
公式中,Cck为对照组藻细胞密度,CNP为NP暴露组藻细胞密度。
2 结果与讨论(Results and discussion)
2.1 NP对微藻的毒性效应及影响因素
NP对微藻叶绿素a含量产生毒性效应的浓度范围和毒性效应参数如表2所示。NP对11种微藻叶绿素a含量的半抑制效应浓度(EC50)介于0.60~3.33 mg·L-1之间,其毒性效应强弱顺序依次为:短棘盘星藻>羊角月牙藻>小球藻>衣藻>斜生栅藻>肥壮蹄形藻>卷曲纤维藻>二尾栅藻>惠氏微囊藻>四尾栅藻>蛋白核小球藻。NP对栅藻属和小球藻属微藻生长的抑制效应也存在极显著差异,四尾栅藻的耐受性显著高于其他栅藻种类,而蛋白核小球藻耐受性显著高于其他小球藻。然而,NP对斜生栅藻、肥壮蹄形藻和衣藻生长的半抑制效应浓度无显著差异(P>0.05)。

表2 NP对微藻叶绿素a含量的抑制效应Table 2 Growth inhibition of NP on the Chl.a content of algae after cultured for 96 h
微藻对环境内分泌干扰物的差异响应在现有文献中也有相应的报道,近头状伪蹄形藻(Pseudokirchneriella subcapitata)对壬基酚、辛基酚和雌二醇的耐受性均高于莱茵衣藻、铜绿微囊藻,且铜绿微囊藻不同株系间对3种污染物的耐受性也存在不同差异[19]。三丁基锡对派格棍形藻(Bacillaria paxillifera)、聚生角毛藻(Chaetoceros socialis)和简裸甲藻(Gymnodinium simplex)的毒性效应显著高于丹麦细柱藻(Leptocylindrus danicus)和微型原甲藻(Prorocentrum minimum)[20]。六溴环十二烷对叉鞭金藻(Dicrateriasp.)和中肋骨条藻(Skeletonema costatum)的毒性显著高于三角褐指藻(Phaeodactylum tricornutum)和海洋小球藻(Chlorellasp.);而四溴双酚A对4种微藻毒性强弱顺序为:中肋骨条藻>叉鞭金藻>海洋小球藻>三角褐指藻[22]。邓结平等[23]的研究表明四溴双酚A对7种海洋微藻毒性效应强弱顺序为:牟氏角毛藻(Chaetoceros muelleri)>微拟球藻(Nannochloropsis oculata)>等鞭金藻塔西堤品系(Isochrysis galbana(Tahitian strain))>湛江等鞭金藻(Dicrateria zhanjiangensis)>塔胞藻(Pyramidomonassp.)>三角褐指藻>亚心形扁藻(Platymonas subcordiformis)。NP暴露下普通小球藻(Chlorella vulgaris)的光合作用效率、色素含量、光能转化效率、抗氧化系统酶类活性等生理过程的抑制效应显著低于羊角月牙藻。同时,NP在普通小球藻细胞内的降解速率也显著高于羊角月牙藻[18]。综合现有的研究以及本研究中11种微藻对NP的响应,我们可以推断,NP对微藻生长的差异性干扰效应与其他种类环境污染物的毒性效应相类似。NP耐受性强的种类主要包括:四尾栅藻、蛋白核小球藻和惠氏微囊藻,而敏感性较强的种类则主要是羊角月牙藻、斜生栅藻、肥壮蹄形藻等。耐受性高的微藻种类可以用来开展NP的藻类生物去除等应用开发,而敏感性高的种类可用来进行NP的环境毒理学测试中敏感性指示种的筛选。
NP对11种微藻生长的抑制效应不仅与藻种有关,而且受藻种的生理和形态特性的影响。除斜生栅藻、羊角月牙藻、肥胖蹄形藻、卷曲纤维藻之外,其余7种微藻的生长速率与EC50呈显著的正相关关系(EC50=11.04μ-2.20,R2=0.8547,P<0.01)。蛋白核小球藻的高EC50值受其高生长速率的影响,相反的,短棘盘星藻的低EC50值受其低生长速率的影响(图1)。这一研究结果在王晓艳等[22]的研究中也有报道,海洋小球藻和三角褐指藻的生长速率显著高于中肋骨条藻和叉鞭金藻,且对六溴环十二烷和四溴双酚A的耐受性也显著高于后者。另外,本研究中所选取的斜生栅藻、羊角月牙藻是环境毒理学中常用的敏感性指示种,其对多数环境污染物的响应均较其他种类敏感。本研究也证实了NP的环境生态风险评价也可采用衣藻和卷曲纤维藻、肥壮蹄形藻等高敏感性微藻进行,进一步丰富了环境毒理学实验中的藻类生物材料。NP毒性与受试微藻细胞形态学特征也呈一定的相关关系,EC50与细胞粒径总体上呈负相关关系;除羊角月牙藻和卷曲纤维藻外,EC50与藻细胞表面积呈显著的负相关关系(EC50=-0.0043S+2.60,R2=0.3908,P=0.042),与藻细胞体积呈也显著的负相关关系(EC50=-0.0089V+ 3.05,R2=0.5705,P=0.018)。本研究中微藻的耐受性与形态特征的相关关系与谢永红等[20]研究结果相类似,细胞粒径和表面积较大的微藻种类耐受性显著低于粒径和表面积较小的微藻种类。

图1 藻细胞增长速率、表面积(μm2)、体积(μm3)与EC50的相关关系
2.2 微藻对NP的去除能效
微藻培养液中NP(1 mg·L-1)随时间变化情况如图2所示,24 h内NP去除率显著增加,各处理组培养液中NP去除率均超过90%。微藻对NP的去除率与总细胞表面积呈显著正相关关系,起始阶段(10 min)NP去除率介于6%~25%,NP去除率与总细胞表面积呈显著正相关相关(NP%=0.05S+5.46,R2=0.9812,P<0.01);12 h时,NP去除率在一定程度上仍受藻类总表面积的影响,其相关关系为:NP%= 0.046S+83.00(R2=0.5898,P=0.004)(附图1)。藻类培养液中NP(1 mg·L-1)的半衰期在各处理组间的变化情况表明,11种微藻培养液中NP的半衰期介于28~200 min之间(图2)。除斜生栅藻、卷曲纤维藻和惠氏微囊藻外,NP半衰期与藻细胞总表面积呈显著的负相关关系(T1/2=-1.07S+229.40,R2=0.8581,P <0.001)(附图2)。微藻对NP的去除速率在不同研究中受微藻种类和起始密度的影响,表现出一定的差异。类似的研究也表明,NP的藻类去除速率与细胞密度呈正相关关系,但去除速率在不定舟形藻(Navicula incerta)[28]、球等鞭金藻(Isochrysis galbana)[29]、铜绿微囊藻(Microcystis aeruginosa)[30]、羊角月牙藻[18]和多种小球藻中存在较大差别,这一现象主要受各实验起始细胞密度以及受试微藻藻种的差别导致。另外,也有研究表明,固定化处理后小球藻对培养液中NP的去除率增加显著[31-32]。

图2 微藻对NP(1 mg·L-1)的去除动力学参数
不同起始浓度NP的藻类去除能效经米氏方程拟合(附图3)后各相关参数:最大去除速率(Vmax)和半饱和常数(1/2Vmax对应的起始NP的浓度)见表3。NP暴露60 min后,11种微藻对NP的最大去除速率介于9.94和91.00 μg·(mg·h)-1之间。11种微藻的NP去除速率从大到小顺序依次为:斜生栅藻>惠氏微囊藻>蛋白核小球藻>四尾栅藻>短棘盘星藻>二尾栅藻>小球藻>肥壮蹄形藻>羊角月牙藻>卷曲纤维藻>衣藻。微藻对NP去除速率的差异可分为6组,四尾栅藻、短棘盘星藻、二尾栅藻、小球藻之间无显著差异;羊角月牙藻、卷曲纤维藻、肥壮蹄形藻之间也无显著差异(P>0.05);但斜生栅藻、惠氏微囊藻、蛋白核小球藻和衣藻之间均存在显著差异(P<0.05),同时,栅藻属和小球藻属微藻之间也存在显著差异(P<0.05),斜生栅藻的NP去除速率显著高于其他2种栅藻,蛋白核小球藻的NP去除速率显著高于其他小球藻。微藻对NP去除的半饱和常数介于10.38~79.43 μg之间,蛋白核小球藻和惠氏微囊藻显著高于其他种微藻,卷曲纤维藻和二尾栅藻半饱和常数显著低于其他种类(P<0.05)。栅藻属和小球藻属之间半饱和常数均具有显著差异(P<0.05)。微藻对烷基酚类环境内分泌干扰物的吸附和去除过程在铜绿微囊藻[33]和斜生栅藻[34]的研究中也得到印证。铜绿微囊藻可以快速吸附辛基酚(OP),且去除过程符合一级反应动力学方程。培养5 d后,斜生栅藻可以去除89%的NP和58%的OP,并且去除过程符合一级反应动力学方程。

图3 藻细胞对NP的最大吸附速率(Vmax)、半饱和常数(Ks)与EC50的相关关系
培养液中NP的生物吸附一定程度上增加了藻细胞的NP暴露浓度,从而导致高吸附能力微藻的NP暴露毒性增加。11种受试微藻的EC50与NP的半饱和常数Ks呈显著的正相关关系(EC50=0.027Ks+0.62,R2=0.5445,P=0.0058);除斜生栅藻和惠氏微囊藻之外,微藻的EC50与NP的最大去除速率Vmax呈显著的正相关关系(EC50=0.062Vmax+0.16,R2= 0.4204,P=0.035)(图3)。微藻对NP的去除包括了被动吸附和主动吸收的过程,而微藻的去除能效均受其自身对NP耐受性程度的间接调控。有研究表明,高去除能效微藻对NP等环境内分泌干扰物的生物去除过程中也进行了生物降解的过程,如:普通小球藻[18,31-32,34-35]、近头状伪蹄形藻(Pseudokirchneriella subcapitata)、急尖栅藻(Scenedesmus acutus)、四尾栅藻和网状空星藻(Coelastrum reticulatum)[36]、水华鱼腥藻(Anabaena flos-aquae)以及铜绿微囊藻(Microcystis aeruginosa)[30]等。微藻的高生物降解能效间接增加了微藻对环境内分泌干扰物的耐受性,有助于微藻在环境内分泌干扰物污染水体中的生存和种间竞争优势的获得。

表3 微藻培养液中NP去除速率与NP初始浓度的米氏方程拟合曲线相关参数Table 3 Parameters of Michaelis-Menten equation for NP removal rate and initial concentrations
综上所述,NP对淡水生态系统的中微藻生长的抑制效应存在显著的种间差异性,96 h半抑制效应浓度(EC50)介于0.60~3.33 mg·L-1之间。NP对微藻毒性效应的影响因素包括:微藻种类、生长速率、微藻形态以及微藻对NP的生物富集能力等。四尾栅藻和蛋白核小球藻的EC50显著高于同属的其他种类。除斜生栅藻、羊角月牙藻、肥壮蹄形藻、卷曲纤维藻之外,微藻的生长速率与EC50呈显著的正相关关系。NP对微藻毒性效应EC50与藻细胞粒径、表面积和体积呈负相关关系;与微藻对NP的最大去除速率和半饱和常数呈正相关关系。NP对微藻群落的影响与其浓度相关,其选择性干扰效应主要与微藻耐受性相关。NP耐受性高的种类多表现出高生长速率和高NP去除能效。四尾栅藻和蛋白核小球藻可作为污水处理厂出水中氮磷和NP等残留的生物降解材料;斜生栅藻、羊角月牙藻、肥壮蹄形藻、卷曲纤维藻可用作NP暴露生态风险评价的敏感性指示种。
(References):
[1] Kruger T,Long M,Bonefeld-Jorgensen C B.Plastic components affect the activation of the aryl hydrocarbon and the androgen receptor[J].Toxicology,2008,246:112-123
[2] Bergman Å,Heindel J J,Kasten T,et al.The impact of endocrine disruption:A consensus statement on the state of the science[J].Environmental Health Perspectives, 2013,121(4):104-106
[3] Vandenberg L N,Colborn T,Hayes T B,et al.Regulatory decisions on endocrine disrupting chemicals should be based on the principles of endocrinology[J].Reproductive Toxicology,2013,38:1-15
[4] Ying G G,Williams B,Kookana R.Environmental fate of alkylphenols and alkylphenol ethoxylates-A review[J]. Environment International,2002,28:215-226
[5] Sánehez-Avila J,Bonet J,Velasco G,et al.Determination and occurrence of phthalates,alkylphenols,bisphenol A, PBDEs,PCBs and PAHs in an industrial sewage grid discharging to a municipal wastewater treatment plant[J]. Science of The Total Environment,2009,407(13):4157-4167
[6] Li D H,Kim M,Shim W J,et al.Seasonal flux of nonylphenol in Han River,Korea[J].Chemosphere,2004,56 (1):1-6
[7] Stachel B,Ehrhorn U,Heemken O,et al.Xenoestrogens in the River Elbe and its tributaries[J].Environmental Pollution,2003,124(3):497-507
[8] Heemken O P,Reincke H,Stachel B,et al.The occurrence of xenoestrogens in the Elbe River and the North Sea[J].Chemosphere,2001,45:245-259
[9] Isobe T,Nishiyama H,Nakashima A,et al.Distribution and behavior of nonylphenol,octylphenol and nonylphenol monoethoxylate in Tokyo metropolitan area:Their association with aquatic particles and sedimentary distributions[J].Environmental Science&Technology,2001,35 (6):1041-1049
[10] Blackburn M,Kirby S,Waldock M.Concentrations of alkyphenol polyethoxylates entering UK estuaries[J].Marine Pollution Bulletin,1999,38(2):109-118
[11] Jonkers N,Laane R,De Voogt P.Fate of nonylphenol ethoxylates and their metabolites in two Dutch estuaries: Evidence of biodegradation in the field[J].Environmental Science&Technology,2003,37(2):321-327
[12] Ferguson P,Iden C,Brownawell B.Distribution and fate of neutral alkylphenol ethoxylate metabolites in a sewageimpacted urban estuary[J].Environmental Science& Technology,2001,35(12):2428-2435
[13] 段菁春,陈兵,麦碧娴,等.洪季珠江三角洲水系烷基酚污染状况研究[J].环境科学,2004,25(3):48-52
Duan J C,Chen B,Mai B X,et al.Survey of alkyphenols in aquatic environment of Zhujiang Delta[J].Environmental Science,2004,25(3):48-52(in Chinese)
[14] 李正炎,李浩东.西瓦湖中壬基酚和双酚A的污染特征[J].青岛海洋大学学报,2003,33(6):847-853
Li Z Y,Li H D.Distribution characteristics of nonylphenol and bisphenol A in Shihwa Lake[J].Journal of Ocean University of Qingdao,2003,33(6):847-853(in Chinese)
[15] Xu J,Wang P,Guo W F,et al.Seasonal and spatial distribution of nonylphenol in Lanzhou Reach of Yellow River in China[J].Chemosphere,2006,65(9):1445-1451
[16] 傅明珠.烷基酚在近海海洋和河口环境中的浓度分布与初步生态风险评价[D].青岛:中国海洋大学,2007
Fu M Z.Distribution characteristics of alkylphenols in coastal and estuary environment and the ecological risk assessment[D].Qingdao:Ocean University of China, 2007(in Chinese)
[17] 沈钢,张祖麟,余刚,等.夏季海河与渤海湾中壬基酚和辛基酚污染的状况[J].中国环境科学,2005,25(6): 733-736
Shen G,Zhang Z L,Yu G,et al.The pollution state of nonylphenol and octylphenol in Haihe River and Bohai Bay in summer[J].Chinese Environmental Science,2005, 25(6):733-736(in Chinese)
[18] Gao Q T,Tam N F Y.Growth,photosynthesis and antioxidant responses of two microalgal species,Chlorella vulgarisandSelenastrum capricornutum,to nonylphenol stress[J].Chemosphere,2011,82:346-354
[19] Perron M C,Juneau P.Effect of endocrine disrupters on photosystem II energy fluxes of green algae and cyanobacteria[J].Environmental Research,2011,111:520-529
[20] 谢永红,苏荣国,张丽笑,等.三丁基锡对中国近海常见海洋微藻的毒性效应[J].生态环境学报,2011,20(6-7):1075-1080
Xie Y H,Su R G,Zhang L X,et al.The toxic effects of chloride tributyltin on the predominant marine algae in China coastal water[J].Ecology and Environmental Sciences,2011,20(6-7):1075-1080(in Chinese)
[21] 孟范平,李卓娜,赵顺顺,等.BDE-47对4种海洋微藻抗氧化酶活性的影响[J].生态环境学报,2009,18(5): 1659-1664
Meng F P,Li Z N,Zhao S S,et al.Effects of BDE-47 on the antioxidase activities of four species of marine microalgae[J].Ecology and Environmental Sciences,2009, 18(5):1659-1664(in Chinese)
[22] 王晓艳,蒋凤华,曹为,等.六溴环十二烷和四溴双酚A对4种海洋微藻的急性毒性[J].海洋环境科学,2013, 32(6):831-835
Wang X Y,Jiang F H,Cao W,et al.Acute toxic effect of hexabromocyclododecane and tetrabromobisphenol A on four marine microalgae[J].Marine Environmental Science,2013,32(6):831-835(in Chinese)
[23] 邓结平,李赟,潘鲁青.四溴双酚A对7种海洋微藻的急性毒性[J].中国海洋大学学报,2015,45(2):54-59
Deng J P,Li Y,Pan L Q.The acute toxicity of TBBPA on seven marine microalgae[J].Periodical of Ocean University of China,2015,45(2):54-59(in Chinese)
[24] 赵丽,刘征涛,冯流,等.单歧藻对烷基酚类化合物的生物降解性及QSBR研究[J].环境科学研究,2005,18 (1):23-27
Zhao L,Liu Z T,Feng L,et al.Study on biodegradability of alkylphenols bytolypothrix and QSBR[J].Research of Environmental Sciences,2005,18(1):23-27(in Chinese)
[25] 翟洪艳,孙红文.藻类对壬基酚微生物降解的影响[J].生态环境,2007,16(3):842-845
Zhai H Y,Sun H W.The effect of algae on biodegradation of nonylphenol by microorganism[J].Ecology and Environment,2007,16(3):842-845(in Chinese)
[26] 彭章娥,杨海真,汪蓓蓓,等.淡水藻类对辛基酚的吸附行为研究[J].环境科学,2009,30(12):3652-3657
Peng Z E,Yang H Z,Wang B B,et al.Study on the sorption of 4-octylphenol by freshwater algae[J].Environmental Sciences,2009,30(12):3652-3657(in Chinese)
[27] Sun K F,Liu W J,Liu L L,et al.Ecological risks assessment of organophosphorus pesticides on bloom ofMicrocystis wesenbergii[J].International Biodeterioration& Biodegradation,2013,77:98-105
[28] Liu Y,Guan Y T,Gao Q T,et al.Cellular responses,biodegradation and bioaccumulation of endocrine disrupting chemicals in marine diatomNavicula incerta[J].Chemosphere,2010,80:592-599
[29] Correa-Reyes G,Viana M T,Marquez-Rocha F J,et al. Nonylphenol algal bioaccumulation and its effect through the trophic chain[J].Chemosphere,2007,68:662-670
[30] Babu B,Wu J T.Biodegradation of phthalate eaters by cyanobacteria[J].Journal of Phycology,2010,46:1106-1113
[31] Gao Q T,Wong Y S,Tam N F Y.Removal and biodegradation of nonylphenol by differentChlorellaspecies[J]. Marine Pollution Bulletin,2011,63:445-451
[32] Gao Q T,Wong Y S,Tam N F Y.Removal and biodegradation of nonylphenol by immobilizedChlorella vulgaris [J].Bioresource Technology,2011,102:10230-10238
[33] Baptista M,Stoichev T,Basto M C P,et al.Fate and effects of octylphenol in aMicrocystis aeruginosaculture medium[J].Aquatic Toxicology,2009,92:59-64
[34] Zhou G J,Peng F Q,Yang B,et al.Cellular responses and bioremoval of nonylphenol and octylphenol in the freshwater green microalgaScenedesmus obliquus[J].Ecotoxicology and Environmental Safety,2013,87:10-16
[35] Peng Z E,Wu F,Deng N S.Photodegradation of bisphenol A in simulated lake water containing algae,humic acid and ferric ions[J].Environmental Pollution,2006, 144:840-846
[36] Nakajima N,Teramoto T,Kasai F,et al.Glycosylation of bisphenol A by freshwater microalgae[J].Chemosphere, 2007,69:934-941◆
Bioremoval of Nonylphenol and Variable Responses of Freshwater Algae under Nonylphenol Exposure
Sun Kaifeng1,2,Liu Lili1,3,Sun Dong1,Liu Weijie1,He Ning1,Duan Shunshan1,*
1.Research Centre of Hydrobiology,Jinan University,Guangzhou 510632,China
2.South China Institute of Environmental Sciences,MEP,Guangzhou 510655,China
3.Department of Biochemistry,Anhui University Jianghuai College,Hefei 230031,China
1 December 2015 accepted 8 January 2016
The effects of nonylphenol(NP)on growth,chlorophyll a content of eleven freshwater algae and their bioremoval ability on NP were compared.Acute toxic of NP was conducted with ten concentrations of NP(0.10, 0.16,0.25,0.40,0.63,1.00,1.59,2.52,4.00,6.30,10.06 mg·L-1),where a final acetone concentration of 0.1%(v/ v)was set as control.The NP bioremoval in eleven algal cultures was determined during incubation with 100,200, 400,600,800,1 000 μg·L-1of NP in BG-11 medium after exposure for 1 h,while the changes of NP(1 mg·L-1) in algal cultures were determined at 0 min,10 min,30 min,1 h,6 h,12 h and 24 h.The half inhibitory effect concentrations(EC50)of NP on Chl.a ranged from 0.6 to 3.33 mg·L-1after being cultured for 96 h.The EC50valuessuggested that the tolerance of algae to NP increased according to the following order:Pediastrum boryanum,Selenastrum capricornutum,Chlorellasp.,Chlamydomonassp.,Scenedesmus obliquus,Kirchneriella obesa,Ankistrodesmus convolutus,Scenedesmus bicauda,Microcystis wesenbergii,Scenedesmus quadricandaandChlorella pyrenoidosa.A positive correlation was detected between algal growth rate and EC50values,except forS.obliquus,S. capricornutum,K.obesaandA.convolutus.In addition,negative correlations were detected between EC50values and cell size,surface area and volume,respectively.Removal rate of NP in all algal species were higher than 90% at 24 h,and a positive correlation was detected between NP removal rate and the total cell surface areas.The algal removal of NP(1 mg·L-1)followed the first-order kinetics equation.A negative correlation was observed between the half-life of NP and total algal surface area.Removal rates of NP under different initial NP concentrations were well fitted with Michaelis-Menten equation.The maximum removal rates of NP ranged from 9.94 to 91 μg·(mg· h)-1,while half saturated constant ranged from 10.38 to 79.43 μg.Positive correlation were detected between EC50values and the maximum removal rates of NP,EC50values and half saturated constants,respectively.Effects of NP on growth of algae and structure of community were dependent on the NP concentration.Variation of community was influenced by the tolerance of NP among tested algal species.Algal species with higher tolerance of NP showed higher growth rates and higher bioaccumulation of NP.
nonylphenol;algae;acute toxicity;bioremoval

附表1 微藻的形态学参数Appendix 1 The morphological parameters of microalgae
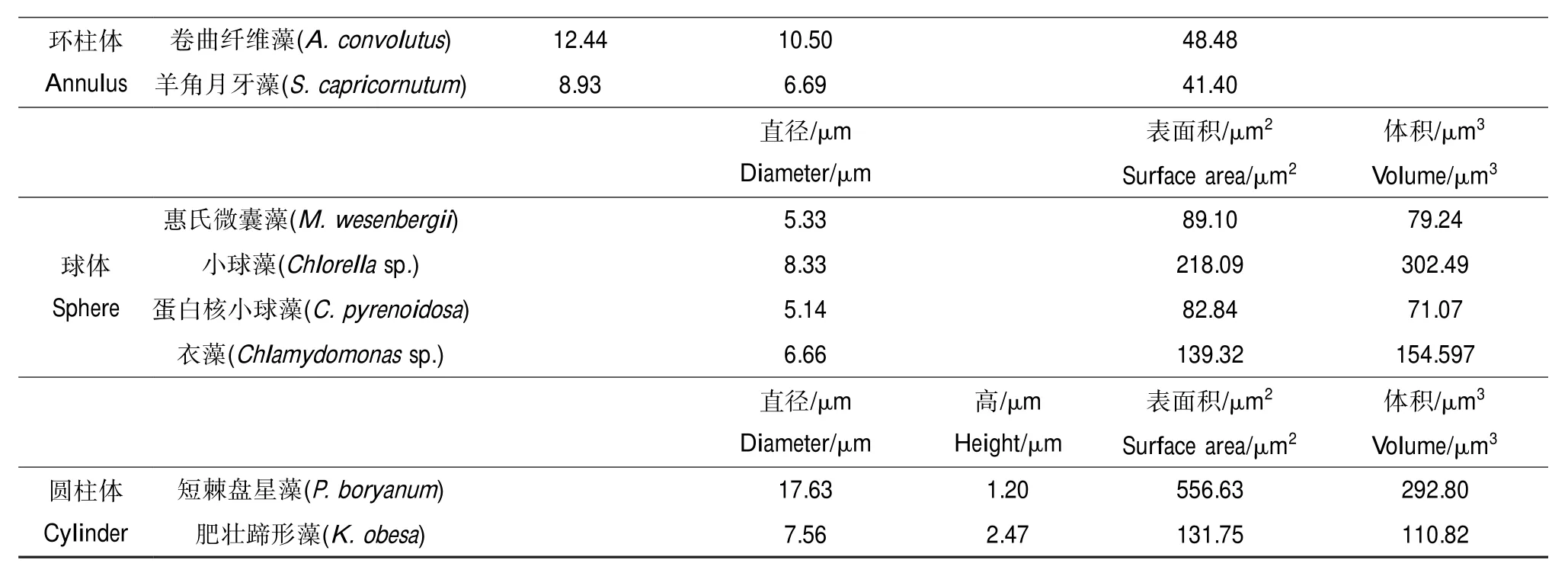
环柱体Annulus卷曲纤维藻(A.convolutus)12.4410.5048.48羊角月牙藻(S.capricornutum)8.936.6941.40直径/μm Diameter/μm表面积/μm2Surface area/μm2体积/μm3Volume/μm3球体Sphere体积/μm3Volume/μm3圆柱体Cylinder惠氏微囊藻(M.wesenbergii)5.3389.1079.24小球藻(Chlorellasp.)8.33218.09302.49蛋白核小球藻(C.pyrenoidosa)5.1482.8471.07衣藻(Chlamydomonassp.)6.66139.32154.597直径/μm Diameter/μm高/μm Height/μm表面积/μm2Surface area/μm2短棘盘星藻(P.boryanum)17.631.20556.63292.80肥壮蹄形藻(K.obesa)7.562.47131.75110.82
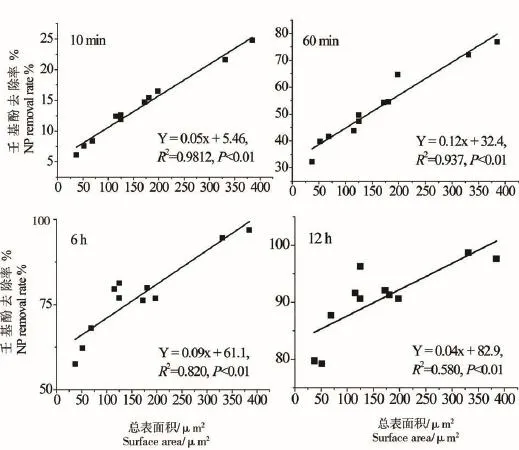
附图1 NP去除率与细胞表面积的相关关系
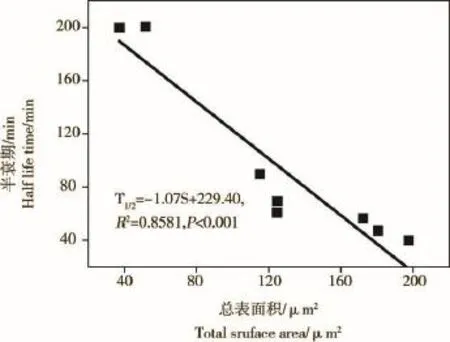
附图2 藻类培养液中NP(1 mg·L-1)的半衰期与藻细胞总表面积的相关关系

附图3 微藻培养液中NP去除速率与起始浓度在第60分钟的米式方程拟合曲线
2015-12-01 录用日期:2016-01-08
1673-5897(2016)3-226-11
X171.5
A
10.7524/AJE.1673-5897.20151201003
简介:段舜山(1955—),男,生态学博士,教授,主要研究方向为水污染生态和藻类生理生态学,发表学术论文200余篇。
国家自然科学基金项目(21307140,41476099);中央级公益性科研院所基本科研业务专项(PM-zx703-201602-043,PM-zx021-201211-123)
孙凯峰(1983-),男,博士后,研究方向为藻类生理生态学,E-mail:jnuskf2009@163.com;
*通讯作者(Corresponding author),E-mail:tssduan@jnu.edu.cn

