凝结芽孢杆菌对白羽肉鸡生产性能及部分肠道微生物相关指标的影响
王政,张大伟,齐长海,左泽,薛玉
(青岛根源生物技术集团有限公司,山东青岛266061)
根源生物技术专栏
凝结芽孢杆菌对白羽肉鸡生产性能及部分肠道微生物相关指标的影响
王政*,张大伟,齐长海,左泽,薛玉
(青岛根源生物技术集团有限公司,山东青岛266061)
为研究在饮水中添加凝结芽孢杆菌对白羽肉鸡生产性能、肠道微生物数量、食糜中挥发性脂肪酸含量及空肠肠道形态结构的影响,本试验将180只7日龄白羽肉鸡随机分为3个处理组,试验1组和试验2组在饮水中添加凝结芽孢杆菌的终浓度分别为105cfu/mL和106cfu/mL,对照组饮水和日粮中不添加任何微生态制剂。研究结果表明:饮水中添加高剂量(106cfu/mL)的凝结芽孢杆菌显著提高了白羽肉鸡的采食量(P<0.05),盲肠食糜中乳酸杆菌数量显著增加(P<0.05),而大肠菌群数量显著降低(P<0.05);高剂量的凝结芽孢杆菌显著提高了丁酸和总挥发性脂肪酸的含量(P<0.05),并增加了空肠绒毛高度/隐窝深度。本试验中凝结芽孢杆菌在饮水中的最适添加量为106cfu/mL。
凝结芽孢杆菌;生产性能;肠道微生物;挥发性脂肪酸;空肠肠道形态结构
益生素是指能够促进动物肠道中微生物区系平衡的微生物制剂或其他物质。益生素能够调节肠道功能紊乱,维持肠道内菌群平衡,提高机体免疫水平。目前国内外广泛应用的益生菌有乳酸杆菌、双歧杆菌、芽孢杆菌和酵母菌等,但乳酸杆菌和双歧杆菌的抗胃酸、抗胆盐和抗高温能力差,而芽孢杆菌由于具有抗逆性强、耐高温高压、易贮藏等独特优点,成为益生菌中研究的热点。其中凝结芽孢杆菌作为一种能够形成芽孢的乳酸菌极具应用前景。凝结芽孢杆菌可形成芽孢、革兰氏阳性、兼性厌氧、杆状、可移动,在较宽的温度(30~57℃)和pH值(4~10.5)范围内都能够生长(De Clerk等,2004)。本试验在白羽肉鸡的饮水中添加凝结芽孢杆菌,考察凝结芽孢杆菌对白羽肉鸡生产性能、肠道微生物数量、食糜挥发性脂肪酸含量及空肠肠道形态结构的影响,为凝结芽孢杆菌在实际生产中的应用提供理论依据。
1 材料与方法
1.1试验材料试验所用凝结芽孢杆菌制剂由青岛根源生物技术集团有限公司提供,活菌数为1.38×1011cfu/g。
1.2试验设计试验于2012年4月在青岛根源生物技术集团有限公司研发中心动物试验室进行,选择1日龄白羽肉鸡300羽,预饲7 d。弃体重差异大的鸡苗,剩余180羽肉鸡正式开始试验,试验分为3个处理组,每个处理组4个重复(即4个栏位),每个重复15只鸡,试验1组在饮水中添加凝结芽孢杆菌,终浓度为105cfu/mL,试验2组饮水中添加凝结芽孢杆菌的终浓度为106cfu/mL,对照组饮水和日粮中均不添加任何微生态制剂,各处理组连续饲喂至42日龄出栏。
1.3日粮组成及营养水平试验所用饲料是根据白羽肉鸡不同时期营养需求制作的配合饲料。试验基础日粮组成和营养水平见表1。
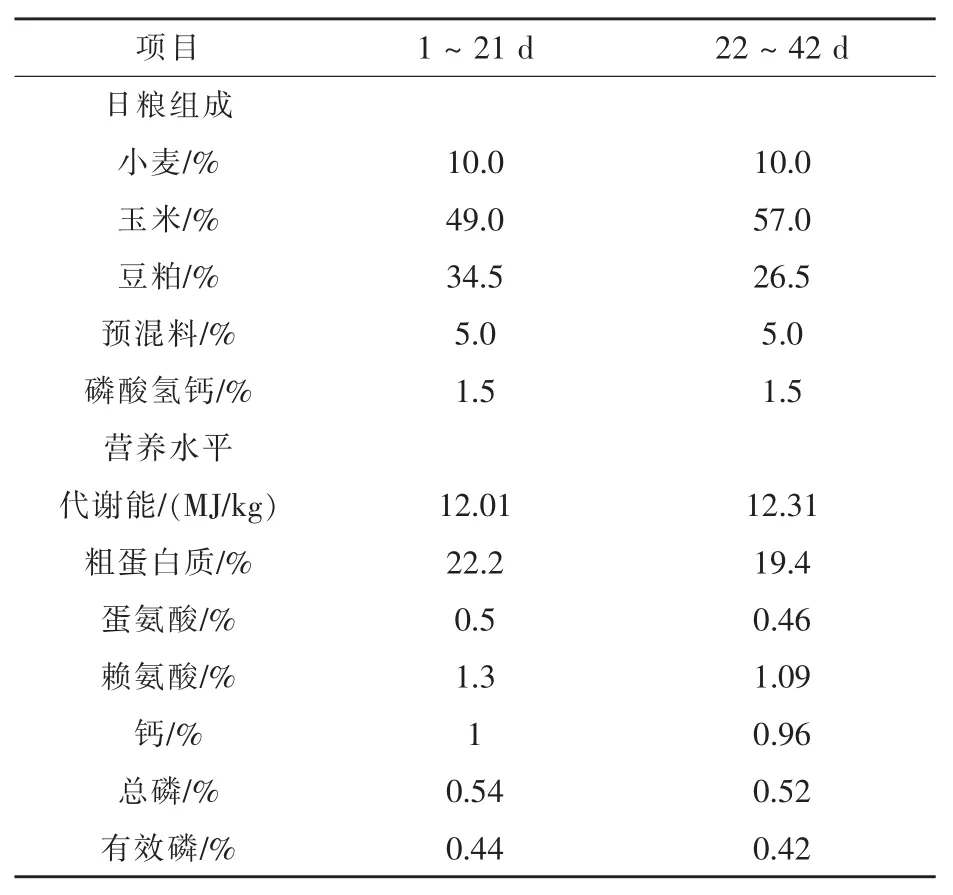
表1 试验日粮组成及营养水平(风干基础)
1.4饲养管理及生产性能测定垫料平养,自由采食和饮水。每日清晨8∶00和14∶00分别记录鸡舍温度和湿度,定期清扫卫生。每周结料1次,计算平均采食量,于42日龄以重复为单位称重,计算日采食量、日增重和料重比等生产性能指标。
1.5样品采集及测定指标各处理组饲喂至42日龄,从每个重复组随机取出3只鸡,禁食12 h后屠宰,取盲肠食糜分析大肠菌群和乳酸杆菌数量,取盲肠食糜分析挥发性脂肪酸含量,取一段空肠测定绒毛高度和隐窝深度。
1.5.1盲肠微生物计数无菌称取盲肠食糜1 g,加入9 mL灭菌生理盐水,充分摇匀后进行逐级10倍稀释,选择3个较为合适的稀释梯度进行接种培养,每个稀释浓度设3个重复。取所选定的梯度细菌稀释液100 μL接种到相应的培养基上,大肠杆菌37℃培养24 h,乳酸杆菌37℃培养48 h,培养完后选择同一稀释度、3个重复菌落数相差不大的平板进行计数,平板上的菌落数要求为30~300个。
1.5.2挥发性脂肪酸测定取1 g食糜于离心管中,加入5倍的双蒸水,混合均匀后取1 mL样品加25%偏磷酸和巴豆酸(内标法,100 mL溶液中含巴豆酸0.6464 g)混合液0.2 mL,-20℃冰箱保存。测定前解冻,12000 r/min离心10 min,取上清液0.6 μL测定。按胡伟莲(2005)方法测定挥发性脂肪酸(VFA),柱温130℃,进样器温度为180℃,检测器温度为180℃。高纯氮总流量30.2 mL/min,柱流1.7 mL/min,氢气流量40 mL/min,空气流量400 mL/min。
1.5.3空肠肠道形态结构测定取长约2 cm的一段空肠,用10%福尔马林固定24 h以上,进行石蜡包埋,连续切片,苏木精-伊红(HE)染色,显微镜测定空肠绒毛高度和隐窝深度。
1.6统计分析试验数据经Microsoft Excel初步处理后,利用SPSS 16.0统计软件进行方差分析,如果方差分析结果显著,则采用LSD法进行多重比较。
2 结果与分析
2.1饮水中添加凝结芽孢杆菌对白羽肉鸡生产性能的影响由表2可知,不同处理组之间的日增重和料重比均无显著差异(P>0.05),但是随着凝结芽孢杆菌添加量增加,试验组日增重略高于对照组,而料重比略低于对照组,即添加凝结芽孢杆菌可以略提高饲料报酬。试验1组和试验2组的日采食量分别较对照组提高2.73%和4.09%(P<0.05),说明饮水中添加凝结芽孢杆菌可以提高白羽肉鸡的采食量。

表2 饮水中添加凝结芽孢杆菌对白羽肉鸡生产性能的影响
2.2饮水中添加凝结芽孢杆菌对白羽肉鸡盲肠微生物数量的影响表3显示了饮水中添加凝结芽孢杆菌对白羽肉鸡盲肠食糜中菌群数量的影响,其中试验2组的大肠杆菌数量较对照组和试验1组分别降低15.43%和19.28%(P<0.05),试验2组乳酸杆菌的数量显著高于对照组9.85%(P<0.05)。表明饮水中添加高剂量(106cfu/mL)的凝结芽孢杆菌有助于降低白羽肉鸡盲肠食糜中的大肠杆菌数量,提高乳酸杆菌数量。
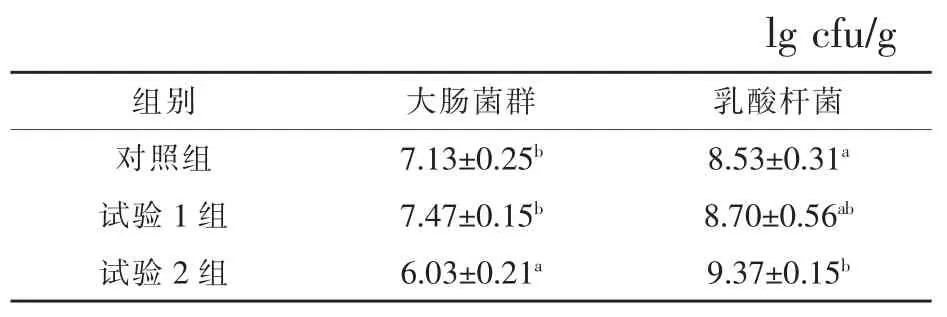
表3 饮水中添加凝结芽孢杆菌对白羽肉鸡盲肠微生物数量的影响
2.3饮水中添加凝结芽孢杆菌对白羽肉鸡盲肠食糜中挥发性脂肪酸生成的影响哺乳动物大肠中的厌氧微生物能发酵产生乙酸、丙酸、丁酸等挥发性脂肪酸,挥发性脂肪酸能够被动物迅速吸收,可作为动物机体的能量来源。表4显示了饮水中添加凝结芽孢杆菌对白羽肉鸡盲肠食糜中挥发性脂肪酸生成的影响,其中试验2组总挥发性脂肪酸生成水平显著高于其他各组(P<0.05)。研究发现总挥发性脂肪酸中乙酸的占比较高,而丙酸、丁酸等脂肪酸占比较低,各处理组之间的乙酸和丙酸生成水平没有显著差异(P>0.05),试验2组、试验1组丁酸水平与对照组相比分别提高了76.00%和20.00%。
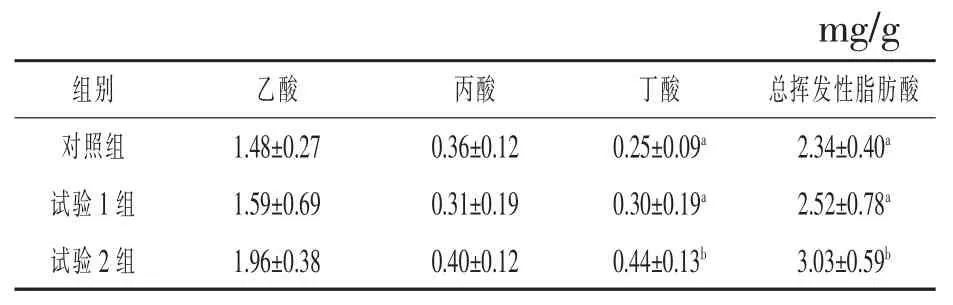
表4 饮水中添加凝结芽孢杆菌对白羽肉鸡盲肠食糜中挥发性脂肪酸生成的影响
2.4饮水中添加凝结芽孢杆菌对白羽肉鸡空肠形态结构的影响表5显示了饮水中添加凝结芽孢杆菌对白羽肉鸡空肠肠道形态结构的影响,试验2组的绒毛高度与隐窝深度比值为7.43,显著高于对照组(P<0.05)。表明饮水中添加凝结芽孢杆菌有助于提高白羽肉鸡空肠对营养物质的吸收能力。
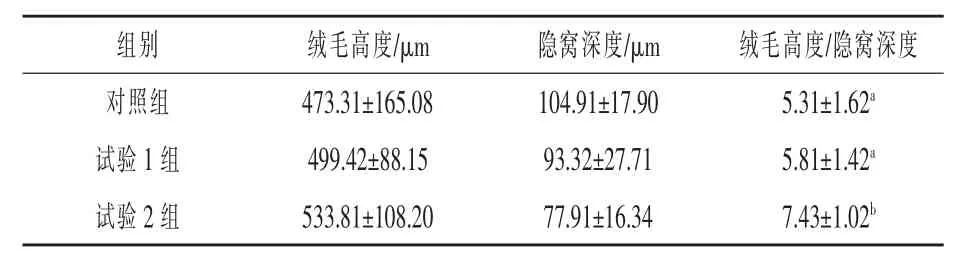
表5 饮水中添加凝结芽孢杆菌对白羽肉鸡空肠形态结构的影响
3 讨论
3.1饮水中添加凝结芽孢杆菌对白羽肉鸡生产性能的影响有关饮水和饲料中添加凝结芽孢杆菌在白羽肉鸡上的应用效果报道不尽相同。De Vecchi和Drago(2006)指出不同的凝结芽孢杆菌菌株特性差异较大,这可能是造成凝结芽孢杆菌在畜禽养殖中应用效果不同的根本原因。Cavazzoni等(1998)发现在肉仔鸡日粮中添加凝结芽孢杆菌CNCMI-1061可以显著提高肉仔鸡的平均体重和日增重。Adami和Cavazzoni(1999)发现与标准日粮或添加了杆菌肽锌的日粮相比,在仔猪日粮中添加凝结芽孢杆菌可以显著减少死淘率,改善日增重和饲料转化率。本试验采用的凝结芽孢杆菌菌株可以显著提高白羽肉鸡的采食量,表明该菌株对于改善白羽肉鸡的生产性能具有一定的作用。
3.2饮水中添加凝结芽孢杆菌对白羽肉鸡盲肠微生物数量的影响在本试验中,饮水中添加高剂量(106cfu/mL)的凝结芽孢杆菌显著增加了白羽肉鸡盲肠食糜中乳酸杆菌的数量(P<0.05),显著降低了大肠菌群的数量(P<0.05),表明一定数量的凝结芽孢杆菌有助于改善肉鸡盲肠微生物区系。研究表明,凝结芽孢杆菌能够抑制大肠杆菌和肠球菌的生长(Lonkar等,2005;Donskey等,2001)。与其他能够形成芽孢的乳酸菌一样,凝结芽孢杆菌能够产生L-乳酸,对多种粪便微生物具有抑制效应(Hyronimus等,2000;Bondi等,2000)。Abada(2008)鉴定了一种新的细菌素,对革兰氏阳性菌、阴性菌和真菌都有抑制作用。Lin等(2011)在肉仔鸡日粮中添加不同剂量的凝结芽孢杆菌,结果表明凝结芽孢杆菌显著降低了十二指肠和盲肠食糜中大肠杆菌数量,而显著增加了这两个肠段乳酸杆菌的数量(P<0.05),与本试验结果相一致。
3.3饮水中添加凝结芽孢杆菌对白羽肉鸡盲肠食糜中挥发性脂肪酸生成的影响畜禽后肠中的厌氧微生物能发酵产生大量的挥发性短链脂肪酸(SCFA),包括乙酸、丙酸和丁酸。动物机体所吸收的短链脂肪酸可以作为结肠上皮细胞的能量来源或者转运到各个外周组织中进行进一步的代谢(Wong等,2006)。丁酸是结肠上皮细胞优先利用的能源物质,有相当数量的丙酸穿过结肠上皮转移到肝脏中,肝脏中的丙酸可以作为糖异生的底物或者参与调节胆固醇的合成(Reilly和Rombeau,1993;Venter,1990)。乙酸是血液中主要的短链脂肪酸,可作为外周组织如肝脏重要的能量来源,肝脏中的乙酸被用于合成脂肪和胆固醇(Cook和Sellin,1998;Bergman,1990)。后肠吸收的短链脂肪酸提供的能量占机体总能量需求的6%~10%,De Filippo等(2010)指出微生物分泌酶类多样性的增加将有助于产生大量的短链脂肪酸,可以为动物机体提供更多的能量,从而有利于促进动物生产性能的提高。本研究发现,饮水中添加凝结芽孢杆菌显著提高了白羽肉鸡盲肠食糜中丁酸和总挥发性脂肪酸的生成水平,说明凝结芽孢杆菌促进了后肠微生物代谢活性的增加并有助于提高动物的生产性能。
3.4饮水中添加凝结芽孢杆菌对白羽肉鸡空肠形态结构的影响肠绒毛是小肠黏膜表面上皮和固有层向肠腔内的细小突起,是动物机体对营养物质吸收和转运的最主要部位,在十二指肠和空肠分布最为密集。小肠与营养物质相对接触面积越大,对营养物质的吸收就越有利。Samanya和Sharma(2002)在28日龄肉仔鸡日粮中添加枯草芽孢杆菌,发现十二指肠和回肠的绒毛高度显著增加,而空肠的绒毛高度有增加的趋势,但未达到显著差异。Iji等(2001)在7~28日龄肉仔鸡日粮中添加5 g/kg甘露寡糖,研究发现28日龄肉仔鸡空肠绒毛高度增加,而Bio-Mos对十二指肠、回肠绒毛表面积和隐窝深度以及回肠的绒毛高度都没有显著影响。本试验研究表明,饮水中添加高剂量凝结芽孢杆菌提高了绒毛高度与隐窝深度比值,有助于提高白羽肉鸡空肠对营养物质的吸收能力。
4 结论
日粮中添加高剂量(106cfu/mL)的凝结芽孢杆菌可提高白羽肉鸡采食量,显著增加盲肠食糜中乳酸杆菌数量,减少大肠杆菌数量,有助于改善肠道微生物区系,促进丁酸和总挥发性脂肪酸的生成。此外高剂量凝结芽孢杆菌能提高白羽肉鸡空肠绒毛高度与隐窝深度比值,改善白羽肉鸡的消化吸收功能。本试验中凝结芽孢杆菌在饮水中的最适添加量为106cfu/mL。
[1]胡伟莲.皂甙对瘤胃发酵与甲烷产量及动物生产性能影响的研究:[博士学位论文][D].杭州:浙江大学,2005.
[2]Abada E A E.Isolation and characterization of an antimicrobial compound from Bacillus coagulans[J].Anim Cell Syst,2008,12:41~46.
[3]A,Cavazzoni V.Occurrence of selected bacterial groups in the faeces of piglets fed with Bacillus coagulans as probiotic[J].J Basic Microbiol,1999,39:3~9.
[4]Bergman E N.Energy contribution of volatile fatty-acids from the gastrointestinal tract in various species[J].Physiol Rev,1990,70(2):567~590.
[5]Bondi M,Messi P,Danila I,et al.Biological characteristics of LABLYS98,a Lactobacillus sporogenes for use as a probiotic compound[J].Ind Aliment,2000,39:704~710.
[6]Cavazzoni V,Adami S A,Castrovilli C.Performance of broiler chickens supplemented with Bacillus coagulans as probiotics[J].Br Poult Sci,1998,39:526~529.
[7]Cook S I,Sellin J H.Review article:short chain fatty acids in health and disease[J].Aliment Pharmacol Ther,1998,12(6):499~507.
[8]De Clerk E,Rodriguez-Diaz M,Forsyth G,et al.Polyphasic characterization ofBacilluscoagulansstrains,illustratingheterogeneitywithinthe species,and emended description of the species[J].Syst Appl Microbiol,2004,27:50~60.
[9]De Filippo C,Cavalieri D,Di Paola M,et al.Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa[J].Proc Natl Acad Sci USA,2010,107(33):14691~14696.
[10]De Vecchi E,Drago L.Lactobacillus sporogenes or Bacillus coagulans misidentification or mislabelling[J].Int J Probiotics Prebiotics,2006,1:3~10.
[11]Donskey C J,Hoyen C K,Das S M,et al.Effect of oral Bacillus coagulans administration on the density of vancomycin-resistant enterococci in the stool of colonized mice[J].Lett Appl Microbiol,2001,33:84~88.
[12]Hyronimus B,Le Marrec C,Hadj Sassi A,et al.Acid and bile tolerance of spore-forming lactic acid bacteria[J].Int J Food Microbiol,2000,61:193~197.
[13]Iji P A,Saki A,Tivey D R.Intestinal structure and function of broiler chickens on diet supplemented with a mannan oligosaccharide[J].J Sci Food A-gric,2001,81:1186~1192.
[14]Lin S Y,Hung A T Y,Lu J J.Effects of supplement with different level of Bacillus coagulans as probiotics on growth performance and intestinal microflora populations of broiler chickens[J].J Anim Vet Adv,2011,10(1):111~114.
[15]Lonkar P,Harne S D,Kalorey D,et al.Isolation,in vitro antibacterial activity,bacterial sensitivity and plasmid profile of Lactobacilli[J].Asian Austral J Anim Sci,2005,18:1336~1342.
[16]Reilly K J,Rombeau J L.Metabolism and potential clinical-application of short-chain fatty-acids[J].Clin Nutr,1993,12:97~105.
[17]Samanya M,Yamauch K.Histological alterations of intestinal villi in chickens fed dried Bacillus subtilis var.natto[J].Comp Biochem Physiol Part A Physiology,2002,133:95~104.
[18]Singh S,Sharma V P,Panwar V S.Effect of different levels of probiotic and energy on microbial population in broiler chicks[J].Indian Vet J,1999,76:1026~1028.
[19]Venter C S.Effects of dietary propionate on carbohydrate and lipidmetabolism in healthy-volunteers[J].Am J Gastroenterol,1990,85(5):549~553.
[20]Wong J M W,de Souza R,Kendall C W C,et al.Colonic health:fermentation and short chain fatty acids[J].J Clin Gastroenterol,2006,40(3):235~243.
A study was carried out to investigate the effect of Bacillus coagulans on the growth performance,cecal microbial population,short-chain fatty acids and jejunum morphology of broilers.A total of 180 seven-day-old broilers were divided into three groups,randomly.The experimental treatments were as follows:drinking water(control group),drinking water+105cfu/mL B.coagulans(group 1),drinking water+106cfu/mL B.coagulans(group 2).The results showed that the high addition level of B.coagulans significantly promoted broiler’s feed intake(P<0.05),increased Lactobacillus PoP ulation but reduced coliform population in the cecal digesta(P<0.05).Furthermore,the high addition level of B.coagulans enhanced butyrate and short-chain fatty acid production,correlating with increased jejunal villus height/crypt depth. The optimum level of B.coagulans in the drinking water was 106cfu/mL in the present study.
Bacillus coagulans;growth performance;microbial population;short-chain fatty acids;jejunum morphology
S816.7
A
1004-3314(2016)07-0031-04
10.15906/j.cnki.cn11-2975/s.20160708


