高效液相色谱紫外检测法测定添加剂预混合饲料中叶酸含量
冯秀燕,杨宝良,魏秀莲,张亚君
(北京市饲料监察所,北京朝阳100107)
检测分析
高效液相色谱紫外检测法测定添加剂预混合饲料中叶酸含量
冯秀燕*,杨宝良,魏秀莲,张亚君
(北京市饲料监察所,北京朝阳100107)
本实验建立了添加剂预混合饲料中叶酸测定的高效液相色谱紫外检测测定方法。样品经碳酸钠溶液提取,通过阴离子交换柱净化富集,高效液相色谱紫外法测定。结果表明:叶酸浓度为0.1~250.0 μg/mL时,具有良好的线性关系,样品回收率为79.9%~100.4%,相对标准偏差小于10%,定量限可达0.3 mg/kg,适用于添加剂预混合饲料中叶酸含量的测定。
饲料;叶酸;高效液相色谱法;测定
叶酸是B族维生素中的一员,在体内被还原酶还原为四氢叶酸,成为多种代谢过程中的辅酶。叶酸的缺乏会影响动物健康和生产性能。叶酸缺乏时雏鸡免疫力低下(牛发良等,2002)。研究表明补充叶酸可改善母猪繁殖性能,提高肉仔鸡生产性能(丑武江等,2009)。目前,叶酸已经成为现代饲料工业中是一种常用的保障动物健康和良好生产性能的饲料添加剂。本实验采用高效液相色谱紫外检测的方法,研究建立了适用于添加剂预混合饲料中叶酸含量测定的方法。
1 材料与方法
1.1仪器和设备高效液相色谱仪:配紫外检测器或二极管阵列检测器;分析天平:感量0.1 mg、感量0.01 mg;超声波振荡器;离心机:转速不低于10000 r/min;涡旋混合器;pH计:精度为0.01;0.22 μm微孔滤膜;固相萃取装置;固相萃取柱:200 mg/6 mL,Bonel Elu+Plexa PAX或相当者。
1.2试剂与溶液0.1 mol/L Na2CO3溶液、0.1 mol/L EDTA溶液、0.05 mol/L NaH2PO4溶液(pH= 6.30)、GB/T 6682规定的一级用水,甲醇为色谱纯,叶酸对照品纯度大于97.4%。
叶酸标准储备液:准确称取叶酸对照品12.5 mg左右,用0.1 mol/L Na2CO3溶液溶解,加入100 μg抗坏血酸并用水定容至50 mL棕色容量瓶中,配制成250 μg/mL的标准储备液。4℃避光保存,有效期为2个月。
叶酸标准工作液:准确量取1.0 mL叶酸标准储备液,用水定容至50 mL容量瓶中,稀释成5.0 μg/mL的标准工作溶液,现配现用。
1.3测定方法
1.3.1提取准确称取添加剂预混合饲料试样1 g(精确到0.0001 g)至50 mL离心管中,加入8 mL 0.1 mol/L EDTA溶液,涡旋混合2 min,加入25 mL甲醇,涡旋均匀混合2 min,全部转移至50 mL容量瓶,再加入10 mL 0.1 mol/L Na2CO3溶液,蒸馏水定容至50 mL。超声提取15 min后,取20 mL样液于50 mL离心管,10000 r/min离心10 min。准确移取上清液10.0 mL于15 mL离心管中,在40℃下氮气吹至6.5 mL(维生素预混合饲料可以不经过净化过程直接过0.22 μm滤膜上机)。
1.3.2净化PAX固相萃取小柱先用5 mL甲醇活化,再用5 mL水进行平衡后,移取全部6.5 mL备用液过柱。取5 mL水冲洗盛放上清液的离心管,充分转移至萃取柱中淋洗,再用5 mL甲醇淋洗,抽干5 min,用6 mL洗脱液,每次2 mL分3次洗脱,流速控制在1 mL/min,收集洗脱液;洗脱液在40℃下氮气吹至1.0 mL以下,向残余物中加水定容至1.0 mL,超声2 min,混匀后过0.22 μm滤膜,供高效液相色谱仪测定。
1.3.3液相色谱参考条件色谱柱为耐碱性C18柱(可耐受pH值10):柱长100 mm,内径4.6 mm,粒径2.7 μm或相当者。柱温为30℃。检测器为紫外检测器或二极管阵列检测器,检测波长为280 nm,流速为1.0 mL/min,进样量为5~10 μL。
流动相:A相为0.05 moL/L磷酸二氢钠(pH= 6.30);B相为甲醇。梯度洗脱程序见表1。
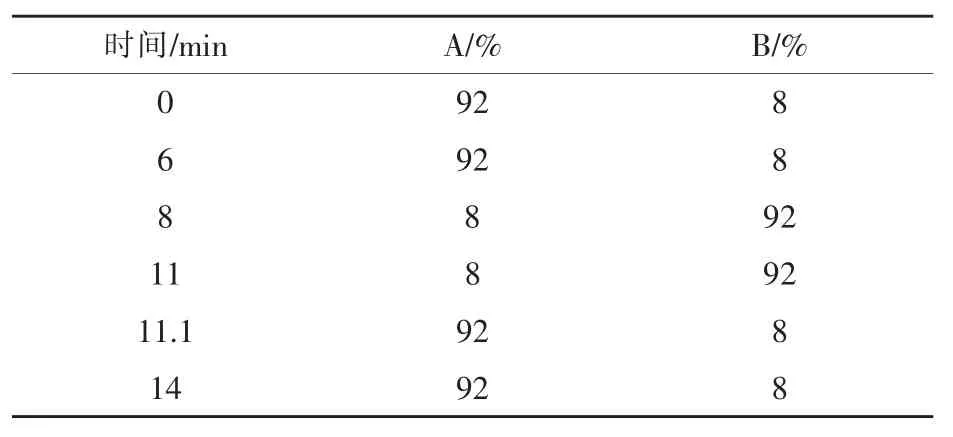
表1 梯度洗脱程序
1.3.4定量测定在仪器正常工作条件下,分别注入叶酸标准工作溶液和试样溶液进行测定。用液相色谱保留时间定性,用标准工作溶液做单点校准,以色谱峰的峰面积进行定量计算,或者以标准工作液中被测组分峰面积为纵坐标,相应被测组分浓度为横坐标绘制工作曲线,用工作曲线对试样进行定量。试样溶液中待测物的响应值均应在仪器测定的线性范围内。
2 结果与分析
2.1色谱图叶酸标准溶液(5.0 μg/mL)、空白饲料样品及空白添加样品的色谱图见图1~4。由色谱图可见,在本实验条件下,被测物叶酸有良好的分析效果,空白饲料及添加样品无干扰。

图1 叶酸标准溶液(5.0 μg/mL)色谱图

图2 几种水溶性维生素的混标色谱图

图3 空白预混合饲料试样色谱图

图4 预混合饲料试样中添加0.3 μg/g叶酸色谱图
2.2线性范围、检出限和定量限根据叶酸的添加范围,配制了6个不同浓度的叶酸标准系列工作溶液,分别为:0.1、0.5、2.5、10.0、25.0、250.0 μg/mL,在本实验色谱条件下进行分析,根据叶酸的浓度与峰面积的响应值进行分析。在0.1~250 μg/mL线性良好,线性回归方程为:y=39.827x+5.4049,r=1.0000。添加1 μg/mL的叶酸标准溶液0.1 mL于1.0 g空白饲料中(即添加浓度为0.1 mg/kg),经提取后测定,叶酸的信噪比S/N>3,表明方法的检出限可达到0.1 mg/kg。添加1 μg/mL的叶酸标准溶液0.3 mL于1.0 g空白饲料中(即添加浓度为0.3 mg/kg),经提取后测定,叶酸的信噪比S/N>10(按PtP算),表明方法的定量限可达到0.3 mg/kg。对预混料进行添加回收实验,使其浓度为0.3 mg/kg。结果表明,在饲料中添加0.3 mg/kg的叶酸,回收率可达到79.9%,可以满足测定的要求。因此,定量限可达0.3 mg/kg。
2.3准确度和精密度以空白预混料为基础进行添加回收实验,验证该方法的准确度和精密度。由表2可知,每种饲料中叶酸添加3个浓度水平。每个浓度设5个平行,计算添加回收率、批内变异系数。在3个浓度添加水平下,平均回收率为79.9%~100.4%。试验数据表明,本方法的准确度和精密度都符合检测分析的要求。

表2 准确度和精密度实验测定结果(n=5)
2.4色谱条件的确立根据叶酸的极性特点检测多用反相色谱柱。选用了SB-C18和HPH-C18两种进行比较,发现SB-C18的分离效果虽然很好,但是相对于HPH-C18而言,其耐碱性能明显要弱。在本方法的色谱条件下,使用寿命非常短。而HPH-C18色谱柱既很好地解决了耐碱问题,在分离效果上也能够满足要求。所以最终选择了HPH-C18色谱柱。由图5可知,根据叶酸在紫外区的吸收特点,确定检测波长为280 nm。进样量为5~10 μL。流速为1.0 mL/min。

图5 叶酸光谱图
2.5提取条件的确定叶酸易溶于弱碱性溶液而微溶于水。用0.1 moL/L的碳酸钠溶液提取叶酸,发现叶酸回收率不是很高,主要源于饲料配方复杂,含多种基质,微量元素中铁、铜、锌的存在也对叶酸的提取造成了一定的影响。根据这种情况从螯合金属元素等方面入手,解决叶酸回收率低的问题。经实验研究,称取1 g试样加入10 mL的EDTA可满足检测要求。通过上述研究,确定了本实验的提取条件。
2.6净化条件的选择目前SPE柱子广泛应用于各类分析,因此对不同种类、不同规格、不同厂家柱子的吸附能力进行考察:waters公司C18柱;supelco公司C18柱;agilent公司的PAX柱。分别用5 μg/mL的标准溶液直接上柱,结果发现agilent公司的PAX柱回收率可达98%以上,因此选用PAX柱来做净化,通过条件优化确定了本实验的净化条件。
3 结论
本实验采用高效液相色谱紫外检测方法测定添加剂预混合饲料中的叶酸含量,方法的回收率和精密度能够满足检测要求,并大大降低了方法的定量限,方法的定量限可达到0.3 mg/kg,回收率为79.9%~100.4%,适用于各种添加剂预混合饲料中叶酸的测定。
[1]丑武江,郭雄全,葛文霞.叶酸对肉仔鸡蛋白质及生产性能的影响研究[J].新疆农业科学[J].2009,46(5):1140~1143
[2]国家质量技术监督局.GB/T 17813-1999[S].中华人民共和国国家标准—复合预混料中烟酸、叶酸的测定高效液相色谱法.北京:中国标准出版社,1999-8-10.
[3]牛发良,侯亚利,秦秀丽,等.添加叶酸对雏鸡免疫功能的作用及意义[J].张家口医学院学报,2002,19(3):3~4.
[4]中华人民共和国卫生部中国国家标准化管理委员会.GB/T 5009.211-2008[S].中华人民共和国国家标准—食品中叶酸的测定.北京:中国标准出版社,2008-11-21.
A high performance liquid chromatography(HPLC)method was developed for the determination of folic acid in feed additive premix.Sample was extracted by the solution of Na2CO3,and purified by ion exchange column.The results showed that:in the range of 0.1~250.0 μg/mL,there was a good linear correlation between the peak area and concentration of folic acid.The average recovery rates in feed were 79.9%~100.4%.The relative standard deviation was below 10%.The quantification limit was 0.3 mg/kg.It was a suitable method for determination of folic acid in feed additive premix.
feed;folic acid;high performance liquid chromatography;determination
S816.17
A
1004-3314(2016)07-0016-03
10.15906/j.cnki.cn11-2975/s.20160704

