分析“测氧”原理激活创新思维
□郭忠辉 叶立华
分析“测氧”原理激活创新思维
□郭忠辉叶立华
教材中关于“空气中氧气含量的测定”实验的原理是利用红磷燃烧消耗密闭容器中的氧气,使密闭容器内压强减小,在大气压的作用下,让水进入容器,测定进入容器内水的体积,即为空气中氧气的体积.该实验要求:(1)可燃物只与空气中的氧气反应,且要过量,如红磷、白磷、铜等;(2)产物一般不能有气体产生,假如将红磷换成硫或木炭,由于生成的是二氧化硫或二氧化碳气体,会导致密闭容器中气体压强变化不明显,影响实验结论;(3)装置不漏气,否则看不到水进入或水进入过少;(4)点燃红磷后要立即伸入集气瓶中,并塞紧瓶塞,防止红磷燃烧放出热量使部分空气受热逸出而导致进入水的体积大于
(5)待红磷熄灭并冷却后,再打开弹簧夹,防止温度偏高时,气体体积膨胀,使进入集气瓶内的水的体积减少,从而造成实验结果偏小.
根据课本中“空气中氧气含量的测定”实验的原理,我们还可以设计出很多“测氧”装置,例如下图1的这些装置:

图1
以上这些装置的操作方法各不相同,但是基本原理都是相同的,同学们还可以设计更多的实验方案来测定空气中氧气的含量.
例1(武汉市)某化学兴趣小组的同学在老师的指导下,正确完成如图2所示的两个实验.已知所用实验装置气密性良好.

图2
关于该实验,有如下说法:①红磷熄灭并冷却后才能打开弹簧夹;②点燃酒精灯加入铜丝,可观察到铜丝由红色变成黑色;③停止加热后即可读出注射器内气体的体积约为24m L;④实验取用铜丝质量的多少不会影响实验结果;⑤两个实验均能证明空气是混合物;⑥两个实验均能证明空气中约含体积的氧气.其中正确说法的个数有().
A.2个B.3个
C.4个D.5个
解析:分析两个实验的实验原理:都是通过可燃物(红磷或铜丝)在密闭容器里的空气中燃烧,消耗了氧气,压强减小,通过密闭容器里的空气的减少来测定空气中氧气的体积分数.为了全部消耗掉氧气,红磷和铜丝的量必须是足量的;气体的体积容易受温度的影响,读数时必须等到装置冷却至室温再读,所以说法③和④都是错误的.
答案:C
点评:空气中氧气含量的测定方法各异,但其原理基本上是一致的,即利用可燃物与密闭容器内空气中的氧气反应,耗尽其中的氧气,且生成物为固体,使容器内气体的压强小于外界大气压,于是水(或其他液体)进入容器内的体积约为消耗的氧气的体积,从而得出结论.但实验时,都应注意可燃物必须过量(或足量);装置气密性良好;燃烧完毕,必须等装置冷却至室温后,才能打开弹簧夹等.
例2(烟台市)实验是科学探究的重要方法.如图3是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题.

图3
(1)根据下表提供的实验数据,完成下表:
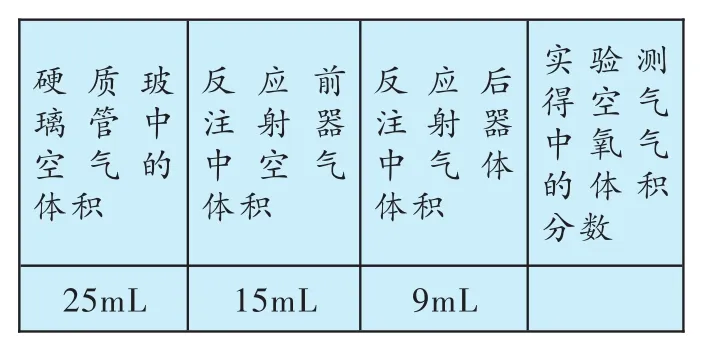
硬质玻璃管中空气的体积2 5 m L反应前注射器中空气体积1 5 m L反应后注射器中气体体积9 m L实验测得空气中氧气的体积分数
(2)装置甲和装置乙中气球的位置不同,____(填“装置甲”或“装置乙”)更合理,理由是_______.
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)__________;__________.
解析:该题是用铜粉测定氧气在空气中的体积分数,属于实验方法和过程的探究.
(1)注射器内气体减少的量就是氧气的体积,则实验测得空气中氧气的体积分数为:
(2)装置乙与装置甲比较,装置乙中的气球在玻璃管的后部,更易让空气流通,氧气与铜能充分反应.
(3)在测定空气中氧气的体积分数时,实验后发现测定氧气的体积分数低于五分之一,可能的原因有:①铜粉的量可能不足,没有将氧气消耗尽;②装置可能漏气;③实验中可能未等装置冷却至室温就读数等.
答案:(1)15%(2)装置乙能让空气更易流通,全部通过铜粉,使氧气与铜粉充分反应(3)铜粉的量不足未待装置完全冷却至室温就读数(其他合理答案也可)
点评:根据课本中“空气中氧气含量的测定”实验的原理,我们可以设计很多“测氧”装置,这些装置经过改进后往往更具有趣味性、简约性、绿色化等优点,测量结果也更准确.解决这类创新型实验的关键是要依据“测氧”原理,明确这些装置的特点及操作方法,遇到具体问题具体分析,达到解决问题的目的.


