基因3型慢性丙型肝炎患者经济化治疗的临床观察
雷华 庄林 王晴晴 田波 柏保利 陈洁
·临床与基础研究·
基因3型慢性丙型肝炎患者经济化治疗的临床观察
雷华庄林王晴晴田波柏保利陈洁
目的研究丙型肝炎病毒(HCV)基因3型感染者对普通干扰素和利巴韦林联合治疗的疗效。方法对2012年5月-2015年6月在我院就诊的抗-HCV和HCV RNA双阳性的1677例HCV患者进行基因分型,将其中2012年6月至2013年12月的120例HCV 3型初治患者采用普通干扰素(皮下注射IFN-α 1b 5 MU/d,连续15 d;此后1次/隔日)联合利巴韦林(RBV 15 mg/kg·d)抗病毒治疗48周的方案;20例HCV 3型初治患者采用PegIFN-α 2b(80 μg/周)联合利巴韦林(RBV 15 mg/kg·d)治疗24周作为对照组。将普通干扰素联合利巴韦林抗病毒治疗获得快速病毒学应答(RVR)的患者,按照病毒载量分两组:≤1×105IU/L(低病毒载量),A1组;>1×105IU/L(高病毒载量),A2组;获得早期病毒学应答(EVR),B组;未获得早期病毒学应答,C组。治疗前后和随访中检测患者血浆HCV RNA水平作为疗效评价的指标。结果在1677份标本中,检测到5种基因型,其中HCV基因lb型有263例,HCV基因2a型195例,HCV基因3a型314例,HCV基因3b型697例,HCV基因6a型67例,不能确定型别141例;其中基因3型(3a和3b)占总数的60.3%。治疗组112例患者完成既定治疗方案,92例(76.7%)患者获得SVR;其中A1组37例患者,33例(89.1%)获得SVR;A2组34例患者,28例(82.3%)获得SVR;B组(EVR)41例,31例(75.6%)获得SVR;C组(未获得EVR)8例: 3例患者将普通干扰素调整为PegIFN,5例患者终止治疗。对照组20例均完成既定治疗方案:18例获得SVR,SVR率为90%。 A1、A2组与对照组差异无统计学意义(P>0.05)。结论(1)昆明地区慢性丙型肝炎患者以基因3型为主。(2)普通干扰素联合利巴韦林治疗获得RVR的3型慢性丙型肝炎患者疗效好。
肝炎病毒;丙型;基因3型;低病毒载量;普通干扰素;疗效
近几年,我国每年丙型肝炎病毒(HCV)感染者报告数量逐年增加[1],2013年有逾20万慢性丙型肝炎(CHC)病例上报中国疾病预防控制中心,且多地已出现疫情的暴发,部分农村地区HCV流行率较高。患者感染HCV后约50%~80%发展成慢性,其中20%~30%的患者发展为肝硬化或肝癌[2]。既往研究已经发现,基因1 型患者的肝硬化和肝癌风险高于基因2 型[3], 而基因3 型患者的疾病进展风险更高[4-7],其肝硬化风险较基因1 型患者增加31%、HCC 风险增加近1 倍,达80%[8]。故临床切不可因其治疗较基因1 型相对容易而放松疾病监测和治疗管理。
对2012年5月至2015年6月在我院就诊的1677例慢性丙型肝炎患者进行HCV病毒基因分型,对2012年6月至2013年12月中的120例HCV 基因3型初治患者选择普通干扰素联合利巴韦林进行治疗,观察疗效。
资料和方法
一、研究对象
2012年5月至2015年6月在我院就诊的抗-HCV和HCV RNA双阳性的1677例HCV患者进行基因分型,将2012年6月至2013年12月的140例HCV 基因3型初治患者作为本研究对象,其中男性 84例,女性 56例,年龄19~59岁,平均35.7岁。140例CHC均符合2009 年制定的《慢性丙型肝炎抗病毒治疗专家共识》中的诊断标准。入选标准:(1)18~65岁的男性或女性患者;(2)血清抗HCV抗体至少2次检测结果为阳性,HCV RNA≥1.0×103IU/mL。排除标准:(1)妊娠及哺乳期妇女;(2)6个月内接受过抗病毒或免疫抑制剂治疗的患者;(3)合并甲、乙、丁、戊型病毒性肝炎及HIV感染患者;(4)自身免疫性肝病、代谢性肝病、酒精性肝病患者;(5)恶性肿瘤、失代偿期肝病及器官移植术后患者;(6)甲状腺疾病、糖尿病患者;(7)精神疾病患者。
二、分组与治疗方案
根据患者经济承受程度,分为治疗组120例和对照组20例。治疗组120例基因3型的HCV初治患者按照下列方案:普通干扰素(皮下注射IFN-α 1b 5 MU/d,连续15 d;此后1次/隔日;药物购自北京三元基因药业股份有限公司)联合利巴韦林(RBV 15 mg/kg·d)治疗48周,获得快速病毒学应答(RVR),按照病毒载量分组:≤1×105IU/L(低病毒载量)A1组;>1×105IU/L(高病毒载量)A2组;获得早期病毒学应答(EVR)B组;未获得早期病毒学应答,调整干扰素制剂或终止治疗,C组;20例HCV 3型初治患者采用PegIFN-α 2b(80 μg/周)联合利巴韦林(RBV 15 mg/kg·d)治疗24周作为对照组。主要终点是SVR24。
三、主要检测方法及试剂
实时荧光PCR定量法检测患者HCV RNA值(试剂购自深圳凯杰工程有限公司);HCV RNA阳性患者进行特异性探针杂交法基因分型(试剂购自中山大学达安基因股份有限公司):根据GenBank已发表的25株HCV基因序列和Tree view软件中HCV的基因型特点,选择HCV 5′端非编码区(5′NCR),采用Primer Premier 5.0软件自行设计引物和特异性探针。提取血浆HCV RNA,经过RT-PCR反应与巢式PCR扩增,将扩增产物进行斑点杂交,根据酶联显色反应结果判断HCV基因型。
四、疗效判定
疗效考核指标包括(1)RVR:在治疗4周时血清HCV RNA定量<103IU/mL;(2)EVR:在治疗12周时血清HCV RNA定量<103IU/mL或血清HCV RNA定量下降超过2个对数值;(3)SVR:在治疗结束24周后血清HCV RNA定量<103IU/mL;(4)无应答(NR):从未获得EVR或SVR;(5)复发:在治疗结束时血清HCV RNA定量<103IU/mL,但在24周随访期间HCV RNA定量又升高>103IU/mL。
五、统计学方法
用SPSS 10.0统计软件进行分析,用χ2检验比较SVR率,P<0.05为差异有统计学意义。
结 果
一、HCV基因分型结果
在1677份标本中,检测到5种基因型,其中HCV基因lb型有263例,HCV基因2a型195例,HCV基因3a型314例,HCV基因3b型697例,HCV基因6a型67例,不能确定型别141例;其中基因3型(3a和3b)占60.3%。
二、病毒学应答结果
治疗组112例完成既定疗程(其中8例患者未获得EVR,调整干扰素制剂或终止治疗),92例(76.7%)患者获得SVR。其中A1组37例患者,33例(89.1%)获得SVR;A 2组34例患者,28例(82.3%)获得SVR;B组(EVR)41例,31例(75.6%)获得SVR。对照组20例患者均完成既定疗程,18例(90%)获得SVR。3组治疗组SVR率与对照组的SVR率卡方检验比较(表1),其中A1、A2组与对照组差异无统计学意义(P>0.05)。
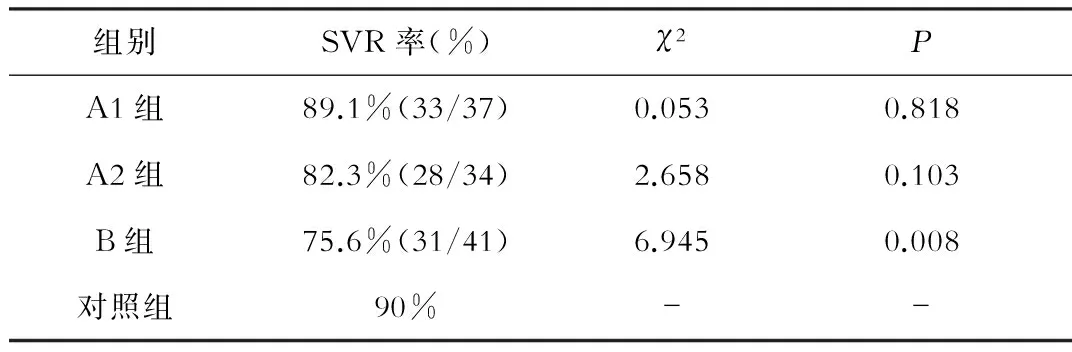
表1 3组患者的SVR率
三、普通干扰素与PegIFN费用的比较
采用普通干扰素治疗48周的费用为12.320万,而采用PegIFN治疗24周的费用为26.880元。
讨 论
近年来,一系列直接抗病毒药物(DAA)的问世,丙型肝炎治疗领域取得了突破性进展。但由于各种原因,国内现阶段仍然要以干扰素联合利巴韦林二联疗法作为抗病毒治疗的唯一选择。
丙型肝炎的干扰素联合利巴韦林抗病毒治疗效果与其基因型密切相关,HCV lb型病毒感染者的干扰素疗效低于非lb型的感染者[9-10],然而非lb型的感染者抗病毒治疗也存在SVR的型别差别,比如基因3型的疗效就低于基因2型的疗效[11-14]。对HCV基因1型患者而言[15-17],PegIFN 联合RBV的方案疗效优于普通IFN联合RBV方案;而对于HCV基因3型肝炎患者,国外研究发现在联用RBV的前提下,PegIFN和IFN的疗效没有明显区别[11-12,18-21]。对昆明地区1677例丙型肝炎患者进行病毒基因分型,发现该地区的HCV基因型以3型(3a和3b)为主,占60.3%。对慢性丙型肝炎基因3型初治患者通过采用普通干扰素(IFN-α 1b 5MU)联合利巴韦林(RBV 15 mg/kg·d) 的治疗方案,应用RGT策略进行抗病毒治疗发现,获得RVR的患者,可获的与PegIFN联合利巴韦林治疗相近的疗效,社会经济效益好。
在发展中国家,面对基因2、3型的HCV患者,普通干扰素联合利巴韦林是否能够带来更多的获益在本研究中采用的样本数较少,还需要更大的样本量来进行探讨,为临床提供更多有价值的参考数据。
[1]中华人民共和国卫生部.卫生部发布2012年1月及2011年度全国法定传染病疫情概况[EB/OL]. 2012.http://www.moh.gov.cn/publicfiles/business/Htmlfiles/mohjbyfkzj/s3578/201202/54106.htm
[2]Omata M, Kanda T, Yu ML, et al. APASL consensus statements and management algorithms for hepatitis C virus infection. Hepatol Int, 2012,6:409-435.
[3]Raimondi S, Bruno S, Mondelli MU, et al. Hepatitis C virus genotype 1b as a risk factor for hepatocellular carcinoma development: a meta-analysis. J Hepatol, 2009,50:1142-1154.
[4]Probst A, Dang T, Bochud M, et al. Role of hepatitis C virus genotype 3 in liver fibrosis progression-a systematic review and meta-analysis. J Viral Hepat, 2011,18:745-759.
[5]McMahon BJ, Bruden D, Bruce MG, et al. Adverse outcomes in Alaska natives who recovered from or have chronic hepatitis C infection. Gastroenterology,2010, 138:922-931.
[6]Nkontchou G, Ziol M, Aout M, et al. HCV genotype 3 is associated with a higher hepatocellular carcinoma incidence in patients with ongoing viral C cirrhosis. J Viral Hepat, 2011,18:e516-e522.
[7]van der Meer AJ, Veldt BJ, Feld JJ, et al. Association between sustained virological response and all-cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis. JAMA, 2012,308:2584-2593.
[8]Kanwal F,Kramer JR,Ilyas J,et al. HCV genotype 3 is associated with an increased risk of cirrhosis and hepatocellular cancer in a national sample of U.S. Veterans With HCV. Hepatology, 2014, 60:98-105.
[9]Mangia A, Minerva N, Bacca D, et al. Individualized treatment duration for hepatitis C genotype l patients:A randomized controlled trial.Hepatology,2008,47:43-50.
[10]McHutchison JG,Lawitz EJ,Shiffman ML,et al.Peginterferon Alfa-2b or Alfa-2a with Ribavirin for Treament of Hepatitis C Infection. N Eng J Med,2009,361:580-593.
[11]Ferenci P, Brunner H, Laferl H, et al. A randomized, prospective trial of ribavirin 400 mg/day versus 800 mg/day in combination with peginterferon alfa-2a in hepatitis C virus genotypes 2 and 3. Hepatology, 2008, 47:1816-1823.
[12]Borroni G, Andreoletti M, Casiraghi MA, et al. Effectiveness of pegylated interferon/ribavirin combination in 'real world' patients with chronic hepatitis C virus infection. Aliment Pharmacol Ther, 2008, 27:790-797.
[13]Berg T, Carosi G. Optimizing outcomes in patients with hepatitis C virus genotype 2 or 3. Antivir Ther, 2008, 13 Suppl 1:17-22.
[14]Elefsiniotis IS, Pantazis KD, Dimitroulopoulos D, et al. Impact of shorter duration of treatment on virological response rate in genotype 2 or 3 chronic hepatitis C virus infection. Indian J Gastroenterol, 2007, 26:209-213.
[15]Manns MP, McHutchison JG, Gordon SC, et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial.Lancet,2001,358:958-965.
[16]Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med,2002,347:975-982.
[17]Romero-Gomez M, Del Mar Viloria M, Andrade RJ, et al. Insulin resistance impairs sustained response rate to peginterferon plus ribavirin in chronic hepatitis C patints. Gstroenterology,2005,128:636-641.
[18]Dalgard O, Bjro K, Ring-Larsen H, et al. Pegylated interferon alfa and ribavirin for 14 versus 24 weeks in patients with hepatitis C virus genotype 2 or 3 and rapid virological response. Hepatology, 2008, 47:35-42.
[19]Poustchi H, Negro F, Hui J, et al. Insulin resistance and response to therapy in patients infected with chronic hepatitis C virus genotypes 2 and 3. J Hepatol, 2008, 48:28-34.
[20]Rumi MG, Aghemo A, D'Ambrosio R, et al. Lack of rapid virological response predicts interferon-alpha2b/ribavirin therapy failure in HCV genotype 2 patients: a single-centre study. Antivir Ther, 2007, 12:1033-1040.
[21]Shiffman ML, Suter F, Bacon BR, et al. Peginterferon alfa-2a and ribavirin for 16 or 24 weeks in HCV genotype 2 or 3. N Engl J Med, 2007, 357:124-134.
(本文编辑:易玲)
650041云南昆明市第三人民医院肝病科(雷华,庄林,王晴晴,田波,柏保利),药剂科(陈洁)
陈洁,Email:mlfzp@126.com
2016-01-24)