小分子抑制剂VLT对乳腺癌细胞生长的影响
关 瑜 周翔宇 陈 垚
(吉林省食品药品安全监测中心,吉林 长春 130000)
小分子抑制剂VLT对乳腺癌细胞生长的影响
关瑜周翔宇1陈垚
(吉林省食品药品安全监测中心,吉林长春130000)
目的研究小分子抑制剂VLT对乳腺癌细胞生长的影响。方法采用四甲基偶氮唑蓝(MTT)法检测乳腺癌细胞在不同时间段(12、48、72 h)的细胞增殖活性;流式细胞仪检测乳腺癌细胞周期及细胞凋亡率的变化。结果小分子抑制剂VLT对乳腺癌细胞具有明显的抑制作用,并在48 h作用最为明显;VLT 2 000 μg/ml组与正常对照组及VLT 1 000 μg/ml组比较显著差异(P<0.05);G0/G1期细胞显著升高,S 期细胞数减少;细胞凋亡率明显增加,VLT 2 000 μg/ml组分别与空白对照及VLT 1 000 μg/ml组比较均差异显著(P<0.05)。结论小分子抑制剂VLT可能通过细胞周期的改变,抑制肿瘤细胞增殖,发挥抗肿瘤生长作用。
小分子抑制剂VLT;乳腺癌
乳腺癌的发病原因包括遗传性疾病、生活方式或饮食因素。其传统的治疗原则是术后先放疗后化疗或单独放疗/化疗,但都难以提高其临床疗效〔1〕,目前国内外已研究的抗肿瘤药物众多,但多数价格昂贵且不良反应大。同时也存在耐药性问题,使其临床应用受到一定限制〔2~4〕,本实验旨在研究小分子抑制剂VLT对乳腺癌细胞生长的影响。
1 材料与方法
1.1细胞、主要试剂及药品 乳腺癌细胞株:购自中国科学院上海细胞生物学研究所。主要试剂:(1)细胞周期与细胞凋亡检测试剂盒(产品编号:C1052)由江苏碧云天生物技术研究所产品;(2)二甲基亚砜、四甲基偶氮唑蓝 (MTT),美国Sigma 公司产品;(3)小分子抑制剂VLT由上海吉尔公司合成,纯度为98%;(4)多西他赛由海正辉瑞制药有限公司生产,国药准字H20093520。
1.2主要仪器(1)倒置显微镜 NiKon ECLIPSE 80i (日本尼康公司);(2)二氧化碳培养箱(日本三样电机株式会社制造 产品型号:NCO-15AC);(3)AN YANG 超净台 (中国苏州安洋科技发展有限公司,型号:BSC-BOOⅡB2);(4)流式细胞仪(美国becton-Dickson公司);(5)酶标仪(中国上海BIO-RAD公司,MODEL550型)
1.3方法(1)MTT法检测细胞存活率:取对数生长期乳腺癌细胞,常规胰酶消化,计数,以每孔1×104/ml接种于96孔板中,100 μl/孔,终体积为200 μl,37℃、5%CO2孵育箱培养4 h,待细胞贴壁后,随机分为空白对照组、多西他赛(100 μg/ml)组及不同浓度VLT(1 000、1 500、2 000 μg/ml)组,20 μl/孔,空白对照组加入等体积的培养液,每组分别设5个复孔。置入37℃、5%CO2培养,分别孵育24、48、72 h,每孔加入20 μl MTT孵育4 h,以二甲基亚砜(DMSO)每孔150 μl终止反应。将96孔板移入平板振荡器,水平振荡10 min。用酶联免疫检测仪于490 nm波长测定吸光度(A)值,以空白对照孔A值凋零,记录结果。(2)流式细胞术检测细胞周期:取对数生长期乳腺癌细胞,常规胰酶消化,计数,以每孔1×106/ml接种6孔板中,分组及给药浓度方法同上,在培养48 h后,收集细胞,加入冰冷的磷酸盐缓冲液(PBS)将细胞轻轻吹打成单个细胞,离心,PBS洗2次,用500 μl PBS从悬细胞,每离心管中加入各100 μl〔1 mg/ml碘化吡啶(PI)、10 mg/ml RNaseA、0.01%Triton-X100〕,37℃避光染色30 min。采用流式细胞仪测定细胞周期变化,结果以各个细胞周期所占的百分率表示。(3)Annexin V-FITC/PI 法分析细胞凋亡:取对数生长期乳腺癌细胞,常规胰酶消化,计数,以每孔5×105/ml接种6孔板中,分组及给药浓度方法同上,在培养48 h后,收集细胞,并用冰冷的PBS洗涤,加入195 μl Annexin V-FITC结合液轻轻重悬细胞,室温(20℃~25℃)避光孵育10 min,加入10 μl PI染色液,轻轻混匀冰浴,避光放置,采用流式细胞仪进行检测。
1.4统计学分析采用SPSS13.0软件进行t检验。
2 结 果
2.1MTT法检测细胞活性如表1所示,不同剂量小分子抑制剂-VLT作用于乳腺癌细胞在24 h时,各实验组比较无显著差异(P>0.05)。在48 h,VLT 2 000 μg/ml组与正常对照组及VLT 1 000 μg/ml组比较显著差异(P<0.05),VLT 2 000 μg/ml组与多西他赛组比较无显著差异(P>0.05);在72 h时,各实验组比较无统计学意义(P>0.05)。
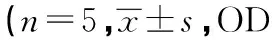
表1 VLT对乳腺癌细胞增殖活性的影响值)
与VLT 2 000 μg/ml组比较:1)P<0.05;下表同
2.2小分子抑制剂-VLT对乳腺癌细胞周期和凋亡率检测在48 h,VLT能够引起乳腺癌细胞周期发生改变,VLT 2 000 μg/ml组G0/G1期比例明显升高,S期细胞数明显减少,细胞凋亡率明显增加,分别与空白对照组及VLT 1 000 μl/ml组比较差异显著(P<0.05),VLT 2 000 μl/ml组与多西他赛组比较无统计学意义(P>0.05)。见表2。
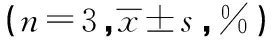
表2 VLT对乳腺癌细胞周期及凋亡的影响
3 讨 论
近年来,乳腺癌发病年龄有逐渐年轻化的趋势〔5〕,由于发病机制目前仍不清楚,其治疗一直没有重大突破。目前主要通过手术治疗,并联合化疗、放疗减少肿瘤的复发及转移,但其治愈率仍较低。
有研究报道,肿瘤的发生是多途径、多步骤的,还与细胞凋亡有关,细胞增殖与凋亡之间的平衡失调与肿瘤的发生、发展密切相关。因此,抑制肿瘤细胞增殖,诱导其凋亡已成为肿瘤治疗的重要手段之一〔6~8〕。本实验表明小分子抑制剂VLT 2 000 μg/ml组细胞生长具有明显抑制作用。
研究表明,细胞癌变与细胞周期密切相关。多种抗肿瘤药物对细胞周期有特异的阻滞作用,导致肿瘤细胞停滞在G2/M期而发挥治疗作用〔9,10〕。流式细胞术检测细胞凋亡水平具有直观、准确等优点〔11〕。本研究结果推测小分子抑制剂-VLT对乳腺癌细胞生长是通过阻滞G0/G1期细胞,使S期细胞减少,诱导细胞凋亡。
1Zhao JX,Liu XQ,Dong BJ.Primary study of bevacizumab combined with temozolomide for recurrent glioma〔J〕.Chin Clin Oncol,2011;16(10):920-2.
2Okada M,Sato A,Shibuya K.JNK contributes to temozolomide resistance of stem-like glioblastoma cells via regulation of MGMT expression〔J〕.Int J Oncol,2014;44(2):591-9.
3Sze CI,Su WP,Chiang MF,etal.Assessing current therapeutic approaches to decode potential resistance mechanisms in glioblastomas〔J〕.Front Oncol,2013;3:59.
4Silber JR,Bobola MS,Blank A,etal.O(6)-methylguanine- DNA methyltransferase in glioma therapy:promise and problems〔J〕.Biochim Biophys Acta,2012;1826(1):71-82.
5Ratchanon S,Phaloprakarn C,Traipak K.Pain control in laparoscopic gynecologic surgery with/without preoperative parecoxib sodium injection:a randomized study〔J〕.J Med Assoc Thai,2011;94(10):1164-8.
6方艳秋,齐亚灵,白晓,等.Survivin反义核苷酸对肝细胞株SMMC-7721增殖的影响〔J〕.吉林大学学报:医学版,2013;39(2):278-81.
7Cobbs CS.Cytomegalovirus and brain tumor:epidemiology,biology and therapeutic aspects〔J〕.Curr Opin Oncol,2013;25(6):682-8.
8Dubrez L,Berthelet J,Glorian V.IAP proteins as targets for drug development in oncology 〔J〕.Oncol Targets Ther,2013;9:1285-304.
9Stuckey DW,Shan K.TRAIL on trail:preclinical advances in cancer therapy〔J〕.Trends Mol Med,2013;26(13):154-8.
10Fink MY,Chipuk JE.Survival of HER2-positive breast cancer cells:receptor signaling to apoptotic control center〔J〕.Genes Cancer,2013;4(5/6):187-95.
11Dabbagh A,Rajaei S.The role of anesthetic drugs in liver apoptosis〔J〕.Hepat Mon,2013;13(8):e13162.
〔2016-03-22修回〕
(编辑李相军/滕欣航)
陈垚(1964-),女,主任药师,主要从事药品安全性评价研究。
关瑜(1983-),女,主管药师,主要从事药品安全性评价研究。
R73
A
1005-9202(2016)15-3636-02;doi:10.3969/j.issn.1005-9202.2016.15.011
1吉林大学中日联谊医院肝胆胰外科

