纤维素降解菌的分离、鉴定及其产酶特性研究
汪 彬,郭照辉,杜东霞
(湖南省微生物研究院,湖南 长沙 410009)
纤维素降解菌的分离、鉴定及其产酶特性研究
汪 彬,郭照辉,杜东霞
(湖南省微生物研究院,湖南 长沙 410009)
从纤维素富集的环境中分离到3株能以羧甲基纤维素钠(CMC-Na)为唯一碳源的纤维素降解菌,采用纤维素-刚果红染色法进一步筛选,获得透明圈较大的菌株1株,命名为为B1。经菌落、菌体形态观察、生理生化实验及分子生物学鉴定,初步确定为蜡样芽胞杆菌(Bacillus cereus),该菌株表现出了较高的滤纸崩解能力和较高的纤维素酶活力。通过培养条件的优化,发现该菌株在起始pH值为5.0的培养基中,37℃培养36 h,其纤维素酶活力可达64.22 U/m L。
纤维素;降解;分离;鉴定;蜡样芽孢杆菌
纤维素是自然界中分布最广泛、来源最丰富的可再生有机资源之一,随着自然界中,不可再生资源的日益枯竭,如何高效利用这一资源成为当前各国关注的重要课题[1-3]。利用微生物可将丰富的有机资源转化为糖和蛋白质,继而成为饲料加工、食品生产等的原材料,从而实现变废为宝[4]。在自然界的长期进化中,可以降解纤维素的微生物有细菌、真菌、放线菌等,其中研究较多的有青霉、木霉、曲霉、纤维弧菌和纤维单胞菌等[5]。利用这些微生物生产的纤维素酶已经广泛应用到食品制造[6]、饲料加工[7]和酒精发酵[8]等领域,但普遍存在纤维素酶活力低、成本高等问题,制约着纤维素资源利用的进一步发展[9]。因此,从自然界中进一步开发纤维素酶高产菌种并加强菌株选育等基础研究,是纤维素资源能否高效利用的关键所在。研究从高温堆肥中分离纤维素分解菌,并对其酶学特性进行了研究,为纤维素酶制剂的开发提供菌株资源。
1 材料与方法
1.1 试验材料
试验材料为富含纤维素的土壤样品(采集自宁乡县回龙埔镇)以及畜禽粪便、作物秸秆的堆肥样品(湖南泰谷生物科技股份有限公司)。
供试培养基:初筛分离平板培养基(羧甲基纤维素钠20 g/L、MgSO40 .5 g/L、K2HPO41.0 g/L、NaCl 0.5 g/L、琼脂20 g/L,pH值自然),复筛培养基(羧甲基纤维素钠20 g/L、(NH4)2SO42.0 g/L、KH2PO40.5 g/ L、K2HPO42.0 g/L、MgSO4·7H2O 0.1 g/L、NaCl 6.0 g/L、CaCl20.1 g/L、琼脂20 g/L,pH值7.0~7.5),液体培养基(羧甲基纤维素钠 10 g/L、硫酸铵 4 g/L、磷酸氢二钾2 g/L、七水硫酸镁 0.1 g/L、酵母膏10 g/L、蛋白胨1 g/L,pH值自然),滤纸崩解液体培养基(硫酸铵4 g/L、磷酸氢二钾 2 g/L、七水硫酸镁 0.1 g/L、蛋白胨1 g/L、酵母膏10 g,pH值自然)。
1.2 试验方法
1.2.1 菌株的分离与筛选 (1)处理样品。称取样品10 g,加入90 mL带玻璃珠的无菌水中,振荡30 m in,放置10 min后,将上清液梯度稀释,并涂布在初筛固体培养基上,30℃培养3~5 d。(2)纯化菌株。挑选生长状态较好的菌株并在复筛培养基上划线分离纯化。(3)刚果红染色筛选。将生长状态好、纯化后的株菌分别点接在复筛培养基平板上,30℃培养3~5 d,将培养好的平板用4 g/L的刚果红染色5 m in,冲洗倾去染液,再用0.9% NaCl脱色5 m in,产生纤维素酶的菌落周围将出现明显的透明圈,测其透明圈大小,选取透明圈较大的菌落进行复筛。
1.2.2 复筛培养及酶活力初测 将初筛水解圈比较大的菌株点接到复筛培养基上,30 ℃培养3~5 d;用4 g/L的刚果红染色5 min,再用0.9 % NaCl 冲洗,测水解圈直径,计算酶的相对比活力:A= d/t,式中A为相对活性、d为透明圈直径、t为培养天数。
1.2.3 菌株的鉴定 (1)形态学观察。在LB培养基上观察菌落形态,在光学显微镜下观察菌体形态。(2)生理生化实验。V-P 试验、甲基红试验、吲哚试验、酪蛋白酶实验、糖类的氧化发酵试验(包括葡萄糖、麦芽糖、果糖和阿拉伯糖等)、卵磷脂酶实验、柠檬酸盐利用试验的具体方法均参照《伯杰氏细菌鉴定手册》(第9版)。(3)16S rDN A的序列分析。利用基因组提取试剂盒提取菌株B1的基因组DNA,并以此为模板,采用细菌16S rDNA通用引物(27F和1492R)进行PCR扩增。PCR产物由生工生物工程(上海)股份有限公司进行序列测定。所得序列与GenBank数据库中的已知序列进行比对分析,选择同源性较高的序列构建系统发育树。
1.2.4 纤维素酶活力测定 取离心后的发酵液1 m L与同体积 0.5%的羧甲基纤维素钠溶液混合,50 ℃恒温水浴30 min,迅速加入2.5 m L的DNS试剂,煮沸5 min终止反应,并在 540 nm波长下比色。在上述条件下1 mL 粗酶液所产生的1 μg 葡萄糖定义为 1个酶活力单位,以U/mL表示。
1.2.5 滤纸崩解情况测定 将B1菌株接种于以滤纸为唯一碳源的液体培养基中,37℃下200 r/m in振荡培养3~12 d,观察记录滤纸崩解情况。
1.2.6 纤维素分解菌B1的产酶条件研究 (1)培养时间对B1菌株酶活力的影响。在500 m L的三角瓶中,装入100 mL的液体培养基,接种B1菌株,37℃下200 r/min摇振培养,分别于12、24、36、48、60、72 h取样测定纤维素酶活力。(2)培养温度对B1菌株酶活力的影响。在500 m L的三角瓶中,装入100 mL液体培养基,接种B1菌株,分别在25、30、35、37、40、45℃条件下,以200 r/min的转速摇振培养36 h,取样测定纤维素酶活力。(3)培养基pH值对B1菌株酶活力的影响。在容积为500 mL的三角瓶中,分别装入100 mL起始pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5的液体培养基,接种B1菌株,37℃下200 r/m in摇振培养36 h,取样测定纤维素酶活力。
2 结果与分析
2.1 纤维素分解菌的筛选
经CMC平板初筛和刚果红染色、NaCl 脱色后得到有清晰透明圈的菌株3株(B1~B3,其中B1来自堆肥样品,B2和B3来自土壤样品),将透明圈较大的菌株B1点接到复筛平板培养基上,纤维素水解圈见图 1。培养3 d测得B1菌株纤维素水解圈直径最大为18 mm。纤维素酶的相对比活力A= d/t=18/3=6。

图1 菌株B1的纤维素水解圈
2.2 纤维素分解菌的鉴定
2.2.1 形态学观察 菌株B1在LB平板上培养,菌落呈白色,表面粗糙不透明,边缘呈扩展状。菌体镜检结果为长杆状,可形成芽孢,为革兰氏阳性菌。
2.2.2 生理生化实验 生理生化实验结果:V-P实验、甲基红实验、吲哚实验、酪蛋白酶、卵磷脂酶实验结果均为阳性;柠檬酸盐实验为阴性;可利用葡萄糖、麦芽糖、果糖及阿拉伯糖等碳源。
2.2.3 16S rDNA PCR扩增、序列测定和系统进化树的构建 将测序结果与GenBank中其他基因序列通过BLAST软件进行比较分析,结果表明,该菌株与蜡样芽孢杆菌(Bacillus cereus)有较高的同源性。从GenBank中任意选取芽胞杆菌属7个菌株的16S rDNA序列与蜡样芽孢杆菌B1的序列一起构建系统发育树,如图2所示。B1菌株与蜡样芽孢杆菌(Bacillus cereus)同为一簇,两者的16S rDNA核苷酸同源率为99%。
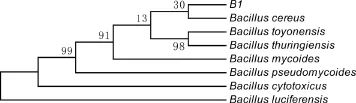
图2 细菌B1的 16S rDNA 序列系统发育树
2.3 B1菌株的纤维素酶活分析
蜡样芽孢杆菌B1以合适的接种量接种到以羧基纤维素钠为唯一碳源的液体培养基中,37℃振荡培养36 h,测定菌株的纤维素酶活力,该菌株的纤维素酶活力为60. 21 U/m L。
2.4 滤纸崩解结果分析
蜡样芽孢杆菌B1以合适的接种量接种到以滤纸为唯一碳源的液体培养基中,培养3 d后滤纸开始变软,其表面可看到少许絮状物;第5天,可见部分滤纸出现崩解,溶液开始变浑浊,絮状物开始增多;培养至12 d后,滤纸全部崩解。
2.5 纤维素酶蜡样芽孢杆菌B1的产酶条件
2.5.1 培养时间对蜡样芽孢杆菌B1酶活力的影晌
从图3中可以看出,该菌株的酶活在培养36 h时达到最大值;培养36~60 h之间,酶活力有轻微下降,但基本处于稳定;培养60 h之后,酶活力迅速下降。
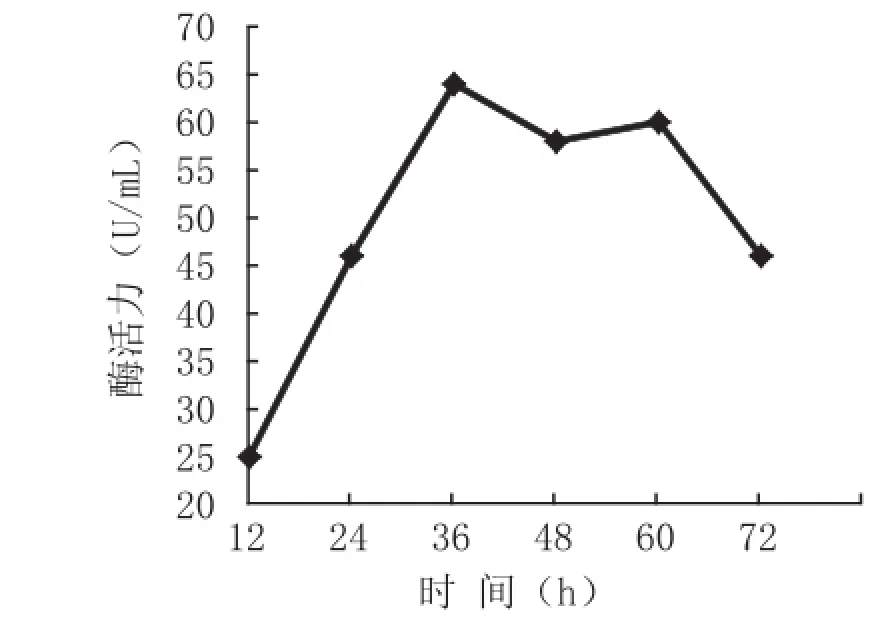
图3 培养时间对菌株B1酶活力的影响
2.5.2 培养温度对蜡样芽孢杆菌B1酶活力的影响
由图4可知,在25~37℃范围内,菌株的酶活力逐渐升高,至37℃达到最大值,而培养温度超过37℃时,酶活力有所降低。
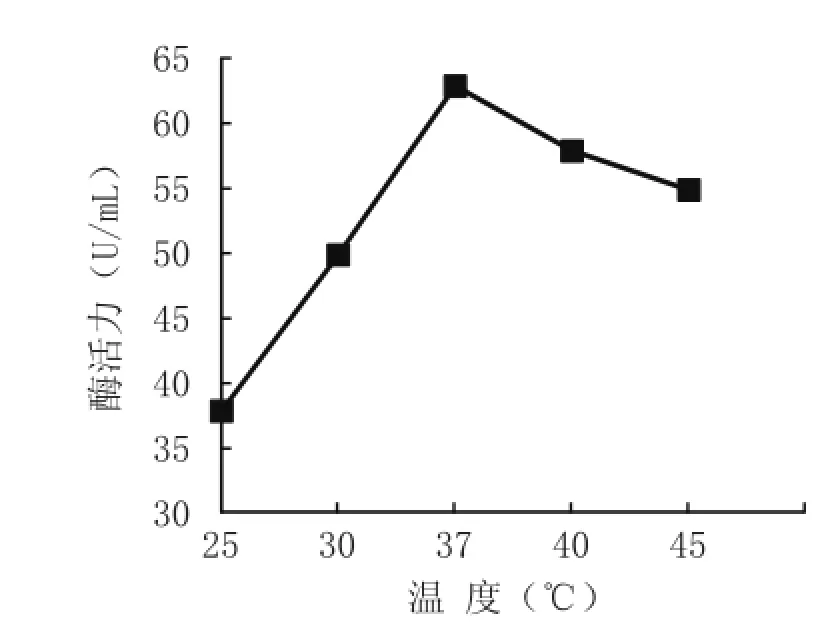
图4 培养温度对菌株B1酶活力的影响
2.5.3 培养基起始pH值对蜡样芽孢杆菌B1产酶的影响 由图5可知,当pH值在4.0~4.5范围内时,酶活力随pH值增加迅速升高,至pH值5.0时达到最大值;当pH值为5.0~6.5之间时,酶活力基本稳定;pH值超过6.5时,酶活力开始逐渐降低。
3 结论与讨论
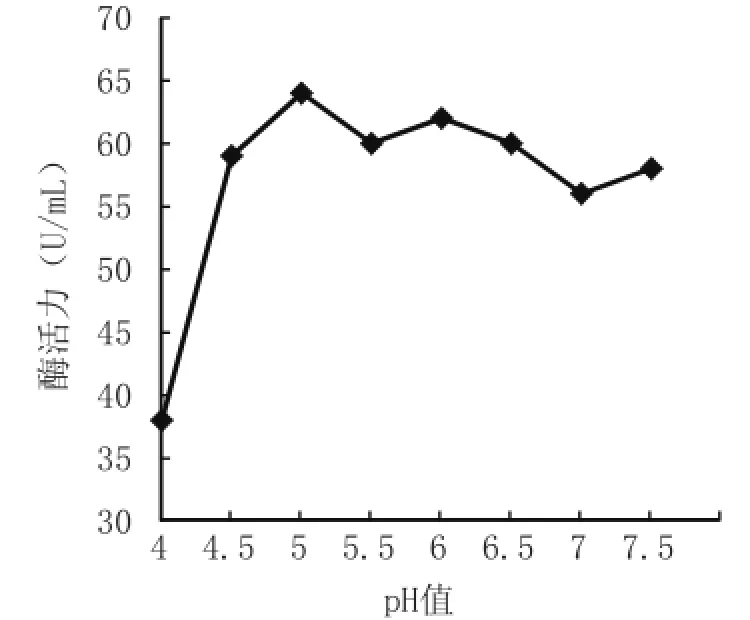
图5 培养基起始pH值对菌株B1酶活力的影响
近年来,有关纤维素分解菌的研究越来越受到关注,从土壤、堆肥、海洋等不同环境中分离纤维素分解菌均有报道。这些菌株所产生的纤维素酶是许多生物化学过程的重要原料。笔者从富集纤维素的环境中筛选分离获得一株纤维素降解菌,该菌株经菌落、菌体形态观察、生理生化实验及分子生物学鉴定,初步确定为蜡样芽胞杆菌,该菌株表现出了较高的滤纸崩解能力和较高的纤维素酶活力。通过培养条件的优化,发现该菌株在起始pH值为5.0的培养基中,37℃培养36 h,其纤维素酶活力可达最大。另外,该菌株分离自纤维素富集的环境中,属芽孢杆菌属细菌,对于构建高产纤维素酶的工程菌株并探索其作用机制具有一定的理论及实践意义。
[1] Wada M,Ike M,Tokuyasu K. Enzymatic hydrolysis of celluloseI is greatly accelerated via its conversion to the cellulose II hydrate form[J]. Polymer Degradation and Stability,2010,95(4):543-548.
[2] Park I,Kim I,Kang K,et al. Cellulose ethanol production from waste newsprint by simultaneous saccharification and fermentation using Saccharomyces cerevisiae KNU5377 [J]. Process Biochemistry,2010,45(4):487-492.
[3] Cardona C A,Sánchez O J. Fuel ethanol production:Process design trends and integration opportunities[J]. Bioresour Technol,2007,98(12):2415-2457.
[4] 石晶瑜,张 功. 分解纤维素菌HT3的筛选及酶活力测定[J]. 内蒙古师大学报(自然科学汉文版),1998,27(1):66-68.
[5] Oksanen T,Pere J,Buchert J,et al. The effect of Trichoderma reesei cellulases and hemicellulases on the paper technical properties of neverdried bleached kraft pulp[J]. Cellulose,1997,(4):329-339.
[6] 陈力宏. 纤维素酶在食品发酵中的应用[J]. 中国酿造,1990,(5):2-5.
[7] 方 俊,王 涛. 纤维素酶在奶牛饲粮中的研究与应用[J]. 饲料博览,2003,(8):34-36.
[8] 邱立友,朱德育. 黑曲霉酶学特性及其在洒精生产中的应用[J]. 河南农业大学学报,1993,27(3):291-295.
[9] Hahn-Hägerdal B,Galbe M,Gorwa-Grauslund M F,et al. Bioethanol the fuel of tomorrow from the residues of today[J]. Trends Biotechnol,2006,24(12):549-556.
(责任编辑:成 平)
Research on Isolation, Identification and Enzyme Production Characterization of Cellu lose Degrading Bacteria
WANG Bin,GUO Zhao-hui,DU Dong-xia
(Hunan Academy of m icrobiology, Changsha 410009, PRC)
Three cellulose degrading bacteria, which can be isolated from cellulose enriched environments, were isolated with carboxymethylcellulose sodium (CMC-Na) as sole carbon source, CMC-Congo red staining method was used to further screen, and one strain with larger transparent circle was obtained, named as B1. Through the identif cation of bacterial colony, cell morphology observation,physiology and biochem istry experiment, and molecular biology, initially identifed as Bacillus cereus, the strain show ed a high ability of disintegration of flter paper and higher cellulase activity. Through the optimization of culture conditions, it was found that the strain was in the culture medium with the initial pH value of 5.0, temperature 37℃ and after 36 hours, the cellulase activity could reach 64.22 U/m L.
cellulose; degradation; isolation; identif cation; Bacillus cereus
Q93-331
A
1006-060X(2016)09-0007-03
10.16498/j.cnki.hnnykx.2016.09.003
2016-07-14
湖南省自然科学基金项目(13JJ2035);湖南省“一化四体系”专项资金 (湘财农指[2014]153号)
汪 彬(1982-),女,湖南长沙市人,助理研究员,主要研究方向农牧废弃物资源化利用等方面的研究。
杜东霞

