葡萄籽原花青素对放射性脑损伤大鼠学习能力和ERK1/2活性的影响
肖 颖,刘永亮
(1. 唐山市工人医院放化疗科;2. 唐山市人民医院神经外科,河北唐山 063000)
◇中医药研究◇
葡萄籽原花青素对放射性脑损伤大鼠学习能力和ERK1/2活性的影响
肖颖1,刘永亮2
(1. 唐山市工人医院放化疗科;2. 唐山市人民医院神经外科,河北唐山063000)
目的观察葡萄籽原花青素(GSPE)对放射性脑损伤大鼠学习能力和细胞外信号调节激酶1/2(ERK1/2)活性的影响。方法120只雄性Wistar大鼠随机分为对照组,模型组,U0126组,低、高剂量GSPE组。用直线加速器进行脑部照射22Gy制作放射性脑损伤模型。HE染色观察海马区神经细胞形态变化;免疫组织化学法及免疫印迹法检测磷酸化的ERK1/2表达;穿梭箱评测大鼠学习能力。结果与模型组比较,U0126组海马区神经细胞结构损伤加重,磷酸化ERK1/2表达水平降低(P<0.01),穿梭箱评测显示GSPE组动物主动回避反应率降低,被动回避潜伏期延长(P<0.01);GSPE组海马区神经细胞结构损伤减轻,磷酸化ERK1/2表达水平增高(P<0.01),穿梭箱评测显示GSPE组动物主动回避反应率明显升高,被动回避潜伏期缩短(P<0.01);上述变化在高剂量GSPE组最为显著(P<0.01)。结论GSPE可以改善放射性脑损伤大鼠学习能力障碍,增强ERK1/2活性。
放射性脑损伤;学习能力;细胞外信号调节激酶1/2;葡萄糖原花青素
放射性脑损伤(radiationinjuriesbrain,RIB)是颅面颈区肿瘤放射治疗后的常见并发症,临床报道接受全脑照射的存活患者出现认知功能障碍的概率高达50%~90%,且认知障碍的程度往往与照射的剂量有关[1]。如何防治电离辐射造成的认知功能障碍已成为放射医学研究的热点。细胞外信号调节激酶1/2(extracellularsignalregulatedkinase,ERK1/2)是有丝分裂原活化蛋白激酶(mitogen-activatedproteinkinases,MAPKs)家族的重要组成部分,活化后经多级激酶的级联反应把细胞外刺激信号向细胞内传递,从而介导细胞产生各种生物学反应;现已证实ERK1/2活性变化与脑损伤后认知障碍及痴呆的形成密切相关[2-3]。葡萄籽原花青素(grapeseedproanthocyanidinextract,GSPE)是从葡萄籽中提取出的生物类黄酮物质,具有极强的抗氧化和清除自由基作用[2]。动物实验报道,GSPE不仅可抑制肿瘤细胞的生长、迁移[4],而且可减轻辐照引起的脏器损伤[5]。目前有关GSPE对RIB的研究尚少。本研究建立RIB模型,观察磷酸化的ERK1/2(活化的ERK1/2)表达变化,初步探讨GSPE防治RIB认知障碍的作用机制。
1 材料与方法
1.1动物分组和模型制备120只清洁级、健康雄性SD大鼠,体质量(245±15)g,月龄(2.8±0.3)月;采用随机数字法分组原则,分成对照组(n=24)、模型组(n=24)、U0126组(n=24)、高剂量GSPE干预组(n=24)、低剂量GSPE干预组(n=24)。各组分别分为照射后7、14、28d三个亚组,各时间组8只动物。
对照组:动物只进行常规麻醉,不进行照射;模型组:动物常规麻醉,参考文献[6]制作RIB模型,方法:采用德国进口加速器产生的6MeV电子线对大鼠进行单次全脑照射,源皮距为100cm,吸收剂量率250Mu/min,吸收剂量为22Gy;干预组:在动物进行照射前2周开始每天灌胃给药1次,持续给药观察时点,剂量分别为:高GSPE组200mg/kg、低GSPE组100mg/kg。
1.2学习能力的评测采用ZH-CSC型穿梭实验视频分析系统(ShuttleBoxSystem)测定动物行为学能力。将各组大鼠按时间点分别放入穿梭箱,适应5min消除探究反射后给予铃声刺激5s,继之给予电击20s,间隔10s后进入下一轮训练。训练中,如果在铃声刺激5s内大鼠逃向安全区,则为主动回避反应,系统自动停止当次训练;如果在铃声刺激5s内大鼠未逃向安全区,则给予1.5mA交流电20s,如果在电击后逃向安全区,则为被动回避反应阳性,否则为主动、被动回避反应阴性。每只大鼠电击30次,记录被动回避潜伏期(passiveavoidancelatency,PAL)、主动回避反应次数等参数。主动回避反应次数占总训练次数的百分比即为主动回避反应率(activeavoidancereactionrate,AARR);AARR越高,PAL越短,表明动物学习能力越强。
1.3脑组织海马区的形态结构观察各组各时间点取4只大鼠,40g/L多聚甲醛灌注固定后,取脑,截取视交叉平面至大脑横裂脑组织。石蜡包埋、冠状切片,片厚5μm,HE染色,光学显微镜下观察。
1.4免疫组织化学法和免疫印迹法检测磷酸化ERK1/2表达免疫组织化学法:取材动物及标本采集与HE染色方法相同,切片常规脱蜡至去离子水,滴加复合消化液后入37 ℃温箱孵育20min,经PBS洗涤3次,每次5min,入30g/L过氧化氢封闭内源性过氧化物酶15min,经PBS洗涤后滴加兔抗鼠磷酸化ERK1/2多克隆抗体(1∶200),4 ℃过夜;37 ℃复温45min,PBS洗涤后滴加生物素化二抗,37 ℃ 40min,PBS洗涤;DAB显色,苏木精轻度复染,脱水、透明、封片。在有测微尺的光学显微镜(20×10)下计数该视野下的阳性细胞数(细胞核中有阳性表达产物,染色呈棕黄色)。具体方法:每个标本取4张切片,在海马区随机选取4个视野,在有测微尺的光学显微镜(20×10)下观察海马区阳性细胞变化并计数(20×10)倍视野下的阳性细胞数量。
免疫印迹法:40μg蛋白样品与等体积上样缓冲液混合,煮沸10min后进行100g/L十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜;加封闭液,室温下震荡2~3h后,加入磷酸化ERK1/2单克隆抗体(北京中山生物公司,1∶2 000),4 ℃孵育过夜,用TBST洗膜,标记的二抗,经37 ℃孵育1h后,再次TBST洗膜;ECL显色,用图像分析仪测定吸光度,作定量分析。
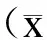
2 结 果
2.1各组穿梭实验结果与对照组相比,模型组动物的AARR减少、PAL延长(P=0.000),且至照射后28d时,AARR和PAL恢复迹象不明显;与模型组相比,U0126组AARR减少、PAL延长(P=0.000),而GSPE组动物的AARR增多、PAL缩短(P=0.000),且28d时AARR和PAL恢复迹象明显(表1、表2),上述变化在高剂量GSPE组最为显著。
表1各组大鼠AARR的比较


组别7d14d28d对照组76.84±4.7877.36±5.3477.68±5.53模型组45.63±0.90*32.71±0.65*34.50±0.78*U0126组34.82±1.20△24.55±1.86△28.48±1.60△低剂量GSPE组56.23±2.56*△44.66±2.79*△50.40±2.16*△高剂量GSPE组64.71±5.65*△▲50.51±5.86*△▲69.98±6.26*△▲
与对照组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量GSPE组比较,▲P<0.05。
表2各组大鼠PAL的比较
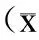

组别7d14d28d对照组17.68±1.7917.56±2.5517.53±3.64模型组40.11±1.57*51.13±1.89*49.08±1.78*U0126组48.44±1.96△61.20±2.08△55.70±1.92△低剂量GSPE组34.11±1.57*△45.52±1.88*△39.52±1.79*△高剂量GSPE组28.33±0.87*△▲36.53±2.70*△▲27.51±1.57*△▲
与对照组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量GSPE组比较,▲P<0.05。
2.2各组神经细胞形态结构的改变对照组神经细胞形态结构正常,神经元胞体较大,胞核大而圆,核仁清晰。模型组可见神经细胞变性水肿,细胞轮廓模糊;亦可见部分死亡神经细胞,表现胞体收缩呈多角形或不规则。U0126组神经细胞变性水肿,细胞轮廓模糊;可见较多死亡神经细胞,形态结构损伤更为严重。GSPE组神经细胞形态结构减轻,在高剂量组变化尤为明显(图1)。
2.3各组磷酸化ERK1/2免疫组化和免疫印迹结果免疫组化:磷酸化ERK1/2阳性表达主要位于细胞核,阳性细胞的胞核可见细小的棕黄色颗粒(图2)。对照组有少量磷酸化ERK1/2阳性细胞,染色棕黄;与对照组比较,模型组7、14d时间点磷酸化ERK1/2阳性细胞均增多,28d有所降低,但仍高于对照组(P=0.000);与模型组比较,U0126组中各时间点磷酸化ERK1/2阳性细胞减少,而GSPE组中各时间点磷酸化ERK1/2阳性细胞增多,高表达状态持续至28d,在高剂量组变化尤为明显(P=0.000,表3)。
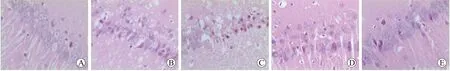
图1各组大鼠海马区神经元形态结构的变化
Fig.1Variationofthehippocampusneuronalmorphologyandstructureindifferentgroupsofratsunderlightmicroscope(×400)
A:对照组;B:模型组14d;C:U0126组;D:低剂量GSPE组14d;E:高剂量GSPE组14d。
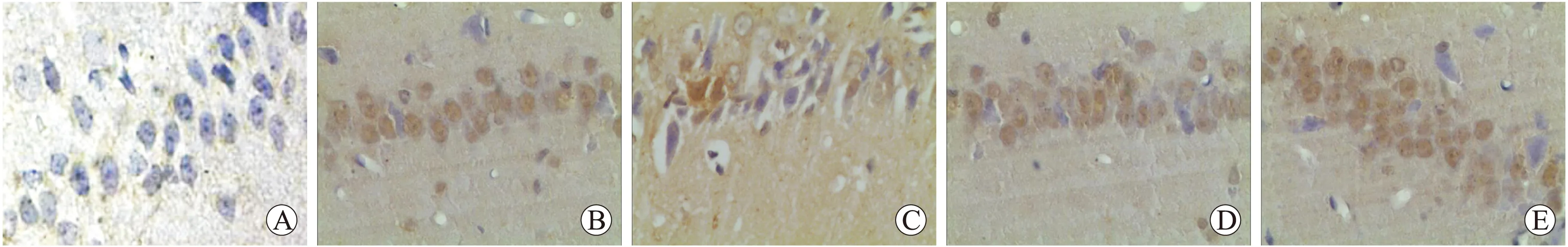
图2各组大鼠海马区磷酸化ERK1/2免疫组化染色结果
Fig.2ImmunohistochemicalstainingresultsofthehippocampusphosphorylatedERK1/2indifferentgroupsofrats
A:对照组;B:模型组14d;C:U0126组;D:低剂量GSPE组;E:高剂量GSPE组。
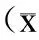

组别7d14d28d对照组2.25±0.702.32±0.682.40±0.75模型组11.12±1.18*20.20±2.50*12.86±1.26*U0126组8.34±0.67△13.74±1.15△9.22±0.96△低剂量GSPE组13.20±1.45△27.40±2.52△19.80±1.30△高剂量GSPE组16.10±1.18△▲34.16±2.94△▲24.36±2.26△▲
与对照组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量GSPE组比较,▲P<0.05。
免疫印迹:以β-actin校准后的蛋白条带IA值反映其蛋白水平(图3)。与对照组比较,模型组7、14d时间点磷酸化ERK1/2表达水平增高,28d有所降低,但仍高于对照组(P=0.000);与模型组比较,U0126组各时间点磷酸化ERK1/2表达水平降低,而GSPE组中各时间点磷酸化ERK1/2表达水平进一步增高,高表达状态持续至28d,在高剂量组变化尤为明显(P=0.000,表4)。
图3各组大鼠海马区磷酸化ERK1/2蛋白免疫印迹结果
Fig.3WesternblotofthehippocampusphosphorylatedERK1/2indifferentgroupsofrats
A:对照组;B:模型组 14d;C:U0126 组;D:低剂量GSPE组;E:高剂量GSPE组。
表4各组大鼠海马区磷酸化ERK1/2蛋白表达水平的比较
Tab.4ComparisonoftheexpressionofphosphorylatedERK1/2proteininthehippocampusindifferentgroupsofrats
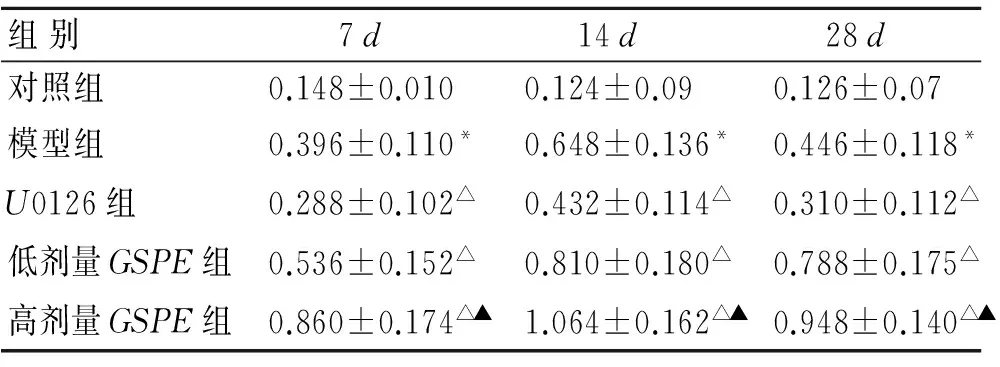
组别7d14d28d对照组0.148±0.0100.124±0.090.126±0.07模型组0.396±0.110*0.648±0.136*0.446±0.118*U0126组0.288±0.102△0.432±0.114△0.310±0.112△低剂量GSPE组0.536±0.152△0.810±0.180△0.788±0.175△高剂量GSPE组0.860±0.174△▲1.064±0.162△▲0.948±0.140△▲
与对照组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量GSPE组比较,▲P<0.05。
3 讨 论
本研究的结果显示,GSPE组动物不仅学习损伤程度轻,同时学习能力在早期即有恢复的趋势,表现在高剂量GSPE组动物在28d时主动回避反应率和被动回避潜伏期变化相对稳定,未出现模型组中持续下降的趋势,说明GSPE对RIB学习障碍有较好的防治作用。电离辐射可以造成脑内氧化应激、炎症反应、神经元损伤、神经递质释放紊乱等,进而造成认知能力损伤[7-8]。GSPE具有较强抗氧化作用,其抗氧化能力是VitE的50倍、VitC的20倍,与SOD相当;此外,GSPE具有抑制炎症通路激活和炎症反应的作用[9-10]。因此,应用GSPE可以降低RIB造成的认知障碍。
ERK1/2信号是MAPKs家族中研究最为深入的成员。研究发现,ERK1/2激活可通过基因表达、蛋白合成等影响神经细胞增殖分化、突触可塑性、轴突生长等,从而参与多种神经系统疾病的发生发展[11]。长时程增强(LTP)是与学习记忆密切相关的神经生物学基础。CRISTOG等[12]在研究中发现,海马区非依赖型LTP增强,需ERK1/2的活化,ERK1/2基因敲除的小鼠海马区LTP消弱或不能形成,动物表现出学习能力下降。ZHONG等[13]报道,当条件性敲除ERK1/2通路基因,不能诱导神经轴突生长;亦有研究显示,ERK1/2激活可通过提高神经细胞突触传递效能、提高兴奋性递质受体,进而诱导与维持LTP的形成[14]。国内学者梁庆[15]也证实对脑缺血大鼠的神经保护作用与提高脑内ERK1/2活化水平有关。本研究发现U0126组较模型组动物的AARR减少、PAL延长,说明ERK1/2信号活性变化是RIB学习记忆障碍的关键。
鉴于ERK1/2信号与学习能力关系的密切性,我们观察了GSPE对RIB大鼠海马区ERK1/2活性变化的影响,结果显示GSPE组中磷酸化ERK1/2在GSPE组呈剂量依赖式显著增高,且高表达时间延长,说明GSPE可提高海马区ERK1/2活性,可能是GSPE对放射性学习记忆损伤起到很好的防治作用的原因之一。
总之,本实验结果表明,GSPE增强RIB大鼠脑内ERK1/2活性,减轻RIB大鼠学习能力障碍。本研究为GSPE抗肿瘤及抗辐射的应用提供了一定的理论依据。
[1]GREENE-SHLOESSRD,MOOREE,ROBBINSME.Molecularpathways:radiation-inducedcognitiveimpairment[J].ClinCancerRes, 2013, 19(9): 2294-2300.
[2] 唐敬龙,高维娟,钱涛,等. 补阳还五汤对血管性痴呆大鼠海马CA1区LTP及ERK2与CaMKIIβmRNA表达的影响[J]. 中风与神经疾病杂志, 2013,10(6):119-125.
[3]ZHAOYN,TANGQQ,LIJM.Regulationofextracellularsignal-regulatedkinase1/2influenceshippocampalneuronalsurvivalinarat[J].NeuralRegenerRes, 2014, 9(7):749-756.
[4] 马佳,方斌斌,曾凡鹏,等. 葡萄籽原花青素下调miR-27a表达抑制胰腺癌细胞生长[J]. 中南大学学报(医学版),2015,40(1):46-52.
[5] 李玉白,黄红焰. 花青素协同葡萄糖醛酸对辐射大鼠肝功能的影响[J].中国医科大学学报,2013,42(11):1025-1031.
[6] 范兴文,贯士阔,吴开良. 脑部照射对大鼠情绪和记忆的影响[J].中国癌症在症,2014,24(11):841-849.
[7] 张娴娴,肖璐,徐耀. 依达拉奉对放射性脑损伤模型大鼠认知功能障碍的影响[J]. 中华放射医学与预防杂志,2013,33(1):40-43.
[8]JENROWKA,BROWNSL,LAPANOWSKIK,etal.Selectiveinhibitionofmicroglia-mediatedneuro-inflammationmitigatesradiation-inducedcognitiveimpairment[J].RadiatRes, 2013, 179(5):549-556.
[9]ZHAOYN,GUOX,WANGHY,etal.Theneuroprotectiveeffectsofgrapeseedproanthocyanidinonratbraininjurycausedbychronicintermittenthypoxia[J].NeurolAsia, 2014, 19(4):399-403.
[10] 赵雅宁,曹书华,郭霞,等. 葡萄籽原花青素对慢性间歇性低氧大鼠脑组织炎症反应及学习记忆能力的影响[J]. 郑州大学学报(医学版),2014,49(1):29-32.
[11]ATHOY,ENDOS,IKEDAT,etal.Extracellularsignal-regulatedkinase2(ERK2)knockdownmiceshowdeficitsinlong-termmemory;ERK2hasaspecificfunctioninlearningandmemory[J].Neurosei, 2007, 27(40):10765-10776.
[12]CRISTOGDI,BERARDIN,CANEEDDAL,eta1.RequirementofERKactivationforvisualeorticalplasticity[J].Science, 2001, 292(5525):2337-2340.
[13]ZHONGJ,LIX,MCNAMEEC,etal.Rafkinasesignalingfunctionsinsensoryneurondifferentiationandaxongrowthin vivo[J].NatNeurosci, 2007, 10(5):598-607.
[14]ILLARREALJS,BAREA-RODRIGUEZEJ.ERKphosphorylationisrequiredforretentionoftracefearmemory[J].NeurobiolLearnMem, 2006, 85(1): 44-57.
[15] 梁庆,梁子敬,林俊敏,等. 脑啡肽乙酸酯对大鼠急性全脑缺血-再灌注后海马区神经元保护的机制研究[J]. 中国急救医学,2015, 35(6):539-543.
(编辑韩维栋)
EffectsofgrapeseedproanthocyanidinonlearningabilityandERK1/2activityinaratmodelofradiation-injuredbrain
XIAOYing1,LIUYong-liang2
(1.DepartmentofRadiotherapyandChemotherapy,TangshanWorkers’Hospital,Tangshan063000;2.DepartmentofNeurosurgery,TangshanPeople’sHospital,Tangshan063000,China)
ObjectiveToobservetheeffectsofgrapeseedproanthocyanidinextract(GSPE)onlearningabilityandextracellularsignalregulatedkinase(ERK1/2)activityafterradiation-inducedinjurytothebraininrats.MethodsTotally120maleWistarratsweredividedintocontrolgroup,modelgroup,U0126group,andhigh-andlow-doseGSPEgroups.Theradiation-injuredbrainmodelswereestablishedbyusinglinearacceleratorirradiationin22Gy.ThemorphologicalchangesoftheneuronsinthehippocampuswereobservedwithHEstaining.TheexpressionofphosphorylatedERK1/2wasdetectedbyimmunohistochemistryandWesternblotting.Thelearningabilitywasassessedwithshuttlebox.ResultsComparedwiththemodelgroup,U0126grouphadincreaseddegreeofnervecellmorphologicalinjuryanddecreasedphosphorylatedERK1/2expressionlevel(P<0.01).ShuttleboxtestingshowedthattheactiveavoidancereactionratewasdecreasedandpassiveavoidancelatencywasprolongedinGSPEgroups(P<0.01);theGSPEgroupshaddecreaseddegreeofnervecellmorphologicalinjuryandincreasedphosphorylatedERK1/2expressionlevel(P<0.01).ShuttleboxtestingshowedthattheactiveavoidancereactionratewasincreasedandpassiveavoidancelatencywasshortenedinGSPEgroups(P<0.01).Theabove-mentionedchangesweremoresignificantinhigh-doseGSPEgroup(P<0.01).ConclusionGSPEcanreducelearningdisabilityofradiation-injuredbrainandpromotetheERK1/2activity.
braininjuryfromradiation;learning;extracellularsignalregulatedkinase
2015-08-07
2015-11-07
河北省卫生厅资助项目(No.20130384)
肖颖.E-mail:szg123@163.com
R742
A
10.7652/jdyxb201605025
SupportedbytheHealthDepartmentofHebeiProvince(No.20130384)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160805.0946.002.html(2016-08-05)

