舌鳞状细胞癌组织中CD44和CD133的表达及临床意义
栾可峰,李新新,孙学辉,范 欣,巩佃霞,胡温庭
潍坊医学院(山东 潍坊 261000)
舌鳞状细胞癌组织中CD44和CD133的表达及临床意义
栾可峰,李新新,孙学辉,范欣,巩佃霞,胡温庭*
潍坊医学院(山东 潍坊 261000)
目的探讨舌鳞状细胞癌癌组织中肿瘤干细胞标志物CD44和CD133的表达与临床病理特征及预后的关系。方法应用免疫组化法研究67例舌鳞状细胞癌癌组织中CD44和CD133的表达状况。结果CD44和CD133在舌鳞状细胞癌患者中的阳性表达率分别为58.21%(39/67)和65.67%(44/67);CD44、CD133的表达与患者年龄、性别无关(P>0.05),但与组织分化程度、临床分期及淋巴结转移相关(P<0.05);单因素分析显示:CD44的阳性表达和CD133的阳性表达均与患者5年生存率存在相关性(P<0.05),Cox多因素分析显示:组织分化程度、CD44的阳性表达及CD133的阳性表达是患者生存的独立预后影响因素(P<0.05)。结论CD44、CD133在舌鳞状细胞癌中的表达与患者的恶性生物学行为有关,可作为预后评价的参考标准,对临床诊疗具有重要的指导意义。
舌鳞状细胞癌;CD44;CD133;临床病理特征;预后
在口腔颌面恶性肿瘤中,舌鳞状细胞癌是发病率最高的恶性肿瘤之一,发展速度快,恶性程度高,并常累及舌肌,严重影响患者的饮食及语言等基本生活功能,患者早期即可发生颈淋巴结转移,影响生存和预后[1]。研究发现,舌癌的发病率逐年增加,并有年轻化趋势[2],Popovtzer等[3]研究发现,45岁以下舌癌患者所占比例达30%,因此提高舌癌的早期诊断及治疗技术至关重要。肿瘤干细胞(cancer stem cells, CSCs)理论的提出给人类进一步认识肿瘤的发生、复发、转移及耐药带来新的希望,CD44和CD133是目前具有重要临床意义的肿瘤干细胞因子,但是在舌鳞状细胞癌中的研究相对较少[4-7],本研究采用免疫组化的方法研究舌鳞状细胞癌中CD44和CD133的表达情况,并进一步研究两者的表达与患者恶性生物学行为及预后的关系,现报道如下。
1 资料与方法
1.1一般资料收集2008年06月01日—2011年03月01日在潍坊医学院附属医院就诊的初治行手术治疗的67例舌鳞状细胞癌患者,术前所有患者均未接受任何抗肿瘤治疗,术后均经病理组织学确诊为舌鳞状细胞癌。患者的病理分期依美国癌症联合委员会(AJCC)胃癌TNM分期(2010年第七版):①组织分化程度:高分化19例,中分化22例,低分化26例;②临床分期:Ⅰ期19例,Ⅱ期18例,Ⅲ期14例,Ⅳ期16例;③有淋巴结转移的41例,无淋巴结转移的26例。每例手术标本在离体后5 min内,立即在癌灶中心非坏死部分取实验组织,将组织块置于福尔马林液中固定,石蜡包埋切片。
1.2主要试剂CD44与CD133单克隆抗体分别购自eBioscience和Milrenyi Biotec公司。
1.3免疫组织化学染色①把切片置于60℃(与蜡块熔点相等)的温箱中烤30 min;②二甲苯脱蜡,梯度酒精脱水:二甲苯Ⅰ(5~10 min)⟹二甲苯Ⅱ(5~10 min)⟹100%酒精Ⅰ(3~5 min)⟹100%酒精Ⅱ(3~5 min)⟹95%酒精Ⅰ(1~3 min)⟹95%酒精Ⅱ(1~3 min)⟹80%酒精(1~3 min)⟹70%酒精(1~3 min)⟹蒸馏水冲洗3次,3 min/次;③抗原修复:将抗原修复液(含EDTA)稀释50倍并置于大器皿中水浴(95~98℃持续15~20 min,pH 6.0),组织切片置于修复液中,让其自然冷却至室温,蒸馏水冲洗,后PBS冲洗3次,3 min/次;④阻断内源性过氧化物酶活性:3% H2O237℃避光孵育10~15 min,PBS冲洗3次,3 min/次;⑤加CD44(或CD133)一抗,每张切片滴50 μL,平放于湿盒中,4℃冰箱过夜,用PBS代替一抗作阴性对照;⑥37℃复温30 min,PBS冲洗3次,3 min/次;⑦加50 μL A液(标记有辣根过氧化物酶和抗兔/鼠免疫球蛋白的多聚分子)37℃孵育30 min;⑧孵育完毕, PBS缓冲液冲洗3次,3 min/次,加DAB工作液50 μL,避光显色,显微镜下控制显色时间,一般10~15 min;⑨DAB终止显色,自来水充分冲洗;⑩苏木素复染,中性树胶封片。
1.4免疫组织化学染色结果判定标准CD44和CD133主要表达于细胞膜,在细胞浆中少量表达,细胞膜被染成褐黄色、棕黄色和淡黄色的即可认为是阳性细胞,在组织片子上随机选取4个高倍视野,每个视野观察500个细胞,计算阳性细胞率,<10%为阴性,≥10%为阳性[8]。
1.5统计学分析应用SPSS 17.0统计学软件,率的比较采用χ2检验,相关性分析采用Spearman检验,应用Kaplan-Meier法和Log-rank检验进行单因素分析,Cox回归模型进行多因素分析,以P<0.05为差异有统计学意义。
2 结果
2.1CD44与CD133在舌鳞癌组织中的表达CD44与CD133主要表达于胞膜上,在舌鳞癌组织中均可见阳性表达,阳性表达率分别为58.21%(39/67)和65.67(44/67)。
2.2CD44与CD133在舌鳞癌组织中的表达与临床病理因素的关系在舌鳞癌组织中,CD44、CD133的表达均与患者年龄、性别无关(P>0.05),与患者肿瘤组织分化程度、临床分期及淋巴结转移相关(P<0.05),组织分化程度越低、临床分期越晚、存在淋巴结转移,CD44和CD133的阳性表达率越高,见表1,表2。
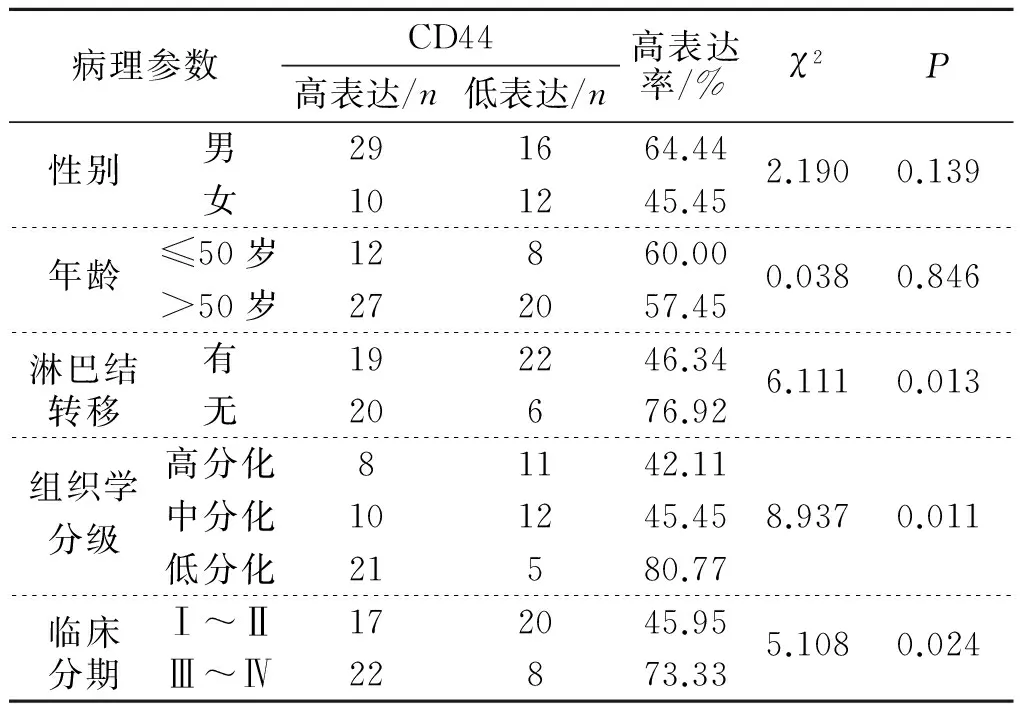
表1 舌鳞癌组织中CD44的表达与临床病理因素的关系
2.3CD44与CD133阳性表达的关系利用spear-man等级相关分析显示:认为CD44表达与CD133表达不具有相关性(r=0.025,P=0.843),见表3。
2.4CD44与CD133阳性表达与患者生存状况的关系单因素分析显示:CD44、CD133阳性舌鳞癌患者的5年生存率明显低于CD44、CD133阴性的舌鳞癌患者(P<0.05),见图1,图2。Cox多因素分析显示:年龄、性别、淋巴结转移及临床分期不是影响患者预后的独立因素,组织分化程度、CD44的阳性表达及CD133的阳性表达是患者生存的独立预后影响因素,见表4。

表2 舌鳞癌组织中CD133的表达与临床病理因素的关系

表3 舌鳞癌组织中CD44 、CD133表达的关系

表4 Cox回归模型分析结果

图1 CD44的表达与患者生存率的关系

图2 CD133的表达与患者生存率的关系
3 讨论
肿瘤的耐药、复发及转移是目前肿瘤诊疗中面临的巨大困难,是对患者生存时间和生活质量的严重威胁。近年来研究表明肿瘤组织中存在的具有自我更新、高增殖能力及多向分化潜能的极少量细胞(即肿瘤干细胞)与肿瘤的耐药、复发、转移存在密切关系[9], Vermeulen L等[10]发现肿瘤进展与转移是肿瘤干细胞与局部微环境相互作用的结果,随着研究的不断进展,逐渐发现几乎所有实体瘤中均存在肿瘤干细胞[11-12]。
CD44是一种细胞表面粘附分子,是一种由胞外区、跨膜区及胞浆尾部组成的跨膜分子,参与细胞间及细胞与细胞间质的粘附、粘连及转移。研究者最初在乳腺癌干细胞的研究中发现CD44分子,Prince等[13]证实在口腔鳞状细胞癌中,CD44阳性的细胞具有明显高于CD44阴性细胞的致瘤能力,将5 000个CD44阳性的口腔鳞状细胞癌细胞植入小鼠体内即可成瘤,而多倍数的CD44阴性细胞仍无法成瘤,证明了CD44阳性的细胞富集了肿瘤干细胞。CD133又称Prominin-1,其编码基因在4号染色体(4p15)上,是一个由865个氨基酸组成的相对分子量为 117 000D的具有5次跨膜结构的单链糖蛋白,CD133表达在膜突出部,有专家由此推断其可能是通过酪氨酸残基磷酸化作用而发挥级联效应的生长因子受体。目前CD133的表达与舌鳞状细胞癌干细胞的关系研究还处在初级阶段,王开等[14]在对人口腔鳞状细胞癌细胞株Tea-8113进行实验时发现,仅占很小一部分的CD133阳性细胞比CD133阴性的细胞具有更强的体外增殖和分化能力,Zhang等[15]在研究人口腔鳞状细胞癌细胞系及癌组织时也发现CD133阳性细胞比CD133阴性细胞具有更强的侵袭力和转移能力,这些研究有力地推动了CD133与舌癌研究的进展。
关于肿瘤干细胞标志物CD44、CD133与舌癌关系的研究在不断进展,本研究利用免疫组织化学的方法探索67例舌癌患者癌组织中CD44、CD133的表达情况,发现很大部分舌癌患者癌组织中存在CD44、CD133两种因子的表达,我们可以考虑是否两种因子可以作为舌癌患者早期诊断的“肿瘤标志物”;在两者表达与临床病理特征的关系的研究中发现,组织分化程度越低、临床分期越晚、存在淋巴结转移,CD44和CD133的阳性表达率越高,说明两种因子的表达与患者的恶性生物学行为存在密切关系,可作为舌癌患者恶性生物学行为的评价指标;并且CD44和CD133阳性表达的患者5年生存率均明显低于CD44和CD133阴性表达的患者,两者的表达与患者生存率存在关系,可以作为舌鳞状细胞癌患者预后的参考指标。但是,应用Spearman分析发现,CD44与CD133的表达不存在相关性,但是仍可以考虑将CD44和CD133作为舌鳞状细胞癌肿瘤干细胞的标志物,为探讨舌癌的发病机制及舌癌鳞状的诊疗的进展提供依据。
综上所述,舌癌干细胞标志物CD44、CD133的表达与舌癌的恶性生物学行为及预后密切相关,但目前研究仍处在初级阶段,需要我们继续验证CD44、CD133对于舌癌的影响,并继续发掘其更深层次的作用,为舌癌的诊疗开拓更多的思路,为治愈提供更广阔的前景。
[1]Price KA,Cohen EE.Current treatment options for metastatic head and neck cancer[J].Curr Treat Options Oncol,2012,13(1):35-46.
[2]Brennan S,Corry J,Kleid S,et al.Prospective trial to evaluatestaged neck dissection or elective neck radiotherapy in patients withCT-staged T1-2 N0 squamous cell carcinoma of the oral tongue[J].Head Neck,2010,32(2):191-198.
[3]Popovtzer A,Shpitzer T,Bahar G,et al.Squamous cell carcinoma of the oral tongue in young patients[J].Laryngoscope,2004,144(5):915-917.
[4]刘 磊,陶树东.头颈部癌中肿瘤干细胞的理论及临床意义[J].生物医学工程与临床,2015,19(5):543-547.
[5]Wang K,Zeng J,Luo L,et al.Identification of a cancer stem cell-like side population in the HeLa human cervical carcinoma cell line[J].Oncol Lett,2013,6(6):1 673-1 680.
[6]Moulay M,Liu W,Willenbrock S,et al.Evaluation of stem cell marker gene expression in canine prostate carcinoma-and prostate cyst-derived cell lines[J].Anticancer Res,2013,33(12):5 421-5 431.
[7]Martin TA,Jiang WG.Evaluation of the expression of stem cell markers in human breast cancer reveals a correlation with clinical progression and metastatic disease in ductal carcinoma[J].Oncol Rep,2014,31(1):262-272.
[8]Zhou F,Mu YD,Liang J,et al. Expression and prognostic value of tumor stem cell markers ALDH1 and CD133 in colorectal carcinoma[J].Oncol Lett,2014,7(2):507-512.
[9]Chen S,Hou JH,Feng XY,et al.Clinicopathologic significance of putative stem cell marker, CD44 and CD133, in human gastric carcinoma[J].Journal of Surgical Oncology,2013,107(8):799-806.
[10]Vermeulen L,De Sousa E Melo F,van der Heijden M,et al.Wnt activity defines colon cancer stem cells and is regulated by the microenvironment[J].Nat Cell Biol,2010,12(5):468-476.
[11]Prince ME,Sivanandan R,Kaczorowski A,et al.Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma [J].Proc Natl Acad Sci USA,2007,104(3):973-978.
[12]Hermann PC,Huber SL,Herrler T,et al.Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer [J].Cell Stem Cell,2007,1(3):313-323.
[13]Wei XD,Zhou L,Cheng L,et al.In vivo investigation of CD133 as a putative marker of cancer stem cells in hep-2 cell line[J].Head and Neck,2009,31(1):94-101.
[14]王开,康非吾,朱炎.实体瘤干细胞特异性表面标记物的研究进展[J].口腔颌面外科杂志,2009,19(1):53-56.
[15]Zhang Q,Shi S,Yen Y,et al. A subpopulation of CD133(+) cancer stem—like cells characterized in human oral squamous cell carcinoma confer resistance to chemotherapy[J].Cancer Lett,2010,289(2):151-160.
责任编辑:艾茜
Expressions and Clinical Significance of CD44 and CD133 in Tongue Squamous Cell Carcinoma
Luan Kefeng,Li Xinxin,Sun Xuehui,Fan Xin,Gong Dianxia,Hu Wenting*
(TheWeifangMedicalUniversity,Weifang261053,China)
Objective To explore the relationship between the expressions and clinical significance of cancer stem cell markers CD44 and CD133 in tongue squamous cell carcinoma (TSCC).Methods The expressions of CD44 and CD133 in 67 patients with TSCC were studied by the way of immunohistochemistry.Results The positive expression rates of CD44 and CD133 in TSCC were 58.21%(39/67)和65.67%(44/67). The expressions of CD133 were not related to the age and gender of the patients (P>0.05),but related to the degree of differentiation, clinical stages and lymph node metastasis (P<0.05).The univariate analysis showed that the positive expressions of CD44 and CD133 were correlated with the survival rate of the patients for 5 years (P<0.05).The cox multivariate analysis showed that the degree of tissue differentiation,the positive expressions of CD44 and CD133 were independent prognostic factors for survival (P<0.05).Conclusion The expressions of CD44 and CD133 were closely related with the malignant biological behaviors of patients and could be regarded as the standards for prognosis evaluation.They have great guiding significance for clinical application.
TSCC;CD44;CD133;clinical pathological features;prognosis
栾可峰(1987- ),男,山东青岛人,在读硕士,研究方向:口腔颌面外科;*
胡温庭,男,主任医师,硕士生导师,主要从事口腔颌面外科方面的研究。
R739.8
A
1008-8164(2016)03-0017-04
2016-06-19

