脂联素对肿瘤坏死因子α诱导的人脐静脉内皮细胞损伤的保护作用
柴 芳,王 俊,李纪男,李 强,李世正
(锦州医科大学附属第一医院普外科,辽宁锦州121001)
脂联素对肿瘤坏死因子α诱导的人脐静脉内皮细胞损伤的保护作用
柴芳,王俊,李纪男,李强,李世正
(锦州医科大学附属第一医院普外科,辽宁锦州121001)
目的研究脂联素球状结合域(gAd)对肿瘤坏死因子α(TNF-α)诱导的血管内皮细胞损伤的保护作用。方法将人脐静脉内皮细胞(HUVEC)分为4组:阳性对照组(C组),以TNF-α(20 ng/mL)作用24 h;gAd+TNF-α组(P组),以gAd(2 μg/mL)预先作用细胞12 h后,加入TNF-α(20 ng/mL)作用24 h;gAd组(G组),以gAd(2 μg/mL)作用细胞12 h;空白对照组(N组),在同等条件下不加任何试剂。荧光实时定量PCR、Western blot检测脂联素受体1(AdipoR1)及P-选择素mRNA及蛋白表达情况。AdipoR1 siRNA转染HUVEC后,采用Western blot检测P-选择素的表达。结果AdipoR1mRNA和蛋白表达量,N组与C组比较无统计学差异(P>0.05);G组、P组与N组或C组比较,P组与G组比较,表达量明显增加(P<0.05)。P-选择素mRNA和蛋白相对表达量,N组与G组比较无统计学差异(P>0.05);C组、P组与N组或G组比较,表达量明显增加(P<0.05);P组与C组相比,表达量明显减少(P<0.05)。AdipoR1 siRNA转染HUVEC后,C组、P组与N组、G组比较,P-选择素表达量明显增加(P<0.05);N组与G组比较,C组与P组比较,表达量无统计学差异(P>0.05)。结论gAd可以通过AdipoR1减少TNF-α诱导的P-选择素表达。
脂联素;肿瘤坏死因子α;P-选择素
动脉粥样硬化是心脑血管疾病的重要病理改变,发病机制至今不清,其中慢性炎症损伤理论得到广泛认可[1]。脂联素是脂肪细胞分泌的细胞因子,具有多种生物学功能,包括抗炎、血管保护等作用。脂联素由3个部分组成:N端序列、补体C1q样结构序列及C端的脂联素球状结合域(adiponectinglobular domain,gAd),其中gAd具有更多的生物学功能[2]。本研究拟通过肿瘤坏死因子α(tumor necrosis factor α,TNF-α)诱导血管内皮细胞损伤,探讨gAd对血管内皮细胞的保护作用及机制。
1 材料与方法
1.1材料
人脐静脉血管内皮细胞株(human umbilical vein endothelial cell,HUVEC)由本实验室保存;DMEM培养基,胎牛血清(美国Hyclone公司);PrimeScript®RT reagent Kit,SYBR®Premix Ex TaqTM(大连TaKaRa宝生物工程有限公司);兔抗人P-选择素抗体,辣根过氧化物酶标记羊抗兔IgG二抗(武汉博士德生物有限公司);兔抗人AdipoR1、β-actin抗体,AdipoR1 siRNA复合物(sc-60124),scramble siRNA(sc-44230),转染培养基(sc-36868),siRNA转染试剂(sc-29528)(美国Santa Cruz公司);ECL化学发光试剂(北京碧云天公司);TNF-α,重组gAd(北京爱迪博生物科技有限公司)。
1.2方法
1.2.1细胞培养及分组:HUVEC以含10%胎牛血清的DMEM培养基于37℃、5%CO2条件下培养。实验分为4组。阳性对照组(C组),加入与P组gAd同体积的PBS培养12 h后,以20 ng/m L TNF-α作用HUVEC 24 h;gAd+TNF-α组(P组),以2 μg/mL gAd预处理细胞12 h后,给予20 ng/mL TNF-α作用24 h;gAd组(G组),2 μg/mL gAd作用细胞12 h后,加入与P组TNF-α同体积的PBS再培养24 h;空白对照组(N组),同等培养条件下给予PBS作为对照。
1.2.2荧光实时定量PCR检测AdipoR1及P-选择素的表达:PCR引物由上海生工生物工程有限公司合成,序列如下。AdipoR1,上游5′-AGAAGGGCAAAC GGGTAA-3′,下游5′-AGCCAGTCAGGGAGCACA-3′;P-选择素,上游5′-CACCAATGTGTGAAGCCATC-3′,下游5′-ACATTGCACCC CTGGAGTAG-3′;β-actin,上游5′-CTGGAACGGTGAAGGTGACA-3′,下游5′-AAGGGACTTCCTGTAACAATG-3′。提取各组细胞RNA并反转录合成cDNA。PCR反应条件,95℃预变性3 min,95℃30 s,60℃退火,72℃延伸30 s,40个循环,荧光定量PCR仪计算结果并分析。
1.2.3Western blot检测AdipoR1及P-选择素的表达:收集各组细胞,并以RIPA裂解液提取总蛋白,BCA法测各组蛋白浓度。每组取25 μg总蛋白进行SDS-PAGE电泳,220 mA转膜3 h,5%脱脂奶粉封闭。兔抗人AdipoR1、P-选择素、β-actin抗体(1∶500)分别4℃孵育过夜,TBST洗膜10 min×3次,二抗(1∶2 000)室温孵育2 h,再次TBST洗膜3次,ECL显色。
1.2.4AdipoR1 siRNA转染细胞:HUVEC以2×105/孔接种于6孔板培养,待第2天融合度达70%~80%时进行转染。制备下述溶液,溶液A将6μL siRNA混合物溶于100μL转染培养基;溶液B将6μL转染试剂加入100μL转染培养基。溶液A、B混合后室温静置30 min。各组待转染细胞以转染培养基清洗1次,分别加入转染混合物。以scramble siRNA转染细胞作为阴性对照siRNA。48 h后收集细胞,Western blot检测P-选择素表达。
1.3统计学分析
每个实验步骤重复3次,实验结果用x±s表示。采用单因素方差分析,组间比较应用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1实时PCR检测AdipoR1和P-选择素mRNA相对表达量
AdipoR1mRNA相对表达量:N组与C组表达无统计学差异(P>0.05);G组、P组与N组或C组比较,P组与G组比较,表达量明显增加(均P<0.05)。P-选择素mRNA相对表达量:N组与G组表达无统计学差异(P>0.05);C组、P组与N组或G组比较,表达量明显增加(P<0.05);P组与C组相比,表达量明显减少(P<0.05)。见表1。
2.2Western blot检测AdipoR1和P-选择素蛋白相对表达量
AdipoR1蛋白相对表达量:N组与C组表达无统计学差异(P>0.05);G组、P组与N组或C组比较,P组与G组相比,表达量明显增加(P<0.05)。P-选择素蛋白相对表达量:N组与G组比较,表达量无统计学差异(P>0.05);C组、P组与N组或G组比较,表达量明显增加(P<0.05);P组与C组相比,表达量明显减少(P<0.05)。见表1、图1。
2.3AdipoR1 siRNA干扰后P-选择素相对表达量
2.3.1AdipoR1 siRNA转染效果检测:以β-actin作为内参,Western blot检测经AdipoR1 siRNA转染的细胞中AdipoR1的表达量为0.26±0.05,而转染了阴性对照siRNA的细胞中AdipoR1的表达量为1.06± 0.04(P<0.01),见图2。
2.3.2AdipoR1 siRNA转染后P-选择素相对表达量:C组、P组、N组、G组P-选择素的相对表达量分别为2.18±0.13、2.13±0.09、1.00±0.00、1.14±0.04,C组、P组与N组、G组比较,表达量明显增加(P<0.05);N组与G组比较,C组与P组比较,表达量无统计学差异(P>0.05)。见图3。
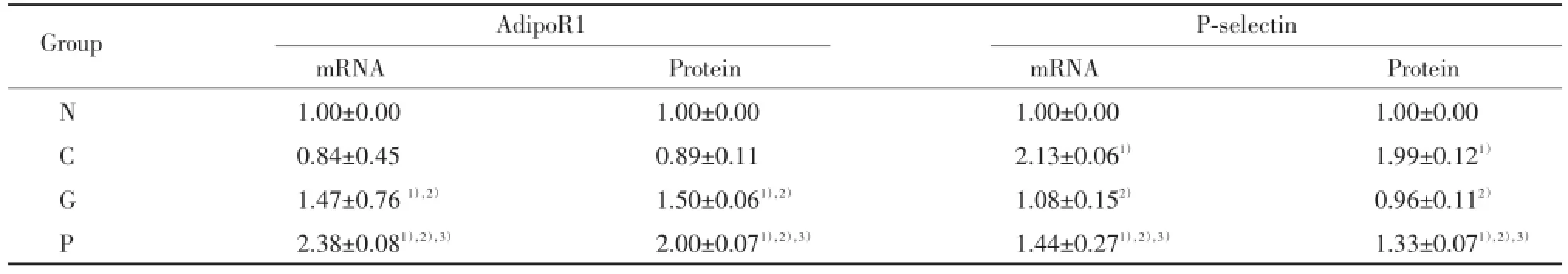
表1 AdipoR1和P-选择素m RNA和蛋白表达水平的比较Tab.1 Com parison of m RNA and p rotein levels of AdipoR1 and P-se lectin

图1 Western b lot检测AdipoR1和P-选择素的表达Fig.1 Expressions o f AdipoR1 and P-selectin detected by Western blot

图2 AdipoR1 siRNA的转染效果检测Fig.2 Detection of AdipoR1 siRNA transfection effects

图3 Weste rn blot检测siRNA转染后P-选择素的表达Fig.3 Expression of P-selectin detected by Western blot post siRNA transfection
3 讨论
动脉粥样硬化症是严重威胁人类健康的疾病,与肥胖、代谢综合征等疾病密切相关[3]。其发病机制至今不清,有多种因素参与,其中脂肪功能不全起重要作用,如TNF-α、白介素6、脂联素等分泌异常,上述因子可参与炎性反应等多种生物学功能[4-5]。脂联素是脂肪细胞分泌最多的一种激素,参与多种生物学功能,包括调节能量代谢、心血管保护、抗炎、抗肿瘤等作用[6-8]。脂联素与心脑血管硬化性疾病关系密切,其血浆水平与代谢综合征、动脉硬化负相关[9-10]。研究[11-12]表明脂联素可以激活血管内皮信号通路,促进一氧化氮产生,抑制平滑肌细胞增殖,保护血管内皮细胞。
P-选择素是细胞黏附分子家族成员之一,广泛表达于血小板及血管内皮等细胞,其配体P-选择素1配体广泛表达于白细胞[13]。在正常血管内皮细胞P-选择素表达水平较低,当受到炎性因子、缺氧等刺激后,在细胞膜表面迅速表达增加,并凝集白细胞、血小板等成分,诱导炎性反应,造成血管内皮细胞损伤[14]。研究[15]表明,P-选择素在动脉粥样硬化病理改变中表达明显升高。本研究显示,经TNF-α作用后P-选择素表达明显升高,考虑TNF-α可能通过改变黏附分子表达参与血管内皮细胞损伤,与既往研究[16]一致。N组、G组P-选择素表达无明显差异,提示生理情况下gAd作用对P-选择素表达无明显影响;但P组与G组比较则提示,在TNF-α上调P-选择素表达时,gAd可以部分逆转该过程,可能通过该通路对血管损伤具有保护作用。
AdipoR1可以在血管内皮细胞表达,与脂联素结合后可以减轻炎性细胞在血管表面的聚集[17]。与N组相比,G组AdipoR1表达增加,提示gAd具有上调其受体作用;与P组相比,G组AdipoR1表达明显增加,提示gAd可能通过其受体减轻TNF-α诱导的血管内皮细胞损伤。
转染效率检测显示,经AdipoR1 siRNA干扰后AdipoR1表达明显降低,说明阻断有效。经AdipoR1 siRNA转染后,P组与G组P-选择素表达无明显差异,提示gAd通过其受体减轻TNF-α诱导的P-选择素表达上调。该结果提示脂联素可能通过减少白细胞、血小板黏附等作用,防止动脉粥样硬化早期病理变化的发生。
脂联素可以通过cAMP/PKA通路减轻TNF-α诱导的内皮细胞损伤[18],LEE等[19]认为cAMP/PKA通路可以减少P-选择素表达,由此我们推测脂联素可能通过cAMP/PKA通路减少P-选择素表达。
本研究提示脂联素可以通过其受体1降低TNF-α诱导的P-选择素表达,进而保护血管功能,为动脉粥样硬化提供新的治疗靶点;其次脂联素及TNF-α在代谢性疾病相关血管病变中相互关联,有可能作为临床观测病变程度及提示预后的指标。本研究不足之处在于应进一步探讨gAd对P-选择素作用的信号通路,其次本研究基于细胞实验,有待动物实验进一步验证其机制,为血管保护提供更多新的治疗靶点。总之,本研究提示gAd可以通过脂联素受体1减少TNF-α诱导的P-选择素表达,这可能是脂联素防止血管内皮细胞损伤的机制之一。
[1]HONG J,MARON DJ,SHIRAI T,et al.Accelerated atherosclerosis in patients with chronic inflammatory rheumatologic conditions[J]. Int J Clin Rheum tol,2015,10(5):365-381.DOI:10.2217/ijr.15.33.
[2]ADYA R,TAN BK,RANDEVA HS.Differential effects of leptin and adiponectin in endothelial angiogenesis[J].J Diabetes Res,2015,10(5):1-12.DOI:10.1155/2015/648239.
[3]BRAUN LM,RODIGUEZ DA,EVENSON KR,et al.Walkability and cardiometabolic risk factors:cross-sectional and longitudinal associations from the Multi-Ethnic Study of Atherosclerosis[J]. Health Place,2016,39(4):9-17.DOI:10.1016/j.healthplace.2016. 02.006.
[4]FIGUEROA AL,TAKX RA,MACNABB MH,et al.Relationship between measures of adiposity,arterial inflammation,and subsequent cardiovascular events[J].Circ Cardiovasc Imaging,2016,9(4):1-3.DOI:10.1161/CIRCIMAGING.115.004043.
[5]CHOI KM.The impact of organokines on insulin resistance,inflammation,and atherosclerosis[J].Endocrinol Metab(Seoul),2016,31(1):1-6.DOI:10.3803/EnM.2016.31.1.1.
[6]GALIC S,OAKHILL JS,STEINBERG GR.Adipose tissue as an endocrine organ[J].Mol Cell Endocrinol,2010,316(2):129-139. DOI:10.1016/j.mce.2009.08.018.
[7]HUI X,FENG T,LIU Q,et al.The FGF21-adiponectin axis in controlling energy and vascular homeostasis[J].J Mol Cell Biol,2016,8(2):110-119.DOI:10.1093/jmcb/m jw013.
[8]WITBERG G,AYERS CR,TURER AT,et al.Relation of adiponectin to all-cause mortality,cardiovascular mortality,and major adverse cardiovascular events(from the Dallas Heart Study)[J].Am J Cardiol,2016,117(4):574-579.DOI:10.1016/j.amjcard.2015. 11.067.
[9]MAURY E,BRICHARD SM.Adipokine dysregulation,adipose tissue inflammation and metabolic syndrome[J].Mol Cell Endocrinol,2010,314(1):1-16.DOI:10.1016/j.mce.2009.07.031.
[10]SRIKANTHAN K,FEYH A,VISWEHWAR H,et al.Systematic review of metabolic syndrome biomarkers:a panel for early detection,management,and risk stratification in the west virginian population[J].Int J Med Sci,2016,13(1):25-38.DOI:10.7150/ijms.13800. eCollection 2016.
[11]ZHU W,CHENG KK,VANHOUTTE PM,et al.Vascular effects of adiponectin:molecular mechanisms and potential therapeutic intervention[J].Clin Sci(Lond),2008,114(5):361-374.DOI:10.1042/CS20070347.
[12]SPRAGUE AH,KHALIL RA.Inflammatory cytokines in vascular dysfunction and vascular disease[J].Biochem Pharmacol,2009,78(6):539-552.DOI:10.1016/j.bcp.2009.04.029.
[13]WANG H,KLEIMAN K,WANG J,et al.Deficiency of P-selectin glycoprotein ligand-1 is protective against the prothrombotic effects of interleukin-1beta[J].J Thromb Haemost,2015,13(12):2273-2276.DOI:10.1111/jth.13146.
[14]GREMMEL T,AY C,RIEDL J,et al.Platelet-specific markers are associated with monocyte-platelet aggregate formation and thrombin generation potential in advanced atherosclerosis[J].Thromb Haemost,2016,115(3):615-621.DOI:10.1160/TH15-07-0598.
[15]BIELINSKI SJ,BERARDI C,DECKER PA,et al.P-selectin and subclinical and clinical atherosclerosis:the Multi-Ethnic Study of Atherosclerosis(MESA)[J].Atherosclerosis,2015,240(1):3-9. DOI:10.1016/j.atherosclerosis.2015.02.036.
[16]SONG M,FANG M,YU L,et al.Myocardin-related transcription factor A cooperates with brahma-related gene 1 to activate P-selectin transcription[J].J Biomed Res,2016,30(1):60-66.DOI:10.7555/JBR.30.20150082.
[17]SOWERS JR.Endocrine functions of adipose tissue:focus on adiponectin[J].Clin Cornerstone,2008,9(1):32-38.
[18]KOBASHI C,URAKAZE M,KISHIDA M,et al.Adiponectin inhibits endothelial synthesis of interleukin-8[J].Circ Res,2005,97(12):1245-1252.DOI:10.1161/01.RES.0000194328.57164.36.
[19]LEE HS,KIM SD,LEE WM,et al.A noble function of BAY 11-7082:inhibition of platelet aggregation mediated by an elevated cAMP-induced VASP,and decreased ERK2/JNK1 phosphorylations[J].Eur J Pharmacol,2010,627(1/3):85-91.DOI:10.1016/ j.ejphar.2009.11.005.
(编辑陈姜)
Protective Effects of Adiponectin on the Tum or Necrosis Factor α-induced Damage in Human Umbilical Vein Endothelial Cells
CHAI Fang,WANG Jun,LI Jinan,LI Qiang,LI Shizheng
(Department of General Surgery,The First Hospital,Jinzhou Medical University,Jinzhou 121001,China)
Objective To investigate the protective effects of adiponectin globular domain(gAd)on the tumor necrosis factor α(TNF-α)-induced vascular endothelial cell damage.Methods Human umbilical vein endothelial cells(HUVEC)were divided into 4 groups.In positive control group(C group),HUVECs were treated with TNF-α(20 ng/mL)for 24 h.In gAd+TNF-α group(P group),cells were pre-incubated with gAd(2 μg/mL)for 12 h and then treated with TNF-α(20 ng/mL)for 24 h.In gAd group(G group),cells were treated with gAd(2 μg/mL)for 12 h.In blank control group(N group),no reagent was added in the same conditions.The mRNA and protein expressions of the adiponectin receptor 1(AdipoR1)and P-selectin were determined by real-time quantitative fluorescent PCR and Western blot.P-selectin levels were detected by Western blot after small interfering RNA(siRNA)targeting AdipoR1 gene transfected HUVECs.Results No significant difference was found in AdipoR1mRNA and protein levels between N and C groups(P>0.05).Compared to the N,C and G groups,P group showed a significantly increase expression(P<0.05).P-selectin mRNA and protein relative levels had no difference between N and G groups(P>0.05).Compared to N or G groups,gene expression in C and P groups were significantly increased(P<0.05).Compared to C group,P group was significantly lower(P<0.05).After AdipoR1 siRNA transfected HUVECs,compared to N and G groups,the expressions of P-selectin were significantly increased in C and P groups(P<0.05).There were no difference between N and G groups and C and P groups(P>0.05).Conclusion GAd reduces the TNF-α-induced P-selectin expression by AdipoR1.
adiponectin;tumor necrosis factor α;P-selectin
R365
A
0258-4646(2016)10-0909-04
10.12007/j.issn.0258-4646.2016.10.011
辽宁省自然科学基金(2013022044);锦州医科大学博士科研启动基金(Y2012B017);锦州医科大学附属第一医院科技启动基金(Fyk201211)
柴芳(1973-),男,副主任医师,博士.
李世正,E-mail:lyfsdyyy@163.com
2016-07-11
网络出版时间:
网络出版地址

