同步辐射微区X射线荧光光谱法原位分析蚯蚓中K,Ca,Cu,Zn和Pb
袁静 罗立强

摘要:为了研究重金属元素在蚯蚓体内的富集和存储机制,使用同步辐射微区X射线荧光光谱法(μSRXRF)研究了K,Ca,Cu,Zn和Pb元素在生长于南京栖霞山铅锌矿区附近菜园土壤的蚯蚓体内的分布特征,发现Pb主要富集在蚯蚓后部消化道周围的区域,Zn,Cu在蚯蚓后部的分布规律与Pb 类似,推测后部消化道周围区域的分布是蚯蚓为了阻断毒性重金属元素威胁而特有的富集和存储方式。5种元素的相关性表明,Pb和Zn相关性最高,存储方式最为相似,Pb与K和Ca在蚯蚓后部的分布呈显著正相关,说明毒性元素Pb在蚯蚓体内的富集和存储过程可能伴随着其它元素的吸收。本研究表明, μSRXRF在原位微区分析蚯蚓样品的元素空间分布方面具有很大优势,而进一步开展土壤及蚯蚓中Pb的形态研究,是研究重金属胁迫下蚯蚓解毒机制的重要前提。
关键词 :同步辐射微区X射线荧光光谱法; 蚯蚓; 原位分析; 铅; 存储机制
1 引 言
近年来,Pb等具有潜在毒性的重金属元素污染问题日益增多,对环境和人类存在极大的生态暴露风险[1]。特别是因矿山开发引起的环境问题,受到了广泛关注[2,3]。随着研究的深入,生物对重金属的耐性机制或解毒机理,引起研究者们广泛关注。杨红霞等[4]用LAICPMS对Cd超富集植物印度芥菜中的7种元素(Cd,P,S,K,Ca,Cu,Zn)进行原位微区分析,通过研究这些元素在样品中的分布特征,揭示超富集植物中Cd的迁移和富集规律。Shen[5]用μSRXRF研究含Pb营养液培养的超富集植物拟南芥中铅的分布規律,获取的元素二维分布图显示种皮中Pb浓度最高,根中Pb浓度比茎和叶片中高。在陆地生态毒理学中,除了土壤、植物等,蚯蚓也担任了重要角色。蚯蚓被称为“生态系统工程师”[6],一方面,它通过自身的代谢活动在土壤生态系统中发挥作用,如建立土壤团聚体,形成利于水分和空气流通的孔隙[7],对土壤酶活性、土壤有机质及植株的生长发育[8]等产生有益影响;另一方面,蚯蚓能够在多种类型被污染的土壤中定居,并且在一定程度上富集重金属,免受重金属的毒害[9]。蚯蚓对毒性元素的耐受性引起了研究者的关注。
重金属在生物体内的微区分布已成为解读生物对毒性元素耐性机制和解毒机理的关键信息,其重要性已得到普遍认可。研究者采用电子探针[10]、激光剥蚀电感耦合等离子体质谱[4]、高分辨扫描电镜和X射线能谱Mapping技术[11]、同步辐射微区X射线荧光(μSRXRF)[12~16]等方法对元素分布进行了大量研究。在众多的微区分析技术中,μSRXRF技术因其光源的高亮度、光束焦斑大小、高分辨率等特性,使探测具有更高的灵敏度和更低检出限,成为微量重金属元素微区分布分析的有力工具。例如,有研究者对在Pb(NO3)2溶液中萌芽的玉米种子进行SRXRF扫描,发现富集Pb的主要部位是种皮和胚结构[16]。Fukuda等[12]用μSRXRF技术分析其它方法很难探测到的Cd元素,发现Cd高度富集在叶片表面的香毛簇。Kopittke等[13]用配备快速探测器的μSRXRF对经过As和As浸泡24 h的新鲜豇豆根部组织进行探测,得到的As的分布图显示,As主要积累在根部的内皮和中柱鞘细胞中。Morgan等[14,15]用μSRXRF对蚯蚓组织鲜样进行微区扫描,获取元素Pb, Zn, Ca的分布规律。
目前,对各类植物样品进行元素微区分布的研究较多,而对土壤动物蚯蚓的研究较少。本研究以铅锌矿区的蚯蚓样品为研究对象,首先用同步辐射微束XRF对样品进行原位XRF分析,判定蚯蚓体内富集的重金属元素,再通过对样品进行扫描获取蚯蚓体内元素分布特征,为揭示Pb等重金属元素从土壤到蚯蚓的迁移规律以及在蚯蚓体内的富集机理提供有力信息。
2 实验部分
2.1 样品采集和处理
将蚯蚓从土壤中挖掘出来并连同土壤一同带回实验室。从土壤中取出蚯蚓,用水清洗多次,洗净后再用18 MΩ cm超纯水清洗3次,置于放有湿润滤纸的皮氏培养皿中净化48 h[17,18],保证蚯蚓肠道中泥土充分排出,以防干扰蚯蚓体内的金属元素分布。净化后,将蚯蚓浸入沸水中30 s[19],整条蚯蚓粘贴在无硫胶带上,用铝箔包裹,留出空间以免破坏蚯蚓,用针把铝箔刺出若干小孔,最后将样品放入冷冻干燥机中干燥3天。用无硫胶带固定在样品架上待测。
3 结果与分析
3.1 实验区概况
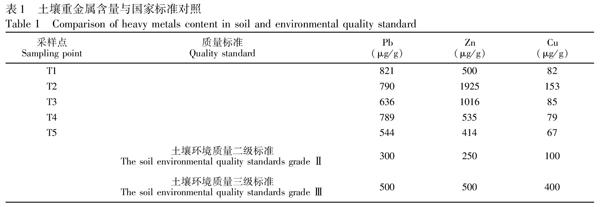
南京栖霞山铅锌矿区已有50多年的开采历史,重金属元素伴随矿山开采所排放的废气、废水和废渣释放到环境中,并不断积累,导致当地的生态环境严重恶化。已有研究发现,土壤和植物中Pb、Zn等重金属含量较高,随后又发现当地居民头发中铅的主要来源是外源性铅,并且人体中血铅和骨铅含量均较高[20]。说明该地区重金属污染已经由生态环境通过食物链进入到人体。表1为蚯蚓样品采集区的土壤EDXRF分析数据,每个样品平行测定3次取平均值,并与国家土壤环境质量标准进行对比。所选用的EDXRF分析方法为专门针对矿区土壤中Pb、Zn等几种重金属元素而建立的方法[21],测定较为准确。由表1可知,蚯蚓生存的土壤中Pb和Zn污染严重。
3.2 土壤和蚯蚓样品μSRXRF原位分析
样品中元素的荧光谱峰识别与准确测定是进行感兴趣元素分布特征研究的前提。首先对蚯蚓样品进行粗扫,在Pb, Zn等重金属元素特征峰较为显著的点进行单点采谱。用相同的方法也对土壤样品进行单点采谱,获得的蚯蚓和土壤的荧光谱图如图1所示。图1A所反映的情况基本与EDXRF测试结果吻合。图1B中,Pb, Zn等重金属元素均能观察到明显谱峰,说明此蚯蚓样品体内已经富集了一定量的Pb和Zn重金属元素。
3.3 谱线干扰识别与感兴趣区的选择
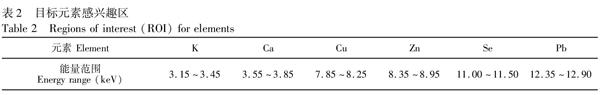
对原位μSRXRF分析获得的谱图进行元素特征峰和谱线干扰识别,进而圈定各元素的感兴趣区。感兴趣区能量范围是决定扫描结果准确性的关键。
本次实验中,特别对Pb的感兴趣区进行了选定。可观察到样品中发射出来的Pb的荧光谱线Pb L3M5(10.5515 keV)和Pb L2M4(12.614 keV),通常圈定Pb L3M5和Pb L2M4两个感兴趣区以保证有足够的荧光强度。但从图1可见,此样品中含有As元素,而As KL3(10.543 keV)和Pb L3M5 (10.5515 keV)存在严重干扰,因而为避免与As信号重叠,选择Pb L2M4(12.614 keV)作为Pb的分析线[21],圈定12.35~12.90 keV作为Pb的感兴趣区。值得注意的是,在Se KL3存在一个较明显的峰,说明样品中含有一定量的Se,而在感兴趣区(12.35~12.90 keV)内Pb L2M4与Se的Kβ(KM3,KN2,3,KM2)有重叠,尽管Pb L2M4的激发效率为0.7878,而Se的3条Kβ线的激发效率分别为0.0867,0.0046和0.0449,干扰较小; 同时, Se KL3明显低于Pb L3M5,据此可知,在Pb L2M4峰位观察到的谱线强度主要来自Pb本身。但为了更准确甄别Pb的分布规律,仍圈定(11.00~11.50 keV)作为Se元素的感兴趣区。各元素的感兴趣区能量范围参见表2。
3.4 Pb与其它元素在蚯蚓中的分布
曾有研究者将蚯蚓解剖为几个不同的部分,用ICPOES分别进行定量分析[22]。也有研究者对蚯蚓进行切片后。观察元素在切面的分布规律[14]。对整只蚯蚓进行原位微区扫描分析的较少,本研究尝试冷冻干燥后直接进行扫描,尽量减少人为操作可能带来的元素分布差异,并能在整体水平上更直观地观察蚯蚓体内元素的分布规律。
由于本研究旨在观察每个元素在样品中的分布规律,而非对元素进行定量分析,因而对于普遍计数较低的图谱可通过igor软件进行信号处理,以方便观察各元素的分布规律。如图2所示,右端是蚯蚓的头部,左端是蚯蚓尾部,红色代表元素含量高,紫色代表元素含量较低。以下分为3类讨论:宏量营养元素K和Ca、必需微量元素Zn和Cu、毒性元素Pb。
K和Ca元素是生物体营养元素,有维持细胞正常生理状态的功能。由图2可见,Ca的分布主要集中在蚯蚓的前半部分,后半部分含量较低;在蚯蚓头部和中间部位有两个小范围内K浓度高,其余部位的K浓度分布较均匀,这与K迁移能力强,具有维持细胞渗透压的功能相符。
Zn和Cu元素在蚯蚓的前半部分有明显分布,但却与K和Ca不同,可能是由于两者作为生物体内必需微量营养元素而发挥作用[14]。值得注意的是,Zn在蚯蚓后部消化道位置有非常明顯的分布高点,而Cu没有这一现象,结合该地区土壤中Zn污染严重,这一分布规律可能与过量Zn元素的存储或解毒机制有关。
Pb在蚯蚓前部分布较少,主要分布于后部消化道,佐证了一些通过蚯蚓前部和后部分离后分别进行测定得到的结果[22]。分布规律与Zn在后部的分布相似。考虑到Pb是该地区的主要污染元素,而Pb又非生命元素,再次印证这一分布规律与重金属元素在蚯蚓体内的解毒机制相关。观察Pb和Se的分布图,Se含量最高的部位在蚯蚓的头部,Pb的高含量区域位于蚯蚓的后部,并且在中部有一个高点(这一规律可通过每个元素的SRXRF数据得到印证)。
以往研究表明,生物体内细胞和组织中金属离子的平衡常通过对金属的键合或者隔离实现。自由的金属通过与蛋白质的氨基或者巯基键合,对细胞系统构成潜在威胁,从而影响结构和功能的完整性[23]。受体生物会对金属的入侵进行动态反应调节,对于必需金属元素Zn, Cu和Fe,通常通过复杂的通道吸收和排泄,同时采取一定的隔离或隐藏机制维持体内这些金属离子的生物活性水平。而对于非必需金属或类金属元素,在生物体内,可能和与其配位方式及其它物理化学性能相似的金属元素具有类似的迁移路径[24]。因此,推测Pb, Zn, Cu等重金属元素在蚯蚓后部消化道部位的分布属于一种隔离或隐藏机制,以阻断重金属迁移到其它器官,进而减少毒性威胁。有毒元素主要分布于蚯蚓后部消化道区域,可能是因为带有有毒元素的物质经过机体消化后,最先到达该区域的细胞[25]。
3.5 元素分布的相关性分析
对SRXRF分析获得的数据进行元素相关性分析,有助于对感兴趣元素之间的关系及蚯蚓体内解毒机制的理解。相关性研究主要针对毒性元素及过量的重金属元素,由图2可知,毒性重金属元素主要分布于蚯蚓的后部消化道表面区域。因此选取蚯蚓后部共1350个点进行分析。
相关性分析结果表明,Pb与K,Ca,Cu,Zn强度分布呈正相关(R2>0.5, 样品点数n=1350,图3)。Pb与K,Ca具有一定的相关性,说明重金属元素在蚯蚓后部的迁移和存储过程可能伴随着其它元素的吸收。而Pb与Cu,Pb与Zn呈显著正相关(R2PbCu=0.6733, R2PbZn=0.8582, 样品点数n=1350),说明作为非必需有毒元素Pb,在某种程度上可能与Zn和Cu这类与其配位方式相似的必需金属元素具有相似的迁移和存储方式。有研究显示,Pb, Zn等重金属元素富集存于蚯蚓后部消化道表面含有Ca和P的颗粒状物质“Granules”中,而Cd, Cu和As等元素存在于富含S的小颗粒中[25]。即这些重金属元素存在于同一类物质中,但可能以相同或不同的形态存在。这一观点与本研究的PbZn相关性最高(R2PbZn=0.8582样品点数n=1350)的结论符合,说明Pb和Zn元素的富集和存储机制最为相似。
4 结 论
用μSRXRF技术原位分析了铅锌矿区附近菜园土壤中蚯蚓样品的K,Ca,Pb, Cu,Zn等元素的分布特征,获取的元素分布图能够简单直观地反映各元素的分布规律,本方法分辨率高,可多元素同时测试,是研究生物组织中元素微区分布规律的有力工具,在生态毒理学研究领域具有巨大应用潜力。值得注意的是,μSRXRF扫描分析需要对每个元素的感兴趣区仔细选择才能获得准确可靠的结果。
蚯蚓能够在重金属污染的土壤中生存缘于其适当的解毒机制,有研究表明,重金属能够在蚯蚓某个部位固定下来而未产生毒性效应,说明这些部位可能具有储存重金属的容器作用[26]。本研究表明,Pb主要分布在蚯蚓后部消化道周围,Cu和Zn在蚯蚓后部的分布规律与Pb类似,可见,在蚯蚓后部消化道表面的组织是有毒元素及过量的重金属元素的主要富集部位,可能由于这一区域是受污染土壤經过蚯蚓消化道之后最先到达的地方,因此在此处的富集和存储可阻止重金属进一步运移到其它器官,进而阻断重金属的毒性威胁。而Cu和Zn元素在前部的分布可能与其作为生物体内必需微量元素参与生命活动有关。通过相关性分析表明,Pb和Zn的富集存储方式最相似,并且重金属元素在蚯蚓体内的迁移和存储过程伴随着对其它元素的吸收。进一步开展土壤及蚯蚓中Pb的形态研究,是研究重金属胁迫下蚯蚓解毒机制的重要前提。
References
1 GarcíaLestón J, RomaTorres J, Vilares M, Pinto R, Prista J, Teixeira J P, Mayan O, Conde J, Pingarilho M, Gaspar J F, Psaro E, Méndez J, Laffon B. Environ. Inter., 2012, 43: 29-36
2 Luo L, Chu B, Liu Y, Wang X, Xu T, Bo Y. Environ. Sci. Pollut. Res., 2014, 21(13): 8242-8260
3 HU QingJing, ZHANG ChaoLan, JIN ZhenJiang, CAO JianHua, LI Qiang. Rock and Mineral Analysis, 2014, 33(5): 714-722
胡清菁, 张超兰, 靳振江, 曹建华, 李 强. 岩矿测试, 2014, 33(5): 714-722
4 YANG HongXia, ZHAO LingHao, GAO JinXu, LIU Wei, LI Bing. Chinese J. Anal. Chem., 2014, 42(3): 355-359
杨红霞, 赵令浩, 高津旭, 刘 崴, 李 冰. 分析化学, 2014, 42(3): 355-359
5 Shen Y. XRay Spectrometry, 2014, 43(3): 146-151
6 Jones C G, Lawton J H, Shachak M. Ecosystem Management, New York: Spriger, 1996: 130-147
7 Turbé A, De Toni A, Benito P, Lavelle P, Lavelle P, Camacho N R, van der Putten W H, Labouze E, Mudgal S. Brussels: Soil Biodiversity: Functions, Threats and Tools for Policy Makers. European Commission (DG Environment), 2010
8 Brown G G, Barois I, Lavelle P. Euro. J. Soil Biol., 2000, 36(3): 177-198
9 Sample B E, Suter G W, Beauchamp J J, Efroymson R A. Environ. Toxicol. Chem., 1999, 18(9): 2110-2120
10 CotterHowells J, Charnock J M, Winters C, Kille P, Fry J C, Morgan A J. Environ. Sci. Technol., 2005, 39(19): 7731-7740
11 HU YongPing, YU XueFeng, ZHENG LinWei, ZHENG YiFan. Rock and Mineral Analysis, 2015, 34(6): 643-651
胡勇平, 于学峰, 郑林伟, 郑遗凡. 岩矿测试, 2015, 34(6): 643-651
12 Fukuda N, Hokura A, Kitajima N, Terada Y, Saito H, Abe T, Nakai I. J. Anal. Atomic Spectrom., 2008, 23(8): 1068-1075
13 Kopittke P M, de Jonge M D, Menzies N W, Wang P, Donner E, McKenna B A, Paterson D, Howard D L, Lombi E. Plant Physiol., 2012, 159(3): 1149-1158
14 Morgan A J, Mosselmans J, Charnock J, Bennett A, Winters C, O′Reilly M, Fisher P, Andre J, Turner M, Gunning P. Environ. Sci. Technol., 2012, 47(2): 1073-1081
15 Morgan A J, Kille P, Bennett A, O′Reilly M, Fisher P, Charnock J. Environ. Pollut., 2013, 173: 68-74
16 SUN JianLing, LUO LiQiang. Chinese J. Anal. Chem., 2014, 42(10): 1447-1452
孙建伶, 罗立强. 分析化学, 2014, 42(10): 1447-1452
17 Arnold R, Hodson M. Environ. Pollut., 2007, 148(1): 21-30
18 Arnold B E, Hodson M E, Charnock J, Peijnenburg W J. Environ. Sci. Technol., 2008, 42(10): 3900-3905
19 LUO LiQiang, XU Tao, CHU BinBin, SUN JianLing, WANG XiaoFang, BO Ying, LIU Ying, WANG ShuXian. Spectroscopy and Spectral Analysis, 2012, 32(3): 821-825
罗立强, 许 涛, 储彬彬, 孙建伶, 王晓芳, 伯 英, 刘 颖, 王淑贤. 光谱学与光谱分析, 2012, 32(3): 821-825
20 CHU BinBin, LUO LiQiang. Spectroscopy and Spectral Analysis, 2010, 30(3): 825-828
儲彬彬, 罗立强. 光谱学与光谱分析, 2010, 30(3): 825-828
21 Luo L, Chu B, Li Y, Xu T, Wang X, Yuan J, Sun J, Liu Y, Bo Y, Zhan X. XRay Spectrom., 2012, 41(3): 133-143
22 Andre J, Charnock J, Sturzenbaum S.R, Kille P, Morgan A J, Hodson M E. Environ. Sci. Technol., 2009, 43(17): 6822-6829
23 Finney L A, O′Halloran T V. Science, 2003, 300(5621): 931-936
24 Clarkson T. Annual Rev. Pharmacol. Toxicol., 1993, 33(1): 545-571
25 Hodson M E. Heavy Metals in Soils, 2013: 141-160
26 Spurgeon D, Hopkin S. App. Soil Ecol., 1999, 11(2): 227-243
Abstract To study the accumulation and storage mechanism of heavy metals in earthworms, synchrotron radiation micro Xray fluorescence (μSRXRF) was used to determine element distribution characteristics of K, Ca, Cu, Zn and Pb in earthworms living in garden around Qixiashan leadzinc mine of Nanjing. The imaging of these elements showed that Pb primarily accumulated in the region around the posterior alimentary canal. There were also Zn and Cu signals in the anterior and posterior part of earthworm, besides the distribution characters of Zn and Cu in the posterior part of earthworm were the same as that of Pb. The findings indicated that the distribution characters in the region around the posterior alimentary canal was a special accumulation and storage mechanism in earthworms for cutting the threat of toxic heavy metals. The high relationship between Pb and Zn distribution indicated that the two elements had a very similar pathway. In this study, we proved that μSRXRF had a great advantage in spatial distribution analysis of elements in earthworm samples. A further research focusing on Pb speciation in soil and earthworms is needed for understanding the detoxification mechanism in earthworms under heavy metal stress.
Keywords Synchrotron radiation micro Xray fluorescence; Earthworm; In situ analysis; Lead; Storage mechanism

