基于四氧化三铁磁性纳米粒子的微囊藻毒素免疫传感器研究
张晶晶 康天放 鲁理平 程水源

摘要:采用化学共沉淀法制备四氧化三铁(Fe3O4)磁性纳米粒子(MNPs),依次用3氨基丙基三乙氧基硅烷(APTS)、丁二酸酐(SAH)对Fe3O4 MNPs表面进行修饰,得到羧基功能化的核壳型磁性纳米粒子(Fe3O4@APTS·SAH MNPs),分别采用透射电镜(TEM)、磁滞回线、X射线光电子能谱(XPS)和傅里叶红外光谱(FTIR)对其进行了表征。将此纳米粒子修饰在自制的磁性玻碳电极(MGCE)表面,用1(3二氨基丙基)3乙基碳二亚胺盐酸盐(EDC)和N羟基琥珀酰亚胺(NHS)活化纳米粒子表面的羧基,通过与氨基的共价交联,将抗微囊藻毒素(亮氨酸精氨酸)(MCLR)抗体(antiMCLR)固定于该修饰电极上,用牛血清白蛋白(BSA)封闭非特异性吸附位点,构建了一种检测MCLR的电流型免疫传感器。采用直接竞争免疫反应模式,在标记物辣根过氧化物酶(HRP)的MCLR(MCLRHRP)存在下,利用差分脉冲伏安法(DPV)测定溶液中的微囊藻毒素。在优化的实验条件下,免疫传感器对MCLR的线性测定范围为0.05~100 μg/L,检出限为0.01 μg/L(S/N=3)。构建的免疫传感器呈现出良好的重现性、稳定性和特异性。将本传感器用于实际水样的测定,加标回收率为94.3%~99.5%。
关键词 :磁性纳米粒子; 微囊藻毒素; 免疫传感器; 差分脉冲伏安法
1 引 言
微囊藻毒素(MCs)是一种环状七肽肝毒素,可破坏人体细胞内的蛋白磷酸化平衡,引起肝脏病变[1,2]。目前, 已发现80多种MCs的同分异构体[3],其中微囊藻毒素(亮氨酸精氨酸)(MCLR)是已发现的毒性最强的微囊藻毒素之一[4]。世界卫生组织(WHO)制定的《饮用水水质准则》[5]中规定MCLR限量值为1 μg/L,因此检测饮用水源中的MCLR对于保障饮用水安全具有重要意义。目前,检测MCLR 的方法主要有高效液相色谱法(HPLC)[6]、高效液相色谱质谱联用技术(HPLCMS)[2,7]、蛋白磷酸酶抑制分析法(PPI)[8,9]等,HPLC和HPLCMS虽然灵敏度较高,但分析周期长、仪器设备昂贵、样品前处理耗时,并且对操作人员技术要求较高;而PPI法检测MCLR的选择性不高。因此,研究开发用于水环境中藻毒素的简单、快速、低成本的检测技术具有重要的实际应用意义。
免疫传感器是将传感技术与特异性免疫反应相结合而建立的一类分析技术。应用电化学免疫传感器检测MCLR具有灵敏度高、特异性好、操作简便、易实现微型化等优点,近年来备受关注[10~12]。磁性纳米粒子(MNPs)是一种新型纳米材料[13~15],可以用多种物质对其表面修饰,以实现其表面的功能化[16,17]。在本研究组的前期工作中,利用戊二醛将氨基功能化的四氧化三铁(Fe3O4)MNPs与MCLR抗体(antiMCLR)上的氨基交联,构建了检测MCLR的免疫传感器[18]。
本研究采用3氨基丙基三乙氧基硅烷(APTS)修饰Fe3O4磁性颗粒,得到Fe3O4@APTS,再利用丁二酸酐(SAH)将Fe3O4@APTS羧基化,得到Fe3O4@APTS·SAH,
通过磁力将复合物均匀地修饰到自制的磁性玻碳电极(MGCE)表面。利用1(3二氨基丙基)3乙基碳二亚胺(EDC)和N羟基琥珀酰亚胺(NHS)活化磁性颗粒表面的羧基,将Fe3O4@APTS·SAH和antiMCLR抗体偶联,基于直接竞争原理,构建了检测MCLR的免疫传感器。本免疫传感器呈现出良好的重现性、稳定性和特异性,用于实际水样的测定,结果令人满意。
2 实验部分
2.1 仪器与试剂
CHI 650d电化学工作站(上海辰华仪器公司);KQ218型超声波清洗仪(昆山市超声仪器有限公司);ZHWY103B培养振荡器(上海智成分析仪器制造有限公司);JEM1200EX透射电子显微镜(TEM,日本电子公司);7410VSM 振动样品磁强计(美国Lake Shore公司);X射线光电子能谱仪(日本ULVACPHI公司)。
石墨粉(320目,光谱纯,国药化学试剂有限公司);环形钕铁硼磁铁(内径1 mm,外径5 mm,厚1 mm,北京丰瑞磁性材料中心);玻碳片(直径5 mm,厚度2 mm,天津艾达恒晟科技公司);MCLR、antiMCLR、辣根过氧化物酶标记的MCLR(MCLRHRP)、微囊藻毒素精氨酸精氨酸(MCRR)和微囊藻毒素酪氨酸精氨酸(MCYR)(北京伊普瑞斯公司);APTS和牛血清白蛋白(BSA,Sigma公司);其它试剂均为分析纯;实验用超纯水由Advantage A10超纯水系统(法国MilliQ公司)制备。
2.2 磁性免疫传感器的制备与修饰
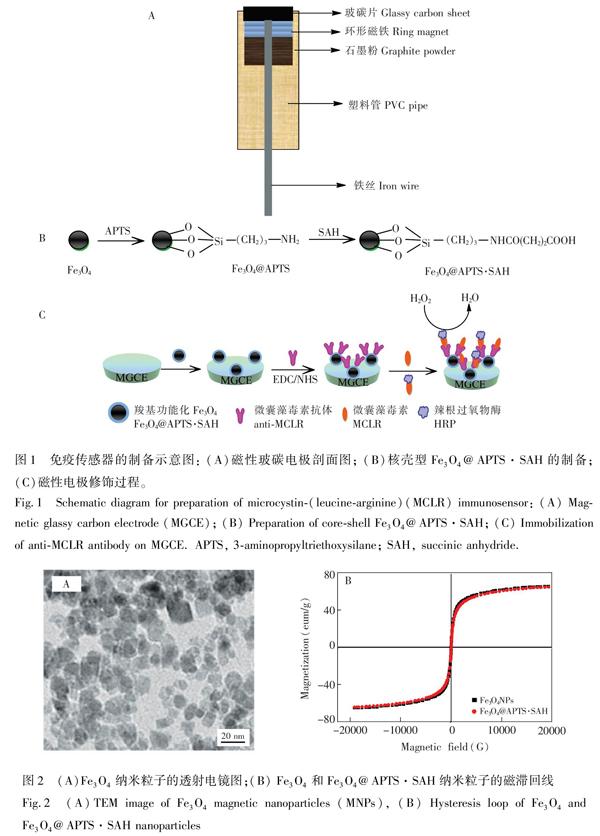
2.2.1 磁性玻碳电极的制备 参照文献[18]中的方法制备MGCE(图1A)。
2.2.2 羧基功能化Fe3O4纳米粒子的制备 采用化学共沉淀方法制备Fe3O4 MNPs[19]。称取25 mg Fe3O4 MNPs于5 mL乙醇溶液中,超声分散1 h,向其中加入0.4 mL APTS,室温下置于摇床中振摇24 h,磁分离,用乙醇和超纯水分别清洗,制得核壳型纳米粒子Fe3O4@APTS。将所制备的Fe3O4@APTS纳米粒子分散于5 mL乙醇中,加入5 mL含有800 mg丁二酸酐(SAH)的二甲亞砜溶液,振摇反应24 h,磁分离,并用乙醇和超纯水清洗后,以水定容至2.5 mL,于4℃储存备用[20]。图1B为制备羧基功能化Fe3O4(Fe3O4@APTS·SAH)纳米粒子的示意图。
2.2.3 抗体在磁性电极表面的固定 磁性电极修饰过程如图1C所示。将MGCE表面抛光,依次在水、无水乙醇、水中超声处理3 min,电极表面滴加25 μL Fe3O4@APTS·SAH纳米粒子悬浊液,室温下晾干后,以水冲洗,得到Fe3O4@APTS·SAH/MGCE。将其浸入含0.1 mol/L EDC和0.05 mol/L NHS混合溶液中,反应1 h后,滴加10 μL 15 μg/mL antiMCLR于MGCE表面,4℃下反应24 h,晾干后用水冲洗,得到antiMCLR/Fe3O4@APTS·SAH/MGCE。电极表面滴加1% BSA,湿盒中反应1 h,水冲洗后,于4℃储存备用。
2.3 MCLR的测定方法 电化学测定采用三电极系统:修饰的MGCE为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝电极为辅助电极。将10.0 μL不同浓度的MCLR 标准溶液或水样与10.0 μL 20 μg/mL MCLRHRP混合滴加到免疫传感器表面,孵育40 min,水冲洗,得到MCLR(MCLRHRP)/antiMCLR/Fe3O4@APTS·SAH/MGCE。在含2.4 mmol/L H2O2 和1.2 mmol/L 对苯二酚(HQ)的0.1 mol/L磷酸盐缓冲溶液 (PBS,pH 7.4)中,采用差分脉冲伏安法(DPV)测量响应电流。电位扫描范围为 ,脉冲振幅50 mV,脉冲宽度50 ms。
3 结果与讨论
3.1 磁性纳米粒子的表征
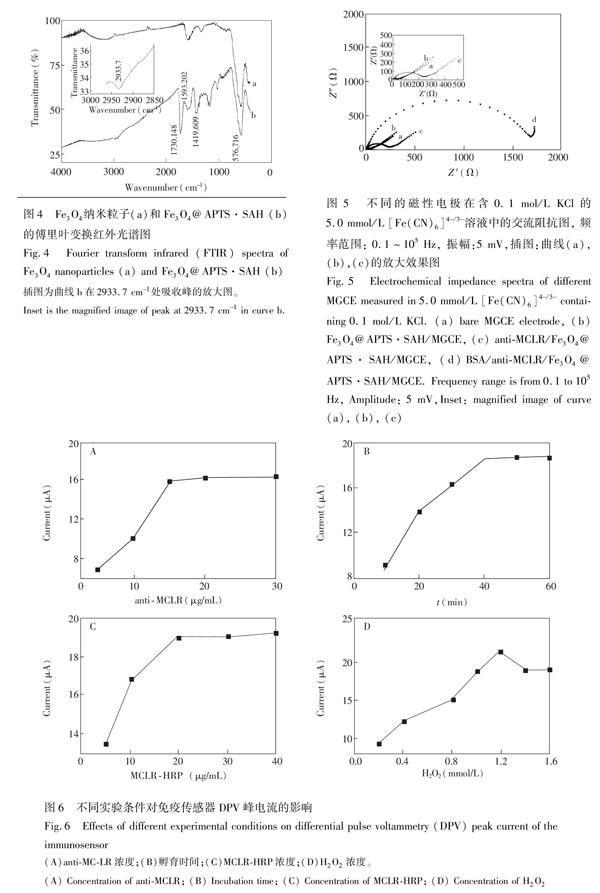
从图2A可见,Fe3O4 MNPs呈球形,分散均匀,粒径约10~20 nm。Fe3O4和Fe3O4@APTS·SAH的矫顽力(图2B)分别为9.1399和10.981 G,剩磁分别为1.1569和1.2128 emu/g,比饱和磁化强度十分接近,分别为65.029和64.119 emu/g,说明对Fe3O4进行表面羧基功能化后未对其磁学性能造成明显影响。
Fe3O4纳米粒子的X射线光电子能谱(XPS)分析全谱图如图3A所示,可见其主要组成元素为Fe与O,在材料表面的含量分别为65.89%和34.11%。图3B中位于723.3和709.5 eV的特征峰为Fe 2p1/2和Fe 2p3/2,说明材料中有一定量的Fe和Fe。图3C中位于528.8 eV的特征峰为O 1s,对应于Fe3O4中的O元素。图3D所示的 Fe3O4@APTS·SAH全谱分析表明,其主要组成元素为O, C, Fe, Si和N,含量分别为46.55%, 28.21%, 19.93%, 2.95%和2.36%,相对于图3A中元素组成和含量有明显变化,其中C, Si, N元素分别来自于已连接到Fe3O4的APTS和SAH,图3E~G中位于398.8, 284和101 eV的特征峰分别对应于N 1s, C 1s和Si 2p。
4 结 论
Fe3O4@APTS·SAH磁性纳米材料具有良好的磁学性能和生物相容性,将其固载于磁性电极表面,采用直接竞争模式,构建了检测MCLR的免疫传感器。本方法具有操作简便、检测快速、灵敏度高等优点,有望用于微囊藻毒素的现场快速测定。
References
1 Mackintosh C, Beattie K A, Klumpp S, Cohen P, Codd G A. FEBS Lett., 1990, 264(2): 187-192
2 Allis O, Dauphard J, Hamilton B, Shuilleabhain A N, Lehane M, James K J, Furey A. Anal. Chem., 2007, 79(9): 3436-3447
3 Welker M, Dohren H. FEMS Microbiol. Rev, 2006, 30(4): 530-563
4 Chang J, Chen Z L, Wang Z, Shen J M, Chen Q, Kang J, Yang L, Liu X W, Nie C X. Water Res., 2014, 63: 52-61
5 WHO. Guidelines for DrinkingWater Quality, 3rd Edition, Geneva: World Health Organization, 2004: 407-408
6 Lawton L A, Edwards C, Codd G A. Analyst, 1994, 119(7): 1525-1530
7 Draper W M, Xu D, Perera S K. Anal. Chem., 2009, 81(10): 4153-4160
8 Serres M H, Fladmark K E, Doskeland S O. Toxicon, 2000, 38(3): 347-360
9 Sassolas A, Catanante G, Fournier D, Marty J L. Talanta, 2011, 85 (5), 2498-2503
10 WANG Ling, KANG TianFang, ZHANG JingJian,LU LiPing, CHENG ShuiYuan. Journal of Instrumental Analysis, 2015, 34(5): 552-557
王 玲, 康天放, 張晶晶, 鲁理平, 程水源. 分析测试学报, 2015, 34(5): 552-557
11 ZHANG JinGuo, KANG TianFang, XUE Rui, SUN Xue. Chinese J. Anal. Chem., 2013, 41(9): 1353-1358
张金果, 康天放, 薛 瑞, 孙 雪. 分析化学, 2013, 41(9): 1353-1358
12 ZHANG XinAi, SHEN JianZhong, ZHANG Fan, MA HaiLe, HAN En, DONG XiaoYa. Chinese J. Anal. Chem., 2014, 42(9): 1301-1306
张新爱, 申建忠, 张 帆, 马海乐, 韩 恩, 董晓娅. 分析化学, 2014, 42(9): 1301-1306
13 Zhou J, Gan N, Li T, Zhou H, Li X, Cao Y, Wang L, Sang W, Hu F. Sens. Actuators, B., 2013, 178: 494-500
14 Zhou H,Gan N, Li T, Cao Y, Zeng S, Zheng L, Guo Z. Anal. Chim. Acta, 2012, 746: 107-113
15 Nourani S, Ghourchian H, Boutorabi S M. Anal. Biochem., 2013, 441(1): 1-7
16 Zhang H, Ying S, Wang J, Zhang J, Zhang H, Zhou H, Song D. Biosens. Bioelectrons., 2012, 34(1): 137-143
17 Rossi L M, Quach A D, Rosenzweig Z. Anal. Bioanal. Chem., 2004, 380(4): 606-613
18 Wang L, Kang T F, Lu L P, Zhang J G, Xue R, Cheng S Y. Anal. Lett., 2014, 47(18): 2939-2949
19 Zhao X,Cai Y, Wang T, Shi Y, Jiang G. Anal. Chem., 2008, 80(23): 9091-9096
20 Shen M, Cai H, Wang X, Cao X, Li K, Wang S H, Guo R, Zheng L, Zhang G, Shi X. Nanotechnology, 2012, 23(10): 105601
Abstract An immunosensor for detection of microcystin(leucinearginine) (MCLR) was constructed. Chemical coprecipitation method was used to synthesize ferriferrous oxide magnetic nanoparticles (Fe3O4 MNPs). The Fe3O4 MNPs were modified with 3aminopropyltriethoxysilane (APTS) and succinic anhydride (SAH) in turn to generate carboxylfunctionalized coreshell MNPs (Fe3O4@APTS·SAH MNPs), which were characterized by transmission electron microscope (TEM), hysteresis loop, Xray photoelectron spectroscopy (XPS) and Fourier transform infrared spectroscopy (FTIR), respectively. The Fe3O4@APTS·SAH MNPs were modified onto the surface of a homemade magnetic glassy carbon electrode (MGCE). AntiMCLR antibody (antiMCLR) was immobilized on the modified MGCE by coupling reaction with ethyl3(dimethyl aminopropyl) carbodiimide (EDC) and Nhydroxysuccinimide (NHS). Subsequently, bovine serum albumin (BSA) was used to block the nonspecific adsorption sites of the electrode. Direct competitive immunoassay format was adopted. In the presence of horseradish peroxidaseconjugated MCLR (MCLRHRP), MCLR in solution was determined by differential pulse voltammetry (DPV). Under the optimized conditions, MCLR could be detected within a wide linear range of 0.05-100 μg/L with a detection limit of 0.01 μg/L (S/N=3). Moreover, the immunosnssoe exhibited good reproducibility, stability and selectivity. The immunosensor was applied for the determination of MCLR in real water samples with the recoveries from 94.3% to 99.5%.
Keywords Magnetic nanoparticles; Microcystin; Immunosensor; Differential pulse voltammetry

