高效液相色谱—串联质谱法测定养殖环境沉积物中多肽类抗生素残留量
钱卓真 罗冬莲 罗方方 汤水粉

摘要建立了测定水产养殖环境沉积物中多肽类抗生素残留量的高效液相色谱串联质谱法。沉积物经10 mL甲醇柠檬酸Na2HPO4溶液(3∶4, V/V)超声提取2次,0.5 g乙二胺四乙酸二钠络合除杂,5 mL甲基异丁基甲酮净化,HLB固相萃取柱进一步富集净化,MGII C18色谱柱分离,0.1%甲酸与0.1%甲酸乙腈梯度洗脱,ESI+电离,多反应监测模式(MRM)监测,外标法定量。粘菌素和杆菌肽在10~10000 μg/L范围内,维吉尼霉素M1在4~4000 μg/L范围内,线性回归系数均大于0.999,方法检出限为2~5 μg/kg,方法定量限为4~10 μg/kg。在3个浓度添加水平下,多肽类抗生素回收率79.7%~91.6%,相对标准偏差1.9%~10.8%。本方法具有良好的精密度和准确度,灵敏度高,适用范围广。
关键词 高效液相色谱串联质谱法; 水产养殖环境; 沉积物; 多肽类药物; 残留
1引言
粘菌素(Colistin)、杆菌肽(Bacitracin)和维吉尼霉素M1(Virginiamycin M1)属于多肽类抗生素。其中,杆菌肽具有一定肾毒性和神经毒性; 粘菌素易引起耐药菌的产生; 而维吉尼霉素M1对人体肠道菌群环境具有一定破坏作用,易引起腹泻或维生素缺乏等症状[1,2]。欧盟委员会早在1999年就禁止在动物源性食品生产和加工过程中使用杆菌肽、维吉尼霉素等4种抗生素 [3],我国农业部也在2002年《无公害食品 渔用药物使用准则(NY 50712002)》中将杆菌肽列为渔业禁用药物。但由于多肽抗生素具有高效廉价的特点,仍常被作为饲料添加剂和药物用于动物养殖 [4]。这类药物相对不易降解,会通过饲料及动物排泄物进入养殖环境并持续累积,进而通过食物链蓄积作用进入人体,对人体器官产生蓄积毒性作用,危害人体健康[5~7]。此类药物会杀灭水环境中有益微生物,破坏水体微环境的生态平衡。
近年,有关多肽类抗生素残留检测的方法研究多集中在动物组织、饲料、牛奶等方面[8~12],有关养殖环境中多肽类抗生素测定研究较少。罗方方等[13]测定了海水中杆菌肽残留量,但这些方法均不适用于养殖环境沉积物中多肽类抗生素的测定。沉积物类似一个大型的蓄积池[14,15],相较于动物组织、饲料、牛奶等样品更为复杂,其含有不等量的重金属和有机质杂质。该类杂质不仅会损伤质谱仪,而且会完全抑制多肽类抗生素在电喷雾质谱上的响应,从而影响灵敏度。针对上述难点,本研究以水产养殖环境中的沉积物为研究对象,建立沉积物中多肽类抗生素残留量测定的高效液相色谱串联质谱法。
2实验部分
2.1仪器、试剂和样品
TSQ Quantum Access高效液相色谱串联质谱仪(美国Thermo Fisher公司),配电喷雾离子源; AB204E型、PL203型电子分析天平(Mettler Toledo 公司); 离心机(北京时代北利离心机有限公司); MS3型旋涡混合器(德国IKA公司); KQ600DB超声波清洗器(昆山市超声仪器有限公司); ZZDCH16水浴氮吹仪(广州智真生物科技有限公司)。
硫酸粘菌素(CS,纯度78.3%)、 杆菌肽(BTC,纯度77.0%)、 维吉尼霉素M1(VGMM1,纯度95.0%)均购自德国Dr公司; 甲基异丁基甲酮(MIBK)、乙腈、甲醇(色谱纯,美国Tidea公司); 乙二胺四乙酸二钠(Na2EDTA)、一水柠檬酸、十二水磷酸氢二钠(分析纯,国药集团化学试剂有限公司); 0.22 μm尼龙针式过滤器(天津市津腾实验设备有限公司); Oasis HLB固相萃取柱(200 mg,6 mL; 美国Waters公司); 水为MilliQ制备的超纯水(美国Millipore公司)。
沉积物采自漳州、莆田及泉州的水产养殖区,采样深度0~20 cm; 共10个,包括泥质、泥沙、沙质3种类型沉积物,每个样品重约500 g。沉积物样品经冷冻干燥机干燥24 h后研磨,过80目筛,4℃保存。其中沉积物样品的含水率13.4%~49.5%,有机质含量0.43%~2.02%。
2.2标准溶液配制
准确称取硫酸粘菌素25.5 mg、杆菌肽26 mg,用0.1%甲酸溶液配制成200 mg/L的混合标准储备液; 称取维吉尼霉素M110.5 mg,用甲醇配制成100 mg/L的标准储备液; 4℃下避光保存(称取标准品的质量是按纯度修正过的质量)。配制0.1 mol/L柠檬酸0.2 mol/L Na2HPO4缓冲溶液(1000∶625, V/V); 甲醇柠檬酸Na2HPO4混合溶液(3∶4, V/V); 定容液: 0.1%甲酸乙腈混合溶液(8∶2, V/V)。
2.3样品前处理
称取 5 g±0.05 g 过筛后的沉积物样品于50 mL离心管内,依次加入Na2EDTA 0.5 g、甲醇柠檬酸Na2HPO4混合溶液10 mL,2000 r/min渦旋混合1 min,超声提取10 min,3500 r/min离心5 min,取上清液,残渣重复提取1次,合并上清液至另一个离心管。上述清液中加入MIBK 5 mL,2000 r/min涡旋混合1 min,3500 r/min离心5 min,将上层液转移至15 mL玻璃试管中,重复上述操作一次。合并两次MIBK提取液,于40℃氮吹至干,甲醇1 mL复溶后,与下层液合并,待固相萃取柱净化。
Oasis HLB固相萃取柱依次用5 mL甲醇、5 mL水预活化,上样, 10 mL水淋洗,控制流速为每秒1滴, 以甲醇3 mL、0.1%甲酸甲醇溶液3 mL依次洗脱,收集全部洗脱液,于40℃氮吹至干。以1 mL定容液复溶,混匀,过膜,待测定。
2.4色谱条件
CAPCELL PAK MGII C18色谱柱(150 mm×2.0 mm, 5 μm); 柱温25℃; 流速0.2 mL/min; 进样量10 μL; 流动相: A 为0.1%甲酸,B 为0.1%甲酸乙腈; 洗脱梯度: 0~2 min,90% A; 2~4 min,90%~25% A; 4~9 min,25% A; 9~10 min, 25%~90% A; 10~12 min,90% A。
2.5质谱条件
电喷雾离子源,正离子检测模式,喷雾电压: 4500 V,雾化气压: 241 kPa,辅助气压: 13.8 kPa,离子传输毛细管温度: 350℃,多反应监测(MRM),母离子、子离子和碰撞能量见表1,Q1半峰宽: 0.7 Da,Q3半峰宽: 0.7 Da,碰撞气压力: 氩气,1.2 mTorr。标准品多反应监测离子流色谱图见图1。
3结果与讨论
3.1提取剂的选择
3种多肽类抗生素溶解性差异较大,单一试剂均不可达到理想的提取效果[16,17]。分别以乙腈0.1%甲酸溶液、甲醇0.1%甲酸溶液、乙腈柠檬酸Na2HPO4溶液和甲醇柠檬酸Na2HPO4溶液作为提取剂。结果表明,甲醇0.1%甲酸溶液和甲醇柠檬酸Na2HPO4溶液提取效果差异不大。但由于后续步骤需使用Na2EDTA,且Na2EDTA在温和pH条件下才会发挥作用,故选择甲醇柠檬酸Na2HPO4溶液作为提取剂。同时比较了提取剂与抗生素溶液的体积比对提取效果的影响,二者比例为3∶4时,目标物质的提取效率最高。
3.2乙二胺四乙酸二钠用量的选择
沉积物基质复杂,其中含有不等量的重金属和有机质等复杂杂质[18~20]。在电喷雾质谱条件下,该杂质会对目标物产生明显离子抑制作用,完全抑制粘菌素和杆菌肽电离。由图2a可见,加入适量Na2EDTA可除去部分杂质,消除部分离子抑制作用,有效降低杂质影响。实验以泥质沉积物为基质,比较了未加入Na2EDTA和分别加入0.25,0.50,0.75和1.0 g Na2EDTA对3种目标物回收率的影响。结果表明,加入0.5 g Na2EDTA,目标物的回收率最高。
3.3净化溶液的选择
虽然通过Na2EDTA的络合作用可除去部分重金属杂质,但残留在提取液中的金属络合物仍对粘菌素和杆菌肽的回收率造成严重影响。质谱全扫描发现, 存在的干扰物质与目标物质分子量接近,在电喷雾质谱条件下,该类干扰物质容易对目标物质形成离子抑制作用(图2a质谱图)。实验比较了不同净化溶液的净化效率,研究表明,MIBK可进一步去除目标物质分子量接近的杂质,完全消除杂质对目标物的离子抑制作用,使得目标物在电喷雾质谱上有明显响应(图2b)。
由于维吉尼霉素M1易溶于有机试剂,故部分维吉尼霉素M1被MIBK浸提出来,影响维吉尼霉素M1的提取。为消除MIBK对维吉尼霉素M1提取效率的影响,MIBK层氮吹至干后,用甲醇将溶于MIBK中的维吉尼霉素M1反萃取出来。最终将此甲醇溶液合并于提取液中,经固相萃取柱净化后再进行检测, 3种目标物的回收率均达到了检测要求。实验比较了3, 5, 10和15 mL MIBK的净化效果(图3),即使添加少量MIBK,3种目标物的回收率均可以达到理想效果,为了充分降低络合物的影响, MIBK分两次净化,每次5 mL。
3.4净化方法的选择
实验比较Oasis HLB固相萃取柱和SAX 强阳离子交换柱对目标物净化效果和回收率的影响。结果表明,Oasis HLB固相萃取柱净化效果好,总体回收率均大于70%,同时对洗脱溶剂进行优化。由表2可知,甲醇作为洗脱溶剂,维吉尼霉素M1充分洗脱,但粘菌素和杆菌肽洗脱不完全; 0.1%甲酸甲醇作为洗脱溶剂,洗脱现象正好相反。综合考虑,实验采用3 mL甲醇、3 mL 0.1%甲酸甲醇溶液依次洗脱。
3.5标准曲线、线性范围、检出限和定量限
采用基质匹配标准曲线法,移取适量标准储备液,用空白沉积物样品提取液分别配制成不同质量浓度基质标准溶液,粘菌素和杆菌肽浓度分别为10, 50, 500, 1000, 2500, 5000和10000 μg/L,维吉尼霉
素M1的浓度分别为4, 20, 200, 400, 1000, 2000和4000 μg/L。 各组分浓度与其色谱峰面积呈良好的线性关系, 线性相关系数均大于0.999。
以3倍信噪比(S/N)计算,粘菌素、杆菌肽、维吉尼霉素M1检出限分别为5, 5和2 μg/kg; 以10倍信噪比(S/N)计算,粘菌素、杆菌肽、维吉尼霉素M1定量限分别为10, 10和4 μg/kg。
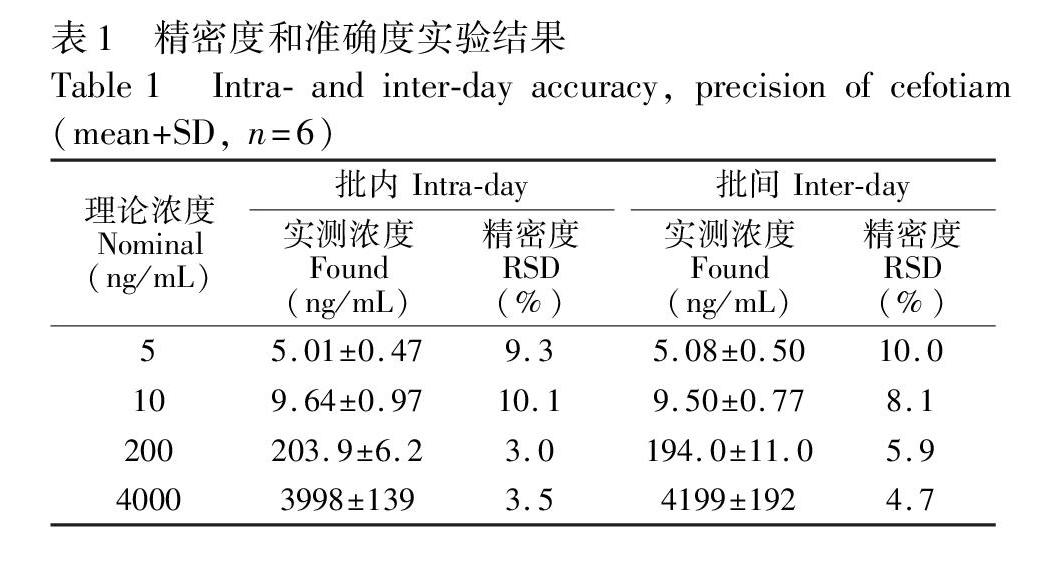
3.6方法准确度和精密度
以实际采集的养殖区泥质为研究对象进行标准添加实验,粘菌素和杆菌肽添加水平分别为10, 100和1000 μg/kg,维吉尼霉素M1添加水平分别为4, 40和400 μg/kg,每个浓度水平做6个平行实验,考察方法的准确度及精密度,平均回收率为79.7%~91.6%,相对标准偏差为1.9%~10.8%(表3)。20天内100 μg/kg加标浓度下进行6次标准添加实验,考察方法日间精密度,相对标准偏差为2.4%~11.1%(表3)。方法的精密度和準确度均能满足药物残留监测需求。选取3种类型的沉积物(泥质、泥沙、沙质)为对象,100 μg/kg加标浓度下考察方法适用性,回收率为78.1%~84.5%,相对标准偏差为2.6%~9.6%(表4)。结果表明,本方法适用范围广。
3.7实际样品的测定
采用本方法测定漳州东山湾沿岸水产养殖区3个采样点的沉积物样品,均未检出上述3 种目标物。
References
1LUO FangFang, QIAN ZhuoZhen, ZHU ShiChao, WU ChengYe. Journal of Fujian Fisheries, 2012, 34(6): 509-513
罗方方, 钱卓真, 朱世超, 吴成业. 福建水产, 2012, 34(6): 509-513
2WANG ZhengBin, LIU YongTao, DONG Jing, XU Ning, YANG QiuHong, XU ChunJuan, AI XiaoHui. Journal of Huazhong Agricultural University, 2015, 34(5): 105-110
王正彬, 刘永涛, 董 靖, 胥 宁, 杨秋红, 徐春娟, 艾晓辉. 华中农业大学学报, 2015, 34(5): 105-110
3Wan E C H, Ho C, Sin D W M, Wong Y C. Anal. Bioanal. Chem., 2006, 385(1): 181-188
4LUO FangFang, QIAN ZhuoZhen, LIN RongXiao, WU ChengYe. South China Fisheries Science, 2013, 9(4): 62-68
罗方方, 钱卓真, 林荣晓, 吴成业. 南方水产科学, 2013, 9(4): 62-68
5TIAN Yu, JIA ZhongBiao, WANG Xu. Heibei Fisheries, 2011, 210(6): 59-61
田 雨, 贾中彪, 王 旭. 河北渔业, 2011, 210(6): 59-61
6SUN Ke, ZOU XiaoTing. Gansu Animal and Veterinary Sciences, 2008, 38(3): 43-46
孙 科, 邹晓庭. 甘肃畜牧兽医, 2008, 38(3): 43-46
7DONG YuYing, ZANG Yang, GUO XingLi, LI Dan, HAO Miao. Journal of Anhui Agricultural Sciences, 2008, 36(6): 2512-2513
董玉瑛, 张 阳, 郭幸丽, 李 丹, 郝 苗. 安徽农业科学, 2008, 36(6): 2512-2513
8LIN WeiXuan, SUN XingQuan, TIAN Miao, YU Ling, CHEN Xi, LI Zhe. Journal of Instrumental Analysis, 2009, 28(2): 212-215
林维宣, 孙兴权, 田 苗, 于 灵, 陈 溪, 李 哲. 分析测试学报, 2009, 28(2): 212-215
9SU Meng, AI LianFeng, DUAN WenZhong, HA Jing. Chinese Journal of Analysis Laboratory, 2012, 31(3): 73-77
苏 萌, 艾连峰, 段文仲, 哈 婧. 分析试验室, 2012, 31(3): 73-77
10WEI YunJi, FENG Min, LIU Yan, HUANG Ming, WANG Yan, YIN Yao, ZHOU GuangHong, WU Bin. Chinese Journal of Analysis Laboratory, 2012, 31(4): 50-53
魏云计, 冯 民, 刘 艳, 黄 明, 王 艳, 殷 耀, 周光宏, 吴 斌. 分析试验室, 2012, 31(4): 50-53
11LIU Qi, SUN Lei, ZHANG Li. Chinese Journal of Veterinary Drug, 2011, 45(7): 17-20
劉 琪, 孙 雷, 张 骊. 中国兽药杂志, 2011, 45(7): 17-20
12Boscher A, Guignard C, Pellet T, Hoffmann L, Bohn T. J. Chromatogr. A, 2010, 1217: 6394-6404
13LUO FangFang, QIAN ZhuoZhen, LIN RongXiao, WU ChengYe. Journal of Fujian Fisheries, 2013, 35(4): 270-275
罗方方, 钱卓真, 林荣晓, 吴成业. 福建水产, 2013, 35(4): 270-275
14Snjeana H R, Zorana K G, Darija K, Ivana U. Chemosphere, 2014, 114: 69-75
15MENG Lei, YANG Bing, XUE NanDong. Asian J. Ecotoxicol., 2015, 10(2): 76-88
孟 磊, 杨 兵, 薛南冬. 生态毒理学报, 2015, 10(2): 76-88
16LIU JiaJia, JIN Fen, SHE YongXin, LIU HongBin, SHI XiaoMei, WANG Miao, WANG Jing, XU SiYuan. Chinese J. Anal. Chem., 2011, 39(5): 652-657
刘佳佳, 金 芬, 佘永新, 刘洪斌, 史晓梅, 王 淼, 王 静, 徐思远. 分析化学, 2011, 39(5): 652-657
17Sin D W M, Ho C, Wong Y H, Ho S K, ALEC C B I. Anal. Chim. Acta, 2005, 535(12): 23-31
18YANG JiFeng, YING GuangGuo, ZHAO JianLiang, TAO Ran, SU HaoChang. Environmental Chemistry, 2015, 34(1): 54-59
杨基峰, 应光国, 赵建亮, 陶 然, 苏浩昌. 环境化学, 2015, 34(1): 54-59
19NIE XiangPing, HE XiuTing, YANG YongTao, CHEN KunCi, PAN DeBo. Environmental Science, 2009, 30(1): 266-270
聂湘平, 何秀婷, 杨永涛, 陈锟慈, 潘德博. 环境科学, 2009, 30(1): 266-270
20HE XiuTing, WANG Qi, NIE XiangPing, YANG YongTao, CHENG Zhang. Environmental Science, 2014, 35(7): 2728-2735
何秀婷, 王 奇, 聂湘平, 杨永涛, 程 章. 环境科学, 2014, 35(7): 2728-2735

