基于聚多巴胺/铜微粒自组装多层膜的无酶葡萄糖传感器
罗明荣 王良良 张亚静 赵爽
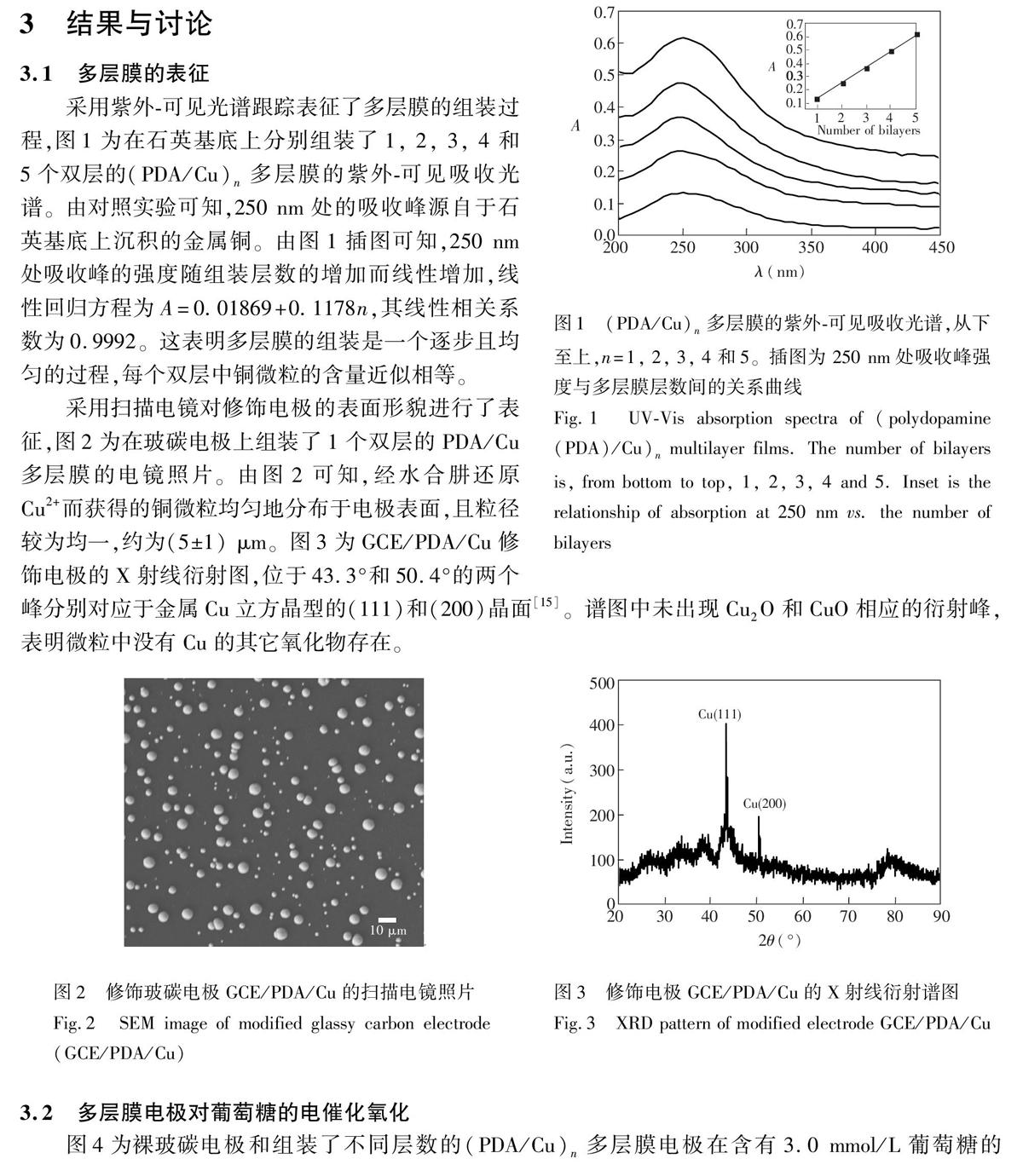
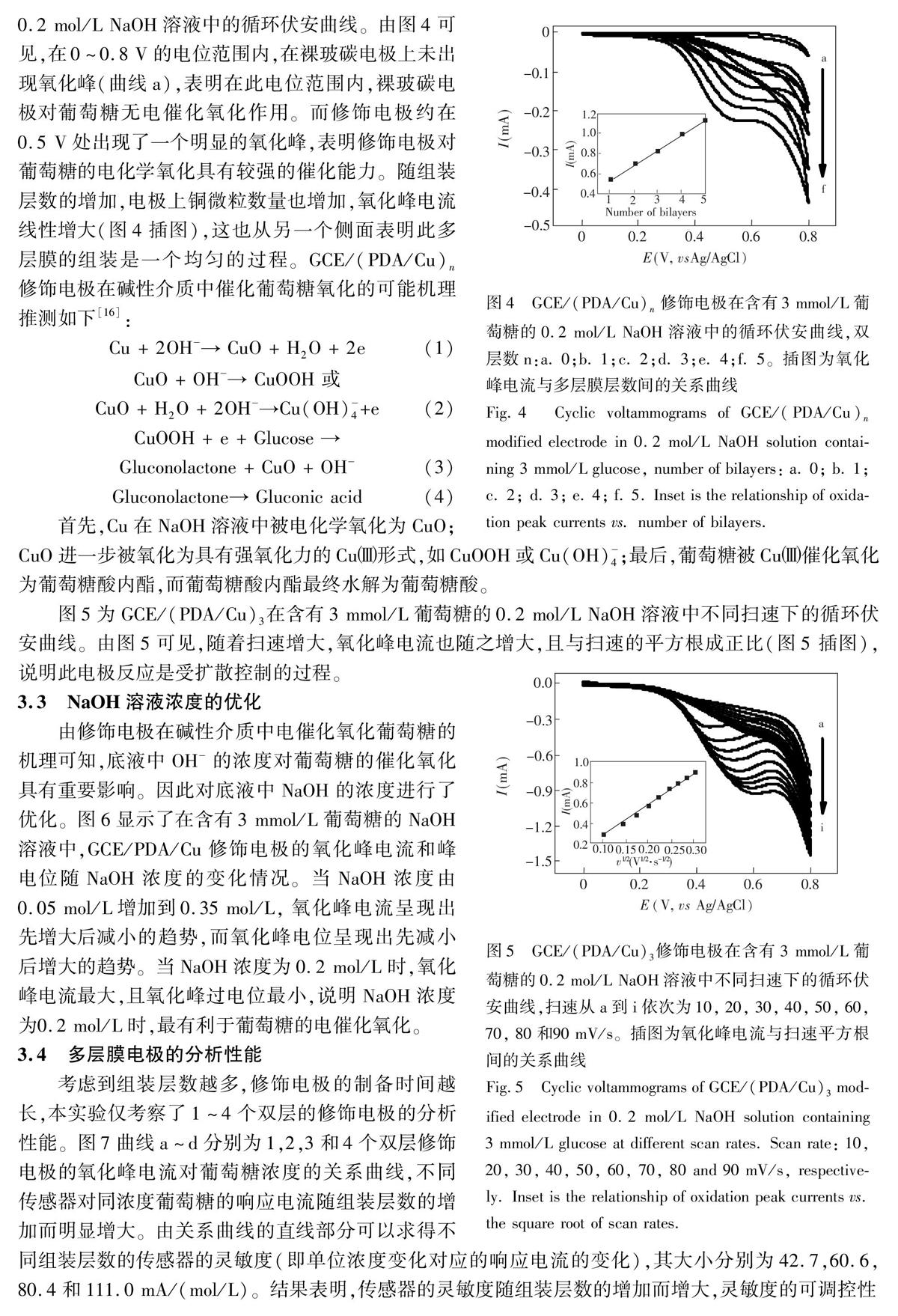
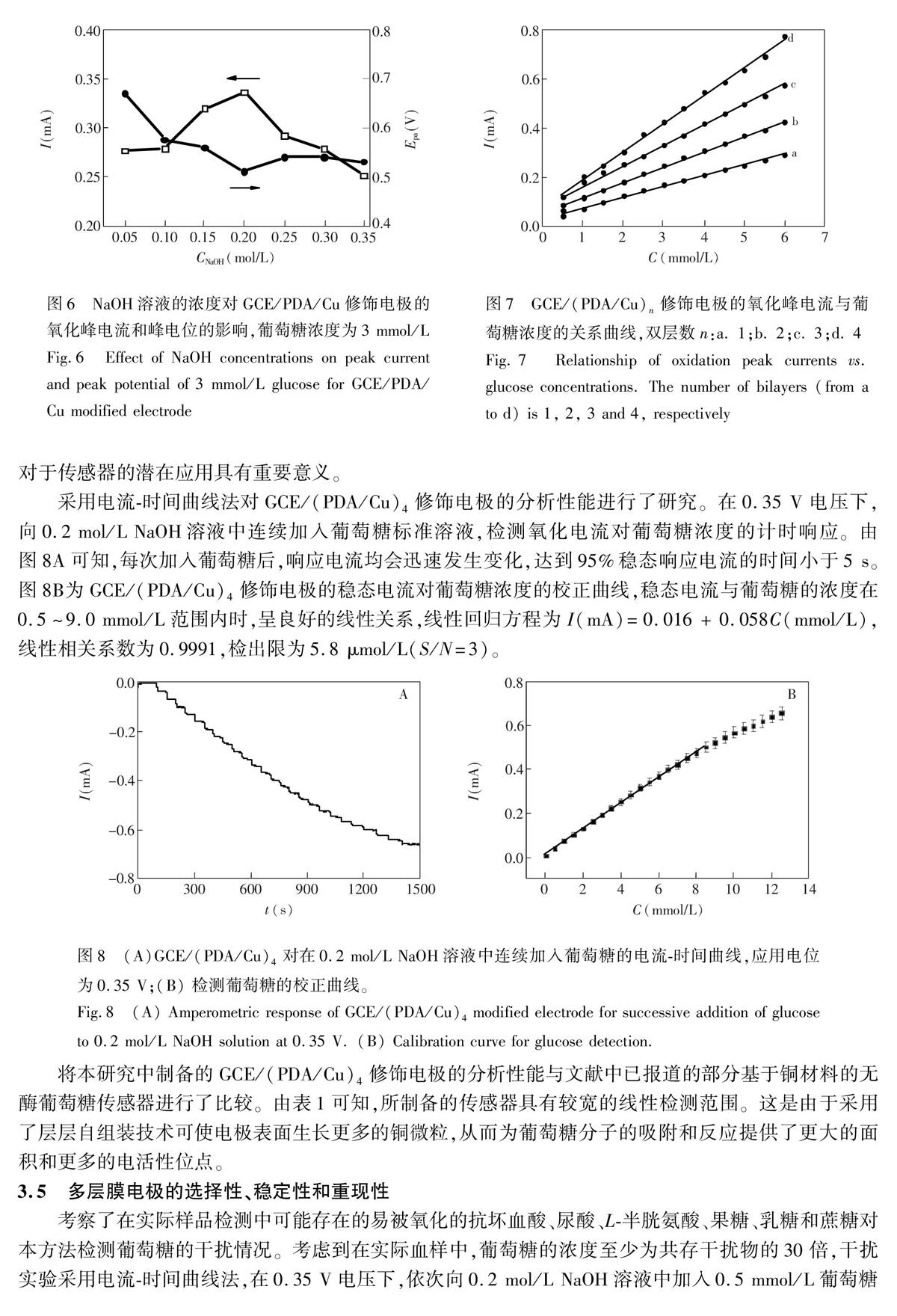
摘要利用多巴胺易于在电极表面发生自聚反应,且聚多巴胺膜中富含邻苯二酚等反应性基团,可通过二次反应实现电极表面的进一步功能化修饰的特点,在玻碳电极(GCE)表面,将多巴胺自聚膜(PDA)与铜微粒(Cu)进行层层自组装,构建了无酶葡萄糖电化学传感器(GCE/(PDA/Cu)n)。传感器的灵敏度可通过控制多层膜的组装层数进行调控。采用紫外可见光谱跟踪表征了多层膜的组装过程,结果表明,多层膜的生长是逐步且均匀的过程。采用循环伏安法和电流时间曲线法研究了修饰电极对葡萄糖的电催化氧化性能。对于GCE/(PDA/Cu)4,检测葡萄糖的线性范围为0.5~9.0 mmol/L,检出限为5.8 μmol/L(S/N=3)。本传感器具有良好的重现性、稳定性和较强的抗干扰能力。将本传感器用于血清中葡萄糖的测定,结果令人满意。
关键词 层层自组装; 无酶传感器; 葡萄糖; 电催化; 多巴胺自聚物
1引言
在已报道的检测葡萄糖的方法中,电化学传感器是最常采用的方法之一[1],可分为基于葡萄糖氧化酶的传感器和无酶传感器两类。由于酶活性易受到环境,如温度、湿度及酸碱度等因素的影响,在一定程度上限制了酶传感器的应用。而无酶葡萄糖传感器不仅不需要葡萄糖氧化酶在电极表面复杂的固定化过程,而且稳定性好、价格低廉,因此一直是该领域的研究热点[2~5]。无酶葡萄糖传感器是基于葡萄糖在电极表面的直接电催化氧化而构建的,已报道的对葡萄糖具有电催化氧化作用的材料包括贵金属、合金材料、过渡金属及其氧化物等,其中相对廉价的过渡金属Cu、Ni及其氧化物或氢氧化物等,由于对葡萄糖检测具有较好的选择性和稳定性而得到了广泛关注[6,7]。
多巴胺是大脑中含量最丰富的儿茶酚胺类神经递质,参与控制运动、认知、情感等多种生理功能,其电化学行为已被广泛研究[8,9]。近年的研究表明,多巴胺在水溶液中很容易被溶解氧所氧化,继而引发自聚交联反应,可在几乎所有固体基质表面形成具有极强粘附性的聚多巴胺(PDA)层[10,11],聚多巴胺的邻苯二酚基团能够对很多金属离子产生较强的配位作用,且聚多巴胺对金属离子具有较强的还原能力,因此可在基质表面获得聚多巴胺/金属复合修饰层[12,13]。
本实验利用多巴胺自聚反应的特性,首先制备聚多巴胺修饰的玻碳电极,然后利用聚多巴胺对Cu2+的配位作用及水合肼对Cu2+的强还原作用,获得聚多巴胺和铜(Cu)微粒共修饰的玻碳电极,通过层层自组装,构建了基于(PDA/Cu)n多层膜的灵敏度可调的无酶葡萄糖电化学传感器。采用紫外可见光谱对多层膜的形成过程进行了跟踪表征,采用循环伏安法和电流时间曲线法详细研究了传感器对葡萄糖的电催化氧化性能。
2实验部分
2.1仪器与试剂
CHI660E电化学工作站(上海辰华仪器有限公司),采用三电极体系:以修饰的玻碳电极(GCE,Φ=3 mm)为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极;Hitachi S3400N扫描电子显微镜(日本日立公司);TU1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);PW3040/60型X射线衍射仪(荷兰PANalytical B.V公司,Cu Kα辐射源)。
多巴胺盐酸盐(DA,SigmaAldrich公司);CuSO4、葡萄糖(国药集团化学试剂有限公司);所用试剂均为分析纯;实验用水为去离子水。
2.2传感器的制备
将玻碳电极依次用1.0, 0.3和0.05 μm的αAl2O3粉末抛光,用去离子水和乙醇交替超声清洗3次, 然后用氮气吹干,备用。将处理好的裸玻碳电极浸入含有2 mmol/L多巴胺的TrisHCl缓冲溶液中(10 mmol/L,pH 8.5),30 min后取出,用去离子水冲洗并用氮气吹干,即得到聚多巴胺修饰的玻碳电极(GCE/PDA)[14]。将GCE/PDA浸入含有0.5 mol/L水合肼以及0.05 mol/L Cu2+EDTA的溶液中,2 h后取出,用去离子水冲洗并用氮气吹干,即得到由聚多巴胺和铜微粒共同修饰的玻碳电极(GCE/PDA/Cu)。重复上述步骤可得到多层膜修饰电极(GCE/(PDA/Cu)n),膜的层数可由重复次数控制。
References
1Chen C, Xie Q J, Yang D W, Xiao H L, Fu Y C, Tan Y M, Yao S Z. RSC Adv., 2013, 3(14): 4473-4491
2FANG Li, HE JinLu. Process. Chem., 2015, 27(5): 585-593
方 莉, 贺进禄. 化学进展, 2015, 27(5): 585-593
3Tian K, Prestgard M, Tiwari A. Mater. Sci. Eng. C, 2014, 41: 100-118
4WANG YiLan, BAO XiaoYu, YANG Yan, BAO KeYan, LIU MengFei. Journal of Analytical Science. 2016, 32(1): 71-74
王藝兰, 包晓玉, 杨 妍, 鲍克燕, 刘梦菲. 分析科学学报, 2016, 32(1): 71-74
5Wang G F, He X P, Wang L L, Gu A X, Huang Y, Fang B, Geng B Y, Zhang X J. Microchim. Acta, 2013, 180(34): 161-186
6Guo M M, Xia Y, Huang W, Li Z L. Electrochim. Acta, 2015, 151: 340-356
7Yi W, Liu J, Chen H B, Gao Y, Li H M. J. Solid State Electrochem., 2015, 19(5): 1511-1521
8Yang X, Feng B, He X L, Li F P, Ding Y L, Fei J J. Microchim. Acta, 2013, 180(1112): 935-956
9Jackowska K, Krysinski P. Anal. Bioanal. Chem., 2013, 405(11): 3573-3771
10Lee H, Dellatore S M, Miller W M, Messersmith P B. Science, 2007, 318(5849): 426-430
11Ye Q, Zhou F, Liu W M. Chem. Soc. Rev., 2011, 40: 4244-4258
12GAO Ai, WANG YuRu, HE XiWen, YIN XueBo. Chinese J. Anal. Chem., 2012, 40(10): 1471-1476
高 艾, 王玉茹, 何錫文, 尹学博. 分析化学, 2012, 40(10): 1471-1476
13Mondin G, Wisser F M, Leifert A, MohamedNoriega N, Grothe J, Dorfler S, Kaskel S. J. Colloid. Interface Sci., 2013, 411: 187-193
14Wang F, Han R, Liu G T, Chen H F, Ren T R, Yang H F, Wen Y. J. Electroanal. Chem., 2013, 706: 102-107
15Wang L, Guo S J, Dong S J. Electrochem. Commun., 2008, 10: 655-658
16Jin J J, Zheng G Y, Ge Y Y, Deng S G, Liu W, Hui G H. Electrochim. Acta, 2015, 153: 594-601
17Luo J, Zhang H Y, Jiang S S, Jiang J Q, Liu X Y. Microchim. Acta, 2012, 177(34): 485-490
18Yang J, Zhang W D, Gunasekaran S. Biosens. Bioelectron., 2010, 26(1): 279-284
19Jiang D, Liu Q, Wang K, Qian J, Dong X Y, Yang Z T, Du X J, Qiu B J. Biosens. Bioelectron., 2014, 54: 273-278
20Luo J, Jiang S S, Zhang H Y, Jiang J Q, Liu X Y. Anal. Chim. Acta, 2012, 709: 47-53
21Huang T K, Lin K W, Tung S P, Cheng T M, Chang I C, Hsieh Y Z, Lee C Y, Chiu H T. J. Electroanal. Chem., 2009, 636(12): 123-127

