脑科学研究新技术*
杜久林 毕国强 骆清铭 徐富强 方 英 王 琛1 中国科学院上海生命科学研究院神经科学研究所 上海 2000312 中国科学技术大学 合肥 2300263 华中科学技术大学 武汉 4300744 中国科学院武汉物理与数学研究所 武汉 4300715 国家纳米研究中心 北京 1001906 中国科学院脑科学与智能技术卓越创新中心 上海 200031
脑科学研究新技术*
杜久林1,6**毕国强2,6骆清铭3,6徐富强4,6方 英5,6王 琛5,6
1 中国科学院上海生命科学研究院神经科学研究所 上海 200031
2 中国科学技术大学 合肥 230026
3 华中科学技术大学 武汉 430074
4 中国科学院武汉物理与数学研究所 武汉 430071
5 国家纳米研究中心 北京 100190
6 中国科学院脑科学与智能技术卓越创新中心 上海 200031

文章针对目前脑科学的发展需求,就亟需研发的几个关键技术方向——“神经信号新型检测技术”“新型显微成像技术”“神经环路形态追踪和功能操控技术”和“全脑尺度上神经环路重构技术”进行阐述。希望通过国家大型脑科学研究计划的顶层设计,集全国之力量,推动我国脑科学核心技术的研发,为脑科学和交叉科学的发展作出贡献,并打破高端科研仪器长期为欧美垄断的局面。
电极阵列,光学成像,跨突触神经环路示踪,光遗传学,神经环路重构
脑科学研究的关键是要实现对神经元集群活动的实时观察,并通过特定神经环路的结构追踪及其活动操纵,研究其对脑功能的充分性和必要性,进而在全脑尺度上解析神经环路的结构和功能。目前通用的神经电活动观测方法是单通道或多通道微电极。这些方法所能记录到的神经元数量有限,且无法观察到阈下电位的变化。因而,需要从新材料使用、微小化、光电融合、记录与刺激融合等方向着手,研制新型神经电极阵列。除了用电极直接记录神经电信号,近年来荧光成像方法也被广为使用,如在神经元内表达对钙离子敏感的荧光蛋白分子,通过检测因电活动而产生的钙离子浓度的变化来描述电活动。这种光学测量法的优点是可同时观测数百个神经元的电活动,缺点是时间分辨率低(约10-1s)。因此,神经科学界目前高度期望能开发出新一代对细胞膜电位变化敏感、有高信噪比、能分辨单个动作电位(毫秒级)的荧光分子或纳米粒子探针,可以特异性地标记各种类型的神经元,从而实现高时空分辨率、大范围神经元集群电活动的同时检测。同时,神经元功能及其电活动的产生依赖于精细的亚细胞结构,因此需要研发新一代超高分辨率光学显微技术,在活细胞甚至活体动物上观察神经元的精细结构。近年来发展起来了病毒介导的神经环路示踪技术和光遗传学技术,前者可以标记特定的神经元类型和所在的神经环路,后者则可以通过光来控制特定的神经元的活动。为了研究控制特定神经环路的功能,需要将这两种技术有机结合,研发标记和操控多种神经环路的新工具。在上述基础之上,需要研发全脑尺度上的高通量重构技术,在全脑尺度上重现大脑多个神经环路的投射结构和精细联结。下面,逐一阐述上述关键技术的国际现状和未来需求。
1 神经信号的新型检测技术
如何实现高时空分辨率、大范围的神经信号检测是目前神经科学研究的主要技术瓶颈之一。针对这个关键技术问题,有两种解决方案:(1)植入式神经电极,通过神经元动作电位引起电极的电流变化从而实现信号的记录。(2)电压敏感分子和纳米荧光探针,通过动作电位引起分子和纳米粒子荧光信号变化而实现信号的记录。
1.1新型神经电极的设计与应用
金属电极阵列(MEA)是目前商用程度较高的植入式神经电极。然而,金属电极技术具有较低的空间分辨率与生物相容性差等问题。金属电极的热噪声随着器件尺寸的降低而增大,从而制约了其空间分辨率的提高;金属电极与生物组织有着较大的力学差异,使得电极难以实现与脑组织的良好接触,同时易于引起生物体的排异反应,最终导致电极的失效。纳米材料和纳米技术为发展新型的神经电极技术提供了重要机遇。
(1)提高了神经电极的空间分辨率。基于场效应晶体管器件的神经电极能够实现对神经信号的原位放大,对提高神经检测的信噪比有着重要的意义。例如,石墨烯作为一种二维半导体纳米材料,具有高的载流子迁移率、力学强度以及化学稳定性。基于石墨烯晶体管器件的神经电极阵列有望实现对神经信号的高空间分辨率检测[1]。另外,利用石墨烯的高透明度,可以实现对神经组织电信号与光信号的同时采集,从而大大提高神经分析的可靠性。
(2)提高了神经电极的生物相容性及长效稳定性。通过发展超薄的柔性网状神经电极,可实现与脑组织的力学性能相匹配[2]。这种柔性网状电极可以通过针管注射的方式导入到小鼠的脑组织中。5 周后,超薄柔性网状电极与神经元形成了稳定的接触界面,并且不会引起小鼠的免疫排斥反应,为实现对神经信息的长期稳定检测奠定了基础(图 1a)。
1.2新型电压敏感探针的设计与应用
1.2.1电压敏感分子荧光探针
从 20 世纪 80 年代末,科学家就已开始开发检测电压变化的染料和探针。最早开发的是有机荧光染料,其动力学响应较快,但灵敏度低,且普遍具有很强的光毒性,因此无法在活体动物中进行长时间的成像。其后,众多实验室开发出了不同版本的遗传编码电压指示探针(GEVIs),这些电压探针可分为 3 种,部分已可应用于活体动物,如线虫、果蝇、斑马鱼、哺乳类动物等。(1)是将离子通道对电压敏感的区域与荧光蛋白相连,形成一个嵌和蛋白,当细胞膜电压发生改变时,蛋白构象发生变化,从而导致相连荧光蛋白的发射光增强或减弱;这类蛋白本底荧光强,但是其动力学响应较慢(10 毫秒),且反应较小。(2)是近年来开发的基于视紫红质的探针,视紫红质的吸收谱和发射谱对电压非常敏感,当细胞去极化,荧光蛋白的发射光就会减弱,指征电压变化;其特点是动力学响应快,反应大,但其荧光量子效率比绿色荧光蛋白(GFP)低 2—3 个数量级,所以需要更高强度的照明光进行成像。斯坦福大学 Mark Schnitzer 实验室最新开发的电压敏感荧光蛋白就是基于这一原理,响应速度能达到 0.4 ms;并且其结合一个很亮的荧光蛋白,极大地降低了照明光的光强,因此可在活体果蝇及小鼠中检测单个动作电位的发放[3]。(3)可称为混合式电压探针,是将电压敏感有机分子与荧光蛋白相结合;当细胞膜电位发生变化时,带电荷的有机分子会在细胞膜中移动,从而导致相连的荧光蛋白产生荧光共振能量转移效应,改变其荧光亮度[4]。
1.2.2新型电压敏感纳米荧光探针
相对于荧光分子,量子点(Quantum Dot, QD)的荧光强度较高,电压响应较快,并且在光照下有着更好的稳定性。由于其具有其他材料无可比拟的光、声、磁、电、热等特殊性能,QD 在神经科学领域已得到成功应用。例如,借助于量子限制斯塔克效应,QD 可感应神经元单个动作电位[5]。相比于分子或蛋白类电压敏感探针,QD 具有更好的光稳定性。功能纳米颗粒在神经活动远程控制中的作用也日益凸显。近期,研究人员借助于超顺磁性纳米颗粒 Fe3O4在交变磁场下产生的热效应,使神经元中对热敏感的 TRPV1 通道开放,从而达到远程控制大脑神经活动的目的[6]。这种方法不仅对活体组织无害,且不受穿透深度限制。目前,中科院神经科学所正开发基于上转换发光纳米颗粒(Upconversion Nanoparticles,UCNPs)的电压敏感探针。其独特优势在于 UCNPs 可用活体穿透深度较高的近红外光(980 nm)激发。初步研究结果证实,所设计的纳米探针可感应细胞膜电位变化,发光变化幅度明显优于目前任何一种分子或蛋白类电压敏感探针。可以预见未来神经科学家和材料学家的交叉合作有望取得突破。
目前,QD 对电压敏感性的研究尚处于初期,其毒性制约了在活体动物上的应用。为此,一方面亟需提高QD 对神经电位的检测灵敏度。通过将电压敏感结构域与荧光蛋白或化学共价荧光标记蛋白相融合,可以构建遗传编码电压敏感分子探针,实现高灵敏和大动态范围的检测。此外,QD 理论研究表明,动作电位的产生可以引起单一种类半导体 QD(ZnS,CdTe 等)5% 荧光强度的变化以及 1 nm 波长的变化。而采用两种 QD 复合构成的神经探针,荧光强度更是可以在动作电位下发生 30% 的变化(图 1b)。另一方面,通过结合对神经元类型特异膜受体有亲和性的蛋白或多肽,可以实现选择性的神经元标记,从而有利于提高检测的电压灵敏度和特异性。另外还需要克服 QD 的细胞毒性问题。蛋白包被同样是解决这一问题的有效手段。此外,许多科研人员也在尝试采用其他无毒的无机 QD(碳量子点等)。兼顾检测性能与生物相容性的荧光检测无疑是今后的重点研究方向之一。
电压指示探针灵敏度相对较低,对检测设备要求非常高,这也阻碍了其广泛使用。此外,绝大多数探针都是用可见光激发,无法检测深层组织的电压变化。因此,使用红外光激发或者其他材料检测电压变化尤为关键,我们最新开发的基于上转换材料 UCNP 的新型电压探针,其能被 980 nm 激光激发,发射可见光;且具有较好的动力学响应速度,光毒性也大大降低,因此 UCNP 材料用于电压成像可能是一个很好的选择。
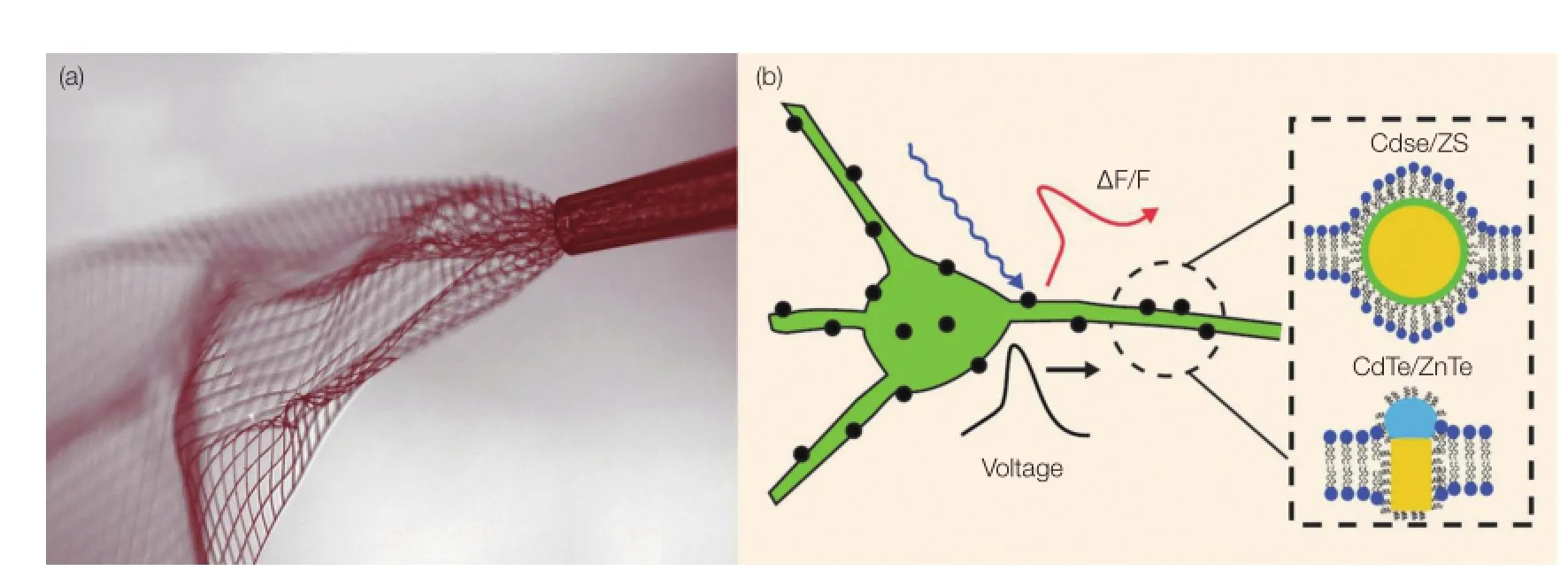
图1 可注射的网状神经电极(a)和半导体量子点检测动作电位的机理(b)
2 新型显微成像技术
正如人们常说的“眼见为实”,从17 世纪英国博物学家罗伯特·胡克通过他自己制作的显微镜发现“细胞”开始,显微成像技术在现代生物学的发展中就一直起着至关重要的推动作用。19 世纪末西班牙病理学家圣地亚哥·拉蒙-卡哈尔通过在显微镜下对大量脑组织样品的细致观察,提出了“神经元学说”,奠定了现代神经生物学的基础。20 世纪中期开始,借助电子显微镜,人们可以观测到神经细胞之间突触联结的精细结构,从而理解神经信息传递的化学本质;同时借助包括共聚焦、双光子成像等各种荧光显微成像技术,人们开始研究大脑组织中大量神经元如何相互连接形成神经环路。而进入 21世纪以来,最新显微成像技术的发展以及其与信息计算技术的融合,产生了包括超高分辨率光学显微和冷冻电镜成像等超微纳米成像技术以及包括光片照明显微等可用于活体神经网络活动研究的高速体成像方法,突破了传统技术在空间和时间分辨率的极限。基于这些仍在快速发展中的新技术手段,神经生物学家对大脑的观测进入了从突触到全脑,跨越多个尺度的“联结组学”时代。
2.1前沿电子显微技术
神经突触一般只有不到 1μm3大小,却是大脑神经环路联结体系的基本计算单元,执行信息传递加工等关键功能,其可塑性变化是学习、记忆等各种高级脑功能的物质基础,而其结构功能异常则是抑郁症、精神分裂症、老年性痴呆等各种精神、神经疾病的根源。因此,对突触内部超微结构的解析是理解突触乃至神经环路功能与疾病机制的关键所在。几十年来,电子显微镜以其纳米水平的分辨率一直是这一微观尺度研究的重要工具。而最近几年来,最新的冷冻电子显微技术,包括电镜三维断层成像及单颗粒三维重构,通过结合快速冷冻对样品的保存和高性能计算突破了常规电子显微镜的局限,可以对亚细胞超微结构乃至蛋白质大分子复合物进行极高分辨率的解析。美国加州大学洛杉矶分校周正洪、旧金山分校程亦凡等华人科学家均是这一领域的先驱。利用单颗粒三维重构,清华大学等单位率先解析了与老年性痴呆相关的神经突触蛋白 γ 分泌酶复合物的原子分辨率三维结构。利用冷冻电镜断层成像技术结合自主研制的光学-电子关联显微装置和算法,中国科学技术大学等单位首先解析了完整的神经突触在接近生理状态下的高分辨三维超微结构,可以直接观测到特定种类突触上单个蛋白分子复合物的形态和准确定位(图 2)。这些方法的进一步发展,可望实现对神经突触的“终极”定量解析与表征。
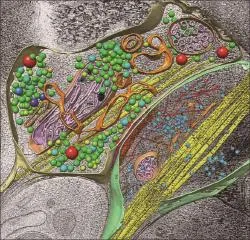
图2 神经突触的冷冻电镜三维断层重构
在百微米尺度上,近几年发展高通量扫描电子显微技术成为了解析由多个神经元联结构成的神经微环路的重要工具。通过不同方式的连续切片和电子扫描成像,德国马普研究所和美国哈佛大学等单位先后实现了对小鼠视网膜中以及脑皮层中微环路的完整解析。这种针对大脑神经环路进行反向工程的微环路解析除了自动超薄切片与电镜成像的硬件技术外,对电镜图像的分析、识别和三维重建也极具挑战。中科院自动化所等单位在这一领域已经具有很好的积累,目前也在与中国科学技术大学等单位合作发展光电关联环路重建技术。
2.2超高分辨光学显微技术
与电子显微技术相比,光学显微特别是荧光显微方法具有更高的灵敏度和特异性,从而可用于解析特定分子组成的表达与分布以及特定细胞或亚细胞结构的识别与分类,同时光学显微可以用于活细胞成像,这些优点对有效解析神经突触和环路的结构功能至关重要。但一般情况下,光学显微受衍射极限的限制,只能达到亚微米级(数百纳米)的分辨率,这显然不足以清楚解析同样亚微米尺度的神经突触内部细微结构及其病理变化。最新发展的超微光学成像技术利用受激辐射耗尽(STED)以及单分子定位重构(PALM/STORM)等方法突破了光学衍射的限制,达到了数十纳米的分辨率,美国科学家埃里克·白兹格和威廉·莫尔纳以及德国科学家斯蒂芬·黑尔等为此获得 2014 年诺贝尔奖化学奖。美国华人科学家庄小威也是这一领域的先驱者,并首先将此技术应用于神经突触的超微结构以及对单个神经元输入联结组的完全解析。
我国科学家也在超高分辨光学成像技术方面开展了创新性工作,中国科学技术大学、中科院生物物理所、北京大学等单位研发了超高分辨光学成像的分子探针,实现了亚细胞区室与细胞器的活细胞动态超微成像,并利用 STORM 技术解析了神经突触的不同类型。这一技术在组织样品尺度方面有进一步发展,通过与电子显微技术和计算技术的结合,有可能成为下一代神经环路反向工程的新的突破口,也是中科院脑科学与智能技术卓越创新中心和中科院脑功能联结图谱先导专项中技术研究团队的一个重要方向。
2.3宽场照明成像技术
脑功能往往涉及全脑范围内大量神经元的协同运作,探究其机制需要快速大规模的神经活动记录。光学成像方法结合能够报告神经元活动水平的荧光染料和蛋白,可以同时观察成百上千个神经元,在过去 10 多年中取得了若干重要成果。然而,受逐点采集的原理限制,通行的双光子成像和共聚焦成像每秒只能采集数帧,远不足以观察精细的神经活动,更难以研究三维空间中的集群活动。近来发展的光片照明成像技术,同时激发整个成像平面的荧光蛋白,又具有良好的轴向分辨率,结合灵敏的荧光相机,可以实现 100 Hz 的神经活动成像,再辅以轴向扫描则可记录三维神经元集群的活动[7]。光场成像技术采用传统照明激发三维空间内的荧光分子,通过微小透镜阵列和数据重建分离不同深度的荧光信息,从而同步采集三维空间中的神经元活动。这些宽场成像方法尤其适于研究小巧透明的实验对象,如斑马鱼幼鱼。斑马鱼具有与高等脊椎动物类似的神经系统,在1周龄已表现出多种复杂行为,但其大脑相对较小,通过透明的皮肤可清楚分辨其中的数十万个神经元,从而实现全脑尺度上神经元活动的光学记录,同时也可以释放其眼睛或尾部来观察感觉刺激所引起的运动。此外,作为重要的模式动物,斑马鱼适合各种遗传学操作,使得可以编辑特定基因及其表达,标记特定的神经元类型和集群,藉此在行为过程中监测记录全脑神经元的活动,通过光遗传学方法操纵参与特定功能的神经元集群的活动并标记其形态和联系特征,实现神经活动记录、操纵与精细结构成像的有机结合,从而实现解析整个神经系统工作原理(图3)[8]。
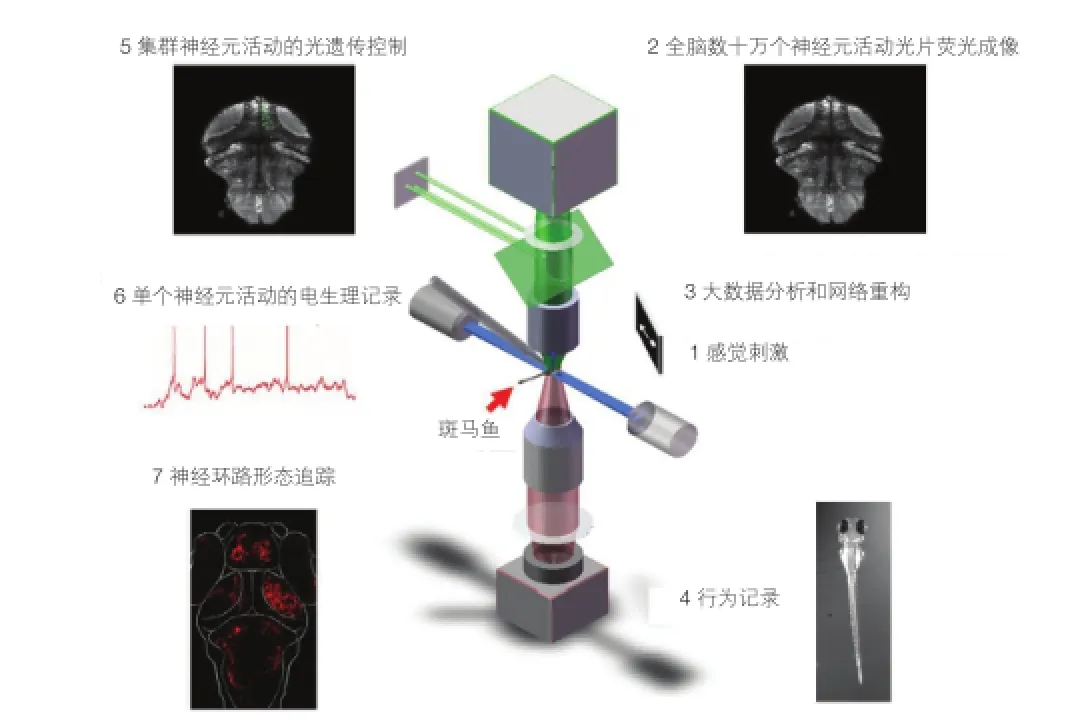
图3 斑马鱼全脑神经元活动检测和操控技术示意图
3 神经环路追踪和光遗传学
神经环路的复杂性是由神经细胞种类的复杂、不同种类神经细胞电生理特征的复杂和不同脑区的不同种类神经细胞连接模式的复杂决定的。因此,如果希望在细胞层次上研究和认识脑功能,就必须结合分子标记和示踪、细胞操纵和干扰等方法、针对特定细胞给予标记。光遗传学神经调控技术是整合了光学、基因工程、电生理以及电子工程的一种全新的多学科交叉的生物技术。其主要原理是首先采用基因技术将光感基因转入到神经系统中特定类型的细胞中进行表达,使其在细胞膜上形成特殊的离子通道。这些离子通道在不同波长的光照刺激下达到对细胞选择性地兴奋或者抑制的目的,从而可以对特定细胞类型的神经通路进行毫秒级精准的开启或者关闭。嗜神经病毒是神经环路结构和功能研究中的新生力量,具有以下特点和优势:种类繁多;可以跨突触传播;跨突触方向可控,可特异顺行或逆行传播;病毒跨突触后可复制,信号不衰减;可携带多种标示物;可结合已有的数百种 cre- 动物品系,对特定类型细胞的神经环路进行高灵敏的可视化。
光遗传学技术在短短 10 年已经成为了神经环路解析最重要的技术,被广泛应用到神经科学研究之中,同时因为此技术的高时空精准、细胞特异性的优势,可应用此技术针对疾病的研究,包括失明、焦虑、瘫痪等,国外已经逐步在向临床应用转化的方向推动。此方面技术的瓶颈主要是可能应用到人体的整体技术的优化和商业开发。其次,作为一种在实验室中重要的生物技术,目前针对脑科学的研究已经不可或缺,但是,应用此技术展开脑功能解析的综合研究仪器,例如整合光遗传、电生理技术、光学成像和大脑磁共振的仪器设备等至今没有商业产品,许多都依赖实验室自己的搭建,大多只能满足单一的实验需求。因此,基于光遗传技术、细胞分辨、高时空精准神经环路功能调控的整套实验技术、装置和设备的革新可以预期将伴随着高质量的研究成果和对产业的推动。载体病毒的感染和传播机制不清,限制新系统的设计;毒力普遍需弱化,方可广泛用于长期跟踪研究;侵入位点、传播方向和跨突触级数等的可控性有待提高以获得更特异的结构信息;结构示踪与功能研究的兼容性和确定执行特定功能的环路方面尚无工具化的示踪体系;对缺乏 cre- 品系的众多物种包括大鼠、树鼩和非人灵长类缺乏细胞类型特异的标记手段。
目前国际上常用于神经环路示踪系统,主要是可分为3大类:(1)疱疹病毒科的伪狂犬病毒和单纯疱疹病毒;(2)弹状病毒科的狂犬病毒和水疱炎病毒;(3)限制跨突触病毒感染和传播范围的辅助病毒,包括腺相关病毒、逆转录病毒和慢病毒等。基于这些病毒的结构、感染及复制特性,利用反向遗传学及同源重组等手段,筛选和改造病毒,减弱毒力,插入荧光蛋白等外源基因,初步满足逆向跨单突触和多突触、正向跨多突触传播的示踪系统,成为神经环路研究的有力工具。我国对神经环路示踪技术的研究于 2008 年始自中科院武汉物理与数学所,早期的跟踪性研究获得了国际权威 L. Enquist 和 E. Callaway 的无私支持,2012 年之后在自然科学基金委“情感与记忆神经环路”和中科院战略先导“脑功能联结图谱”等专项及科技部“973”计划的支持下,建立了国际上几乎所有具有使用价值的体系,发展了在灵敏度、标识物和宿主多样性、稳定性、安全性、病毒毒力等方面更优越的 100 多种新型示踪系统(图 4),并为国内外科研院所广泛应用[9,10]。但大多数所建立的,包括结构与功能研究兼顾的体系,与大多文献报道类似,尚需相当努力使之工具化。
光遗传学技术在国内近几年的发展得到了包括自然科学基金委、科技部以及中科院一些项目的支持。但是,相比美国等国家针对此技术方向的支持力度,差距巨大。国内团队在光刺激多通道电生理记录技术、光遗传学单细胞水平调控技术研发以及应用此技术解析特定神经环路功能等方面取得了一些重要的进展。依托中科院深圳先进技术院已经建立了功能完善的光遗传技术研发、应用和技术资源共享平台,基于国内平台的研发工作,拥有自主知识产权的光遗传及其相关技术已经获批 30 余件核心专利;同时此技术体系由中科院深圳先进技术院辐射到境内外 230 余家实验室,在短期内极大地整体上提升了国内科研机构在国际此领域的竞争力。
目前,需针对性地加强所涉及病毒与宿主相互作用的机理研究,从而设计出极弱毒力的、侵入位点、传播方向和跨突触级数可控的、高灵敏和灵活的、适于不同物种(尤其是非人灵长类)、兼顾结构示踪与功能研究的、细胞和突触类别特异的、可标识执行特定功能的、不依赖于 cre- 品系的神经环路示踪工具库。强化标记体系的工具化和工业化,建立全国性支撑服务平台,全面推动脑科学的发展。目前国内光遗传学相关技术与国际同领域技术基本保持同步。光遗传技术和多种脑功能解析技术的整合,例如电生理、脑功能成像、光学成像等,需要整合国内优势团队协同攻关。国外至今也尚无此类研究手段。建议基于国内已经获得自主知识产权的核心技术,拓展应用,并充分利用国内学科交叉、协同攻关的工作模式:(1)研发基于光遗传技术的脑功能解析手段和科研装置;(2)运用此技术,针对我国已经取得进展的研究领域,例如本能行为神经环路功能解析、精神疾病的病理性神经环路解析、特定脑功能图谱的解析等;(3)是光遗传技术的科研产业化推动以及针对疾病治疗的临床前研究、技术储备等,为未来可能的临床应用奠定基础。
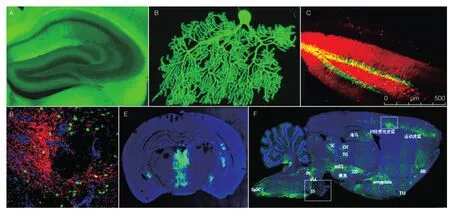
图4 活体脑细胞和神经环路的病毒标记示例
4 神经环路重构
人脑中有约 1011个分子类型特异的神经元,它们通过约 1014个突触彼此相互交织形成神经信息传递、处理和整合的立体神经环路。解析神经环路的结构与功能是阐明高级脑功能机理的前提和基础,这需要首先明确构成环路的神经元类型以及在单神经元水平构建跨脑区的环路结构。国际科学界高度重视神经环路结构的构建,2013年美国发起了“创新性神经技术推动的脑研究”,并将确定神经细胞类型和建立大脑精细结构图作为前两项重点研究的内容,而其他研究均需要以这两项为基础,这充分显示出在介观层面解析神经环路之于脑研究的重要性和迫切性。
近年来,借助于小鼠的转基因技术、神经标记技术迅猛发展,为构建小鼠脑神经环路及绘制连接图谱提供了丰富的动物模型资源。面向小鼠的全脑光学显微成像技术也应运而生,它们突破光学成像深度限制,足以获取厘米见方的神经环路结构信息[11]。其中,由华中科技大学自主研发的显微光学切片断层成像(Micro-Optical Sectioning Tomography, MOST)系列技术[11,12],在国际上首次获得了体素分辨率为 1 μm 的小鼠全脑连续三维结构数据集,并首次展示了小鼠全脑内长距离轴突投射通路的连续追踪(图 5)。正是基于上述技术领域的进步,美国 Allen 脑科学研究所已经重建出一套体素分辨率 100 μm 的脑区水平的小鼠脑连接图谱,但还未达到单神经元分辨水平。
尽管鼠脑研究方兴未艾,但为了更有效地揭示人类脑疾病发生发展过程,理解人脑高级功能机制,开展与人类亲缘关系更密切的非人灵长类动物脑研究的重要性日益凸显。我国在非人灵长类的神经环路研究中具有得天独厚的优势,拥有丰富的非人灵长类动物资源,中科院脑科学和智能技术卓越中心已经在全国建立了多个非人灵长类脑功能的研究平台,猕猴转基因技术亦处于国际领先。相比之下,欧美国家受到了资源、伦理、政策等因素的制约,相关研究日益衰退。我国有望抓住这一历史机遇,在非人灵长类神经环路研究方面取得突破,在脑科学竞争的国际舞台抢占先机。但是,猕猴的脑容量约为小鼠脑的 90 倍,研究难度远大于小鼠脑。为了构建非人灵长类大脑神经环路,需要在样本标记与制备、大样本高分辨率成像技术、大数据处理与分析等方面进行系统性、多学科的协同攻关,才有望取得突破。
与鼠脑研究相比,高质量的非人灵长类动物模型还十分匮乏。不仅是因为灵长类动物繁育周期长,在小鼠等低等动物中已十分成熟的分子遗传学方法、实验手段,大多难以直接、甚至完全不能应用于非人灵长类等高等模式动物。而且,在大体积脑组织中荧光标记物(如病毒)和包埋固定物质如何能快速均匀渗透,如何提高样本质量的稳定性和持久性等都是亟待解决的技术难题。
如何建立单细胞分辨的非人灵长类动物全脑数据获取的光学显微成像技术是又一大技术难题。现有技术以0.5 μm3精度扫描完整小鼠脑大约需要 3—10 天,若对灵长类全脑范围进行成像则需数月时间,时间成本巨大,无法满足生物学统计性的样本量需求。而且,现有成像仪器、关键器件难以胜任连续数月的工作强度。因此,需要从成像原理、核心器件、采集策略上求得突破,开发出高通量、高精度,适用于非人灵长类大脑的下一代全脑成像技术。
解决了获取数据的问题之后,非人灵长类全脑图像大数据的处理分析必将是下一个瓶颈。根据最新的研究报道,国际上刚刚初步解决了小鼠全脑数据集的计算问题,数据处理能力低于 10 TB。非人灵长类全脑数据集的数据量将达到百 TB,甚至 PB,这对计算和存储的体系结构,以及软件技术都提出了巨大挑战。此外,鼠脑研究中仍然将人工追踪作为神经元形态重建的金标准,照此推算重建非人灵长类大脑百亿级神经元规模的神经环路大约需要 3 000 万人同时工作一年。因此,利用人工智能技术实现脑内信息的全自动识别必将是未来重要的发展方向。
综上所述,非人灵长类动物全脑神经环路的构建是极具挑战的前沿研究,它涉及生物医学、信息、物理、化学、数学、材料、控制等多个学科,需要从基础到临床、从科学到工程多个方面,共同围绕脑科学本身的需求与问题展开研究,这将是我国脑计划实施中亟待协同攻关的技术瓶颈。
5 发展建议
脑科学是未来若干年自然科学领域国际竞争的焦点,抢占国际制高点的关键是整合交叉学科力量,加速研发新技术,并前瞻性地部署未来技术。(1)要充分发挥中科院在相关学科方向的优势力量,通过顶层设计,与脑科学具体研究和需求结合,研制新型研究技术和体系。(2)建立跨学科、跨单位的双学位研究生体系,培养脑科学和其他交叉学科的复合型人才,为未来的技术发展培养和储备人才。(3)要通过针对性的研讨,积极思考和部署未来不可预见的技术方向。通过脑科学研究新技术的研发,不仅推动脑科学的发展,也将带动其他交叉学科的进步。
1 Cheng Z, Hou J, Zhou Q, et al. Sensitivity limits and scaling of bioelectronic graphene transducers. Nano Letters, 2013, 13(6): 2902-2907.
2 Liu J, Fu T, Cheng Z, et al. Syringe-injectable electronics. Nature Nanotechnology, 2015, 10(7): 629-636.
3 Gong Y, Huang C, Li J Z, et al. High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science, 2015, 350(6266): 1361-1366.
4 Storace D, Sepehri Rad M, Kang B, et al. Toward better genetically encoded sensors of membrane potential. Trends Neurosci. 2016, 39(5): 277-289.
5 Rowland C E, Susumu K, Stewart M H, et al. Electric field modulation of semiconductor quantum dot photoluminescence: insights into the design of robust voltage-sensitive cellular imaging probes. Nano Letters, 2015, 15 (10): 6848-6854.
6 Chen R, Romero G, Christiansen M G, et al. Wireless magnetothermal deep brain stimulation. Science, 2015,347(6229): 1477-1480.
7 Keller P, Ahrens M. Visualizing whole-brain activity and development at the single-cell level using light-sheet microscopy. Neuron, 2015, 85(3): 462-483.
8 Shang C F, Mu Y, Du, J L. Zebrafish swimming in neuroscience research: a visible mind in a transparent brain. Science in China: Life Science, 2015, 45(3): 223-236.
9 Wei P, Liu N, Zhang Z, et al. Processing of visually evoked innate fear by a non-canonical thalamic pathway. Nat Commun,2015, 6: 6756-6768.
10 Yang H, Yang J, Xi W, et al. Laterodorsal tegmentum interneuron subtypes oppositely regulate olfactory cue-induced innate fear. Nat Neurosci, 2016, 19(2): 283-289.
11 Li A, Gong H, Zhang B, et al. Micro-optical sectioning tomography to obtain a high-resolution atlas of the mouse brain. Science, 2010, 330(6009): 1404-1408.
12 Quan T, Zhou H, Li J, et al. NeuroGPS-Tree: automatic reconstruction of large-scale neuronal populations with dense neurites. Nat Meth, 2016, 13(1): 51-54.
杜久林中科院神经科学所研究员、所长助理,中科院脑科学与智能技术卓越创新中心副主任,神经科学国家重点实验室副主任。国家“杰出”青年基金、中科院“百人计划”、中青年科技创新领军人才等获得者;曾获上海市自然科学牡丹奖、张香桐神经科学青年科学家奖、明治生命科学奖、上海市自然科学奖一等奖(第二完成人)、中国高校自然科学奖一等奖(第二完成人)等。1993 年本科毕业于中国科技大学;1998 年博士毕业于中科院上海生理所;1999—2000 年任上海生理所助理研究员;2002 年任复旦大学副教授;曾在日本东京大学(2000—2001年)和美国加州大学伯克利分校(2002—2005 年)从事博士后研究;2006 年起任中科院上海生科院神经科学所课题组长。创建多项国际领先的斑马鱼在体研究技术,从突触—神经元—神经环路—行为的研究策略出发,以视觉系统为切入点,研究感觉-运动的神经机制以及神经调质系统的功能,提出“Bi-Pathway Hypothesis for Behavior Generation”,阐述动物产生适应性行为的神经机制;同时拓展交叉研究方向,探索脑血管网络和血脑屏障的发育机制及其神经调节。研究成果主要发表在 Neuron、Developmental Cell、PLoS Biology、Circulation Research 等学术期刊上。E-mail: forestdu@ion.ac.cn
Du Jiulin Senior Investigator and Assistant Director of Institute of Neuroscience (ION), Chinese Academy of Sciences (CAS), and Deputy Director of CAS Center for Excellence for Brain Science & Intelligence Technology and State Key Laboratory of Neuroscience. He is a winner of National Outstanding Young Scientist Award, National Youth Science and Technology Innovation Talents, CAS Hundred Talents Award, and Hsiang-Tung Chang Outstanding Young Neuroscientist Award. He obtained B.S. degree from University of Science & Technology of China in 1993 and Ph.D. degree from Shanghai Institute of Physiology, CAS in 1998, and then did Postdoc studies at Tokyo University and UC Berkeley. He joined ION at 2006 as a PI. His laboratory has developed several novel innovative in vivo methods for zebrafish research, including wholecell recording, intron-based knockin, dopamine release monitoring, and 3-dimensional brain vasculature reconstruction and analysis. He has performed series study on neural circuit mechanisms underlying visuomotor transformation and adaptive behavior generation, and proposed the Bi-Pathway Hypothesis for Behavior Generation. Original research papers have been published on Neuron, Developmental Cell, PLoS Biology,Circulation Research, and so on. E-mail: forestdu@ion.ac.cn
Developing Novel Techniques for Brain Science Research
Du Jiulin1,6Bi Guoqiang2,6Luo Qingming3,6Xu Fuqiang4,6Fang Ying5,6Wang Chen5,6
(1 Institute of Neuroscience, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences,Shanghai 200031, China;2 University of Science and Technology of China, Hefei 230026, China;3 Huazhong University of Science and Technology, Wuhan 430074, China;4 Institute of Physics and Mathematics, Chinese Academy of Sciences, Wuhan 430071, China;5 National Center for Nanoscience and Technology, Beijing 100190, China;6 Center for Excellence in Brain Science and Intelligence Technology, Chinese Academy of Sciences, Shanghai 200031, China)
The progress of brain science research requires the application of inter-discipline techniques, and in turn promotes the developmentof the latter. In the highly competitive international Brain Research Project, the first priority is to develop new techniques. This review focuses on why and how we are going to tackle several crucial techniques, including measurement of neural signals, optic imaging of neural signals and structures, combination of tans-synaptic tracing and optogenetics, and large-scale re-construction of neural circuits. Through the state-of-the-art design of national brain research-relevant major projects, we can integrate national research efforts and make a breakthrough in this field in the coming future.
microelectrode array, optic imaging, trans-synaptic neural circuit tracing, optogenetics, neural circuit re-construction
10.16418/j.issn.1000-3045.2016.07.007
* 资助项目:中科院战略性先导科技专项项目(B类)(XDB0200000)
** 通讯作者
修改稿收到日期:2016年6 月10日

