非人灵长类模型*
胡新天 仇子龙 顾 勇 龚 能 孙 强 中国科学院昆明动物研究所 昆明 6503 中国科学院上海生命科学研究院神经科学研究所 上海 0003
非人灵长类模型*
胡新天1仇子龙2**顾 勇2龚 能2孙 强2
1 中国科学院昆明动物研究所 昆明 650223
2 中国科学院上海生命科学研究院神经科学研究所 上海 200031

全球有近 10 亿脑疾病患者,每年约带来经济负担 1 万亿美元。目前,绝大部分脑疾病尚无有效治疗方法。因此,脑疾病机理研究和新药开发十分迫切。由于进化上相近,非人灵长类的脑在结构、功能活动等多方面与人类高度相似。因此,相对于其他实验动物,非人灵长类具有解决人类问题,特别是脑相关问题的独特优势。它们除了是研究人类正常脑高级功能的关键实验动物外,还是最好的研究脑疾病机理和治疗方法的模型动物。中国不但有丰富的非人灵长类资源,而且在猕猴建模方面有很好的积累,尤其在转基因疾病猕猴模型创建方面,目前处于世界领先的地位。文章分析了脑疾病领域的国家战略需求,总结了国内外非人灵长类的应用情况,以及国内非人灵长类模型现状。在此基础上,对我国非人灵长类模型领域下一步发展的重点提出了建议。
脑疾病,非人灵长类,动物模型
1 非人灵长类
灵长类动物是动物界最高等的类群,共有11科 51 属 180 种,其中包括猴、猿等,还有最后发展出的人类。由于具有动物界中最发达的大脑,它们除了有很高的智力和复杂的社会行为外,在运动方面,大拇指灵活,能与其他指对握。这一指间“对握”是灵长类种属特征,赋予它们高度灵活精巧的手指抓握功能。在感觉方面,在其他哺乳动物严重依靠嗅觉、触觉时,灵长类则发展出了高级视觉系统,是少数具有三色视觉(能看到三种颜色)的物种,因此具有丰富的视觉感知和强大的物体分辨能力。顾名思义,非人灵长类是除人以外的灵长类动物,由于具有许多与人类相似的生物学特征,它们是很重要的实验动物。在研究工作中,使用量最多的是旧大陆猴,其中以猕猴、食蟹猴为主。由于进化上的相近,猕猴基因序列有 93% 与人相同,与之相对,鼠是 84%。因此,相比其他实验动物,非人灵长类具有解决人类问题,特别是脑相关问题的独特优势:除了是研究人类正常脑高级功能的关键实验动物外,它们还是极佳的研究脑疾病机理和治疗方法的模型动物。
2 脑疾病需要非人灵长类疾病模型
目前,全球有近 10 亿脑疾病患者,带来的经济负担每年约 1 万亿美元。在我国,精神疾病方面,目前儿童自闭症患者数达 164 万;全国精神分裂症患者约 1 600 万人,抑郁症患者超过 2 600 万。而与我国快速发展的老龄化过程密切相关的神经退行性疾病,如:老年痴呆病患者数量达 900 万,并以每 10 年翻一番的速度递增;我国帕金森病患者已超过 300 万,已成为帕金森病患者最多的国家。目前,绝大部分脑疾病尚无有效治疗方法,因此,脑疾病研究和新药开发十分迫切。
由于社会伦理和道德的制约,人类健康和医药的研究都离不开动物模型。而缺乏理想的动物模型是脑疾病机理研究和药物开发的重要瓶颈,因为目前广泛应用的鼠类动物模型有很大的局限性:在进化上,相对于人和猴在 2 000 万年前的分离,人和鼠 1 亿年前就已分开,其后果是造成了鼠类和人在脑结构和功能上有巨大差别。用鼠类建模时,人类脑疾病的复杂症状往往很难得到忠实的体现。例如,神经退行性疾病老年痴呆症以及帕金森病,在携带人类基因突变的转基因小鼠中虽然也有类似的认知表型,但是却极少看到在人类病患大脑中的神经元死亡症状,因此无法在小鼠疾病模型中筛选相关药物来缓解神经元死亡等症状。由于这种差异,大量在鼠类上有效的药物在临床试验中失败。其中影响最大的就是最近美国两大著名医药公司辉瑞和强生的抗老年痴呆症新药抗 Aβ 的单克隆抗体 Bapineuzumab 在进入 III 期临床试验后因无明显治疗效果,且出现血管性脑水肿、脑沟积液等不良反应宣告失败;另一个老年痴呆症新药,也是美国知名医药公司礼来开发的抗 Aβ 的单克隆抗体Solanezumab 则因无明显治疗效果宣布失败。这一现象已经引起了广泛重视与反思,2014 年,有国外学者在 Nature 上撰文“误导性的小鼠研究浪费了医疗资源”(图 1)。

图1 误导性的小鼠研究浪费了医疗资源
总之,一个尴尬的事实是,人类花费了大量金钱和精力进行脑疾病机理研究和新药开发,出来的却是鼠的脑机理和药物,导致国际各大药厂纷纷退出这一领域。如何突破这一“老鼠药”的局面呢?
由于进化上相近,非人灵长类的脑结构、生理活动等很多方面与人类高度相似,是目前脑疾病模型的理想建模动物。利用其创建的人类疾病模型,比其他模式动物能更好地复制人类疾病,特别是神经性疾病的特征,同时也能更好地模拟疾病的机制和病理进程。更为重要的是,由于其发达的中枢系统,非人灵长类有复杂的认知和社会行为、精巧的运动控制,可以完成与人相似的记忆任务,这对于客观评价情感和社会认知、记忆能力和精细运动等脑疾病相关核心行为指标尤为重要。因此,利用非人灵长类建立脑疾病动物模型,将能极大地降低新药研发失败风险,是跨越基础和临床研究之间必要的、有时甚至是唯一的桥梁。
3 非人灵长类国内外应用现状
国际上很早就对非人灵长类非常重视,美国、德国、日本、新西兰、韩国、泰国和印度等国家,已建立了供生命医学研究用的灵长类饲养和实验中心,总数达 70 余个。但由于动物资源稀缺、动物保护主义者反对等多种原因,进展缓慢。除此之外,在目前经济不景气的大环境下,猕猴使用成本(猕猴在美国的购买和饲养成本是中国的 4—6 倍)的居高不下也使欧美非人灵长类的研究雪上加霜。据统计,在 2008—2011 年间,欧洲非人灵长类研究下降 28%。 2015 年 5 月,美国哈佛医学院关闭了它的灵长类中心。
相反,我国是世界上野生灵长类动物分布较为丰富的国家,拥有灵长类动物 24 种,约占全球灵长类物种的 10%。近年来,随着生命科学研究以及转化医学研究的快速发展,灵长类动物饲养繁殖得到迅速发展,仅云南、广东、广西和苏州等地的猴养殖场就达到 20 余个,人工养殖存栏数达到 30 余万只。国家对非人灵长类在脑及其相关疾病研究中的意义也十分重视,在即将实施的“中国脑计划”中,以猕猴为模式动物的脑功能和疾病研究将会占有突出地位。国家自然科学基金委动物模型项目近年来也偏向支持非人灵长类疾病模型的构建。2016 年,国家又批准了非人灵长类大科学装置,将在云南昆明建立一个管理规范、设备先进、集灵长类模式动物培育、表型与遗传分析研究于一体的,规模化、标准化、智能化、精确化、集成化、自动化的大型研究设施。
在国内众多的研究机构中,中科院对非人灵长类历来比较重视,有传统也有优势。早在 1959 年,中科院在昆明动物所建立了我国第一个灵长类动物人工驯养繁殖中心,并于 2008 年 10 月通过国际权威组织 AAALAC(国际实验动物评估和认证委员会)认证,饲养繁殖和使用都达到了国际水平。它是国内饲养繁殖灵长类动物种类最多,研究历史最长的机构之一。在此基础上,近年来,鉴于非人灵长类在生物医学领域的重要性日益凸显,中科院又在上海、北京和深圳等地建立了多个基地。
结合国家的战略布局需求,经过多年的建设和发展,我国非人灵长类研究形成了特色鲜明、局部国际领先的良好局面,在国内外形成了广泛的影响。其中,我们关于灵长类实验动物的研究得到国际著名杂志 Nature 和 Cell 等的专题报道[1]。
面对如此形势,已有国外学者担忧,如此发展下去,将来中国可能在世界药物筛选科研领域形成垄断,到时全球药物的药效学评价都得到中国来[1]。这一担忧从另一个方面证明灵长类研究能力的提升将极大地提升我国健康领域生命科学与生物医药产业技术的自主创新能力。
4 国内脑疾病非人灵长类疾病模型现状
我国有丰富的灵长类动物资源,但是只有把它们转化为相应的脑疾病模型后,才能将这巨大的潜力转化为能力、实力来造福患者。目前常用的脑疾病模型可分为自发模型、转基因模型和诱发模型3类。由于目前国内外尚无公认的自发脑疾病模型,本文只介绍国内转基因模型和诱发模型的发展情况。
4.1转基因模型
人类利用非人灵长类对脑功能和脑疾病进行研究已有多年的历史,以前也有猕猴转基因成功的报道,但为什么近几年才引起了国内外的高度重视呢?例如,日本已启动的脑计划就是以狨猴为基础来设计和实施的。其主要原因是猕猴转基因技术有了重大突破。近年来高效快速的基因打靶方法层出不穷,出现了一系列可在受精卵水平高效基因敲除的系统如 TALEN 及 CRISPR/Cas9 方法等,使猕猴基因精确编辑成为可能。这一重要前景,引起了国内外多个团队的注意和竞争。通过密切协作,我国科学家团队目前已成功将这两项技术首次应用到猕猴上[2-4]。此项技术的成功,使得我国成为世界上少数可以开展人类重大疾病的非人灵长类转基因动物模型的国家,将我国的非人灵长类基因编辑与基因工程工作提升到世界领先水平。
在此基础上,近年来国内非人灵长类脑疾病模型进展很快,2014 年,国内 2 个独立团队在世界上首先成功构建了神经发育性疾病瑞特综合症相关基因 MECP2 的基因敲除食蟹猴,为进一步研究神经发育性疾病的神经机理提供了重要的动物模型。2015 年,另一个团队利用CRISPR/Cas9 基因编辑方法构建了杜氏肌营养不良 DMD基因突变的非人灵长类动物模型,为进一步研究 DMD 基因突变的临床干预方法提供了可能。他们还应用慢病毒转基因方法构建了帕金森病转基因非人灵长类模型。此转基因模型表达人类帕金森病致病基因 alphasynuclein 基因突变,携带此突变的转基因猴表现出一定程度的认知功能障碍,转基因猴脑内也出现类似人类帕金森病病人的病变。2016 年 1 月Nature 期刊在线发表了题为“MECP2 转基因猴的类自闭症行为表征与种系传递”的研究论文,该研究由中科院上海生命科学院神经科学研究团队合作完成。该研究通过构建携带人类自闭症基因MECP2 的转基因猕猴模型及对转基因猴进行分子遗传学与行为学分析,发现 MECP2 转基因猕猴表现出类似人类自闭症的刻板行为与社交障碍等行为。研究团队还通过精巢异体移植的方法,成功得到了携带人类 MECP2 基因的第二代转基因猕猴,且发现其在社交行为方面表现出了与亲代相同的类自闭症表型(图 2)。此研究是世界首个自闭症的非人灵长类模型,为深入研究自闭症的病理与探索可能的治疗干预方法提供了重要基础。以上系列模型的成功建立,进一步扩大了我国在转基因非人灵长类转基因模型方面的世界领先地位[5-8]。

图2 我国科学家在国际上首先构建成功的人类自闭症转基因猕猴模型
4.2诱导模型
由于关键技术的突破,非人灵长类脑疾病转基因模型迎来了黄金时代,在今后的神经精神疾病研究中将大放异彩。但是,由于每个生命个体都是环境和基因相互作用的结果,除少数遗传因素占主导的疾病外,大多数疾病的发病原因也常常是环境和基因二者兼有。例如,排名神经退行性疾病第一和第二位的老年痴呆症、帕金森病,基因异常造成的只占不到 10%,其余可能与环境因素有关。在抑郁症中,目前甚至尚未找到很明确的风险基因。因此,随着基因与疾病的关系日益清晰,找到这些疾病的环境诱发因素,再利用它们来诱导动物产生相关疾病的建模方法也引起了国内外科学家的重视。同样,在这一建模策略中,非人灵长类也有巨大的优势:由于大小鼠的生活环境、代谢和生理过程与人差别很大,已有证据表明,人的风险因素不一定能在啮齿类上诱导出相应的疾病来。我国的研究团队长期致力于这方面的工作,并在环境因素诱导老年痴呆症、抑郁症猕猴模型等方面取得重要进展。
4.2.1老年痴呆症模型
流行病学调查表明,年龄增加是老年痴呆症的最重要风险因素。但是,体内随着年龄变化的因素很多,到底是什么因素起了主要作用呢?甲醛是脑内的一种正常代谢产物,它在脑内的浓度随着年龄而增加,而老年痴呆症患者体内的甲醛浓度要高于同龄的对照。体外实验表明,它能导致 Tau 蛋白过度磷酸化和 aβ 聚集,是神经纤维缠结和老年斑这两个老年痴呆症典型病理症状的前期表型(图 3)。因此,甲醛有可能是老年痴呆症的一种自然诱导因子。通过长期低剂量颅内注射来增加脑内甲醛,以模拟甲醛随年龄变化的现象,猕猴出现了老年痴呆症所有关键症状:功能上,记忆长期稳定下降;病理上,出现了神经纤维缠结、老年斑。换句话说,无论外源性或内源性增加脑内甲醛,都能在猕猴脑内诱导出老年痴呆症的核心临床症状和核心病理症状,提示甲醛在老年痴呆症发生和发展过程中扮演重要角色。这一结果对于老年痴呆症的防治提供了新的视角和手段,也是国内外第一个具有所有老年痴呆症核心症状的猕猴模型[9]。
4.2.2抑郁症模型
(1)社会压力诱导的猕猴抑郁模型。抑郁症是一种多发性的情绪障碍,人群中大约有10%—15% 的发病率。目前尚未发现很明确的风险基因。在环境因素中,应激和抑郁症的发病有很大的相关性。高等非人灵长类的一个重要特征是具有严格复杂的社会结构。在这一结构中,低地位的个体要承受更大的社会压力,所以是一个建立社会压力相关抑郁模型很好的动物。在国外,研究者利用群居的食蟹猴建立了社会压力诱导的抑郁症模型。我国研究团队则首次利用猕猴建立了类似模型,扩展了建模的动物种类,为将来在非人灵长类上进行抑郁症的研究奠定了基础[10,11]。
(2)生物节律诱导的猕猴抑郁模型。这是一个我国首创的猕猴模型。众所周知,抑郁症与生物节律密切相关。在北欧,冬季抑郁症(又称季节性情感紊乱)发病率为 30%左右。我国研究团队第一次尝试在猕猴中建立冬季抑郁症的模型,发现短光照可以导致猕猴表现抑郁样的蜷缩行为,自主活动量减少,以及反应活动量的降低。除了这些抑郁相关的行为异常外,这些猕猴还表现出和冬季抑郁症病人相似的生理异常,包括体重减轻、快感缺乏和皮质醇增多。进一步的研究又发现,抗抑郁药物治疗可以缓解猕猴表现出的全部抑郁相关症状,包括抑郁样的蜷缩行为、自主活动量的降低、反应活动量的减弱、体重减轻、糖水消耗量减少和皮质醇增多。概括来说,这一研究首次在猕猴中观察到了人类冬季抑郁症的症状,这可以为未来冬季抑郁症的病理机理研究以及药物研发提供一个很好的平台[12]。
(3)早期逆境诱导的青少年猕猴抑郁症模型。大量人的临床研究表明,经历早期逆境(早期不幸经历或早期应激事件,包括童年时期受虐、被父母忽视、家庭不和、父母离异等)的儿童,青少年期及成年后易产生暴力行为和抑郁等情绪障碍。目前,它的形成机理不清楚。利用幼年猕猴,采用将母亲和婴儿分开来的方法来模拟早期逆境,我国研究团队的研究结果首次表明:早期不良环境可以对青少年猕猴造成长期负面影响,但是并没有发现猕猴表现出抑郁样症状。该团队又首次在母婴分离青少年猕猴研究中加进了慢性应激这一抑郁症密切相关的环境因素。与对照组相比,母婴分离组猕猴在经历了慢性应激后,出现了自由活动量减少。抑郁样蜷缩行为和刻板行为增加等抑郁行为。母婴分离组猕猴还发现可的松分泌量的增多现象,以及体重降低的抑郁症状。这些结果首次表明,早期不良环境和慢性应激的确可以造成青少年猕猴患抑郁症,为利用猕猴研究早期逆境的机理奠定了基础。这也是一个我国首创的猕猴模型[13]。
4.2.3两种新型猕猴帕金森病模型的建立
病理学研究表明,脑内一种称为多巴胺能神经元的大量死亡是帕金森病的发病原因。MPTP 是一种能特异高效杀死灵长类脑内多巴胺能神经元的化合物。将它注射进入猕猴体内,就可建立经典的 MPTP 猕猴帕金森病模型。国内好几家单位已建成使用。但是,这一模型也存在几个比较严重的缺陷,影响了其广泛使用。通过将 MPTP 的代谢产物 MPP+ 注射到猕猴侧脑室和单侧黑质中,使药物作用的范围局限于中枢神经系统,国内团队在世界上首次克服了经典 MPTP 诱导模型个体差异大,健康状况差以及症状停药后恢复的三大缺陷,建立了具有良好实用价值新型猕猴帕金森病慢性和急性 2 种模型[14,15]。
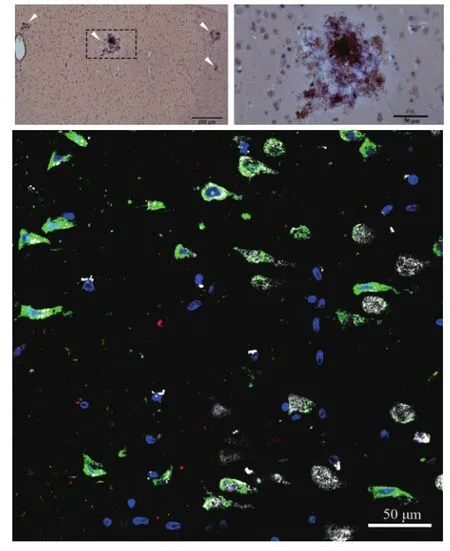
图3 通过长期低剂量颅内注射来增加脑内甲醛,猕猴脑内出现了老年斑(上)、神经纤维缠结(下)两个老年痴呆症的核心病理症状
4.2.4脑高级认知功能的非人灵长类模型
除了疾病研究外,非人灵长类最大的优势在于研究人类高级脑功能。目前,我们对于以自我意识和语言为代表的一系列人类高级认知行为在进化上的起源,尤其是从猴到类人猿和人类这一进化过程中认知行为的爆发式发展知之甚少。同时,缺乏有效合适的动物模型,极大地阻碍了对自我意识和语言等高级认知功能神经机制的深入研究。因此,建立以猕猴为模型研究人类高级认知功能的范式就显得尤为重要。
自我意识是人类最重要的高级认知功能之一,其中一种表现形式就是可以识别镜子中的自我。在发育上,人类儿童要到两岁左右才具备识别镜中自我的能力,而在进化上,以前公认的观点是只有人类和少数几种类人猿(如黑猩猩)能够自我识别,而大量的研究试图证明或训练猴子识别镜中的自我都以失败告终。中科院上海生命科学院神经科学所的研究团队首创了一种视觉感觉偶联训练方法,首次证明恒河猴可以学会识别镜中的自我(图 4)。该研究填补了动物认知进化上的一个空白,并为研究自我识别和自我意识提供了一个理想的动物模型和新的研究途径。同时,在某些神经疾病如智障、自闭症、精神分裂症和老年痴呆症中,病人会表现出自我意识的损伤,不能认识镜中的自己。该研究及其训练方案为临床治疗这种自我意识的缺失提供了有用的线索[16]。
5 对我国非人灵长类模型领域发展的建议
通过以上总结,可以看到我国不但有丰富的非人灵长类资源,还在脑重大疾病建模方面已经有了很好的积累,尤其在转基因猕猴模型方面,我们已处于世界领先的地位。虽然目前科学家们已经在非人灵长类中建立了较高效的基因操作方法(如慢病毒转染和 CRISPR/Cas9基因编辑),但这两种方法获得的转基因个体仍有严重的嵌合体现象。嵌合意味着每个首建动物有不同的基因型,这就导致几乎不可能用首建猴进行科学研究和大规模的药物筛选等应用。理论上获得大量同一突变个体的F1代可以解决这个问题,但非人灵长类实验动物恒河猴和食蟹猴的性成熟时间都很长(4—6 年)。因此,可以说目前的非人灵长类转基因技术还未达到完美,还需改进和优化。下一步,我们应该积极开展新的非人灵长类转基因技术的研究与应用以及非人灵长类动物模型的加速传代研究。在此基础上,我们应加大投入,加紧建立重要的非人灵长类模型,包括脑疾病方面的转基因和药物诱导模型,巩固领先优势,抢占制高点。除此之外,加紧工具猴的研发也是当务之急。工具猴,指的是利用现代成熟的光遗传学技术,制作可应用于非人灵长类认知行为功能研究的光遗传学工具猴,具体包括在全脑范围内表达光遗传学工具蛋白的转基因猴,这样可以避开目前急性病毒在非人灵长类上转染效率不高的缺点,从而为在非人灵长类上研究大脑的高级认知活动与神经元之间的因果关系上提供有效的手段,将极大促进对人脑工作机制的理解。此外,工具猴还包括在特定类型神经元特异性表达,例如 Cre 重组酶的转基因猴,这对脑网络联接图谱的研究也将提供有效的工具。

图4 恒河猴可以学会识别镜中的自我
另外一个应该高度重视的问题是非人灵长类模型动物的表型分析技术的研发。表型,又称性状,指个体形态、功能等各方面的表现,是基因型和环境共同作用的结果。因此,疾病的各种行为、生理和病理特征也是表型。虽然我们可通过转基因和环境因素诱导来建立疾病模型,但是要利用这些模型进行相关疾病机理研究和药物筛选,表型分析是基础。换句话说,没有有效的表型分析手段,模型也失去了意义。因为老鼠和人类在个体、行为的复杂程度上相差很大,现有的鼠类的分析系统又很难移植到非人灵长类上。由于历史的原因,国内外尚未大规模利用非人灵长类建模来研究脑疾病的历史,国内外大多非人灵长类研究处于“小作坊”式的状况,缺乏集成的、系统的表型分析系统来研究发病机理和药物评价等。
一个高效的表型分析系统应该包括覆盖行为与神经生物学、遗传和分子生物学、基因组学、生殖与发育生物学、免疫学、影像学等多个学科,研究层次从分子、细胞、组织扩展至生物个体研究。人类疾病灵长类动物模型研究能否取得突破,很大程度上取决于多学科、多领域、多层次、自动化集成的综合表型分析评价系统的建立。
致谢:感谢昆明理工大学季维智教授对本文提出的宝贵建议。
1 Cyranoski D. MONKEY KINGDOM:China is positioning itself as a world leader in primate research. Nature, 2016, 532: 300-302.
2 Niu Y, Yu Y, Bernat A, et al. Transgenic rhesus monkeys produced by gene transfer into early-cleavage-stage embryos using a simian immunodeficiency virus-based vector. Proc Natl Acad Sci USA, 2010, 107(41): 17663-17667.
3 Niu Y, Shen B, Cui Y, et al. Generation of gene-modified cynomolgumonkey via Cas9/RNA-Mediated gene targeting in One-Cell Embryos. Cell, 2014, 156(4): 836-843.
4 Liu H, Chen Y, Niu Y, et al. TALEN-mediated gene mutagenesis in rhesus and cynomolgus monkeys. Cell Stem Cell, 2014, 14(3): 323-328.
5 Liu Z, Zhou X, Zhu Y, et al. Generation of a monkey with MECP2 mutations by TALEN-based gene targeting. Neuroscience Bulletin, 2014, 30(3): 381-386.
6 Chen Y, Zheng Y, Kang Y, et al. Functional disruption of the dystrophin gene in rhesus monkey using CRISPR/Cas9. Human Molecular Genetics, 2015, 24(13): 3764.
7 Niu Y, Guo X, Chen Y, et al. Early Parkinson's disease symptoms in α-synuclein transgenic monkeys. Human Molecular Genetics, 2014, 24(8): 2308-17.
8 Liu Z, Li X, Zhang JT, et al. Autism-like behaviours and germline transmission in transgenic monkeys overexpressing MeCP2. Nature, 2016, 530(7588):98-102.
9 Yang M F, Miao J Y, Rizak J, et al. Alzheimer's Disease and Methanol Toxicity (Pt.2): Lessons from four rhesus macaques (macaca mulatta) chronically fed methanol. J Alzheimers Dis.,2014, 41(4): 1131-47.
10 Qin D D, Rizak J, Chu X X, et al. A spontaneous depressive pattern in adult female rhesus macaques. Scientific Reports,2015, 5:11267.
11 Zhang Z Y, Mao Y, Feng X L, et al. Early adversity contributes to chronic stress induced depression-like behavior in adolescent male rhesus monkeys. Behavioural Brain Research, 2016, 306: 154-159.
12 Qin D D, Chu X X, Feng X L, et al. The first observation of seasonal affective disorder symptoms in Rhesus macaque. Behavioural Brain Research, 2015, 292(8): 463-469.
13 Feng X L, Wang L N, Yang S C, et al. Maternal separation produces lasting changes in cortisol and behavior in rhesus monkeys. Proc Natl Acad Sci USA, 2011, 108(34): 14312-14317.
14 Lei X, Li H, Huang B, et al. 1-methyl-4-phenylpyridinium stereotactic infusion completely and specifically ablated the nigrostriatal dopaminergic pathway in rhesus macaque. PLoS One, 2015, 10(1).
15 Li H, Lei X, Huang B, et al. A quantitative approach to developing Parkinsonian monkeys (Macaca fascicularis) with intracerebroventricular 1-methyl-4-phenylpyridinium injections. Journal of Neuroscience Methods, 2015, 251:135-135.
16 Chang L T, Fang Q, Zhang S K, et al. Mirror-induced self-directed behaviors in rhesus monkeys after visual-somatosensory training. Current Biology, 2015, 25: 212-217.
胡新天中科院昆明动物所研究员,博士生导师。1988 年毕业于中国科学技术大学生物系,2000 年在美国普林斯顿大学获神经生物学博士学位,2000—2005 年在美国贝勒医学院神经生物学系从事博士后研究,2006 至今年在中科院昆明动物所任研究员、PI。2007 年获得中科院“百人计划”支持。2015 年,被聘为中科院脑卓越中心核心骨干。现在承担中科院战略性先导科技专项(B 类)1 项,中科院重点部署项目 1 项,科技部“973”计划 2 项,基金委重点培育项目1项,面上项目 2 项。目前主要研究方向集中在中枢系统重大疾病猕猴模型的构建和机理研究。目前已建立了 1 种人类早期逆境,2 种新型帕金森氏病,2 种新型老年痴呆症和 3 种抑郁症的新型猕猴模型。以此为基础,开展了系列疾病机理研究,并取得了一批成果。目前与中心其他课题组合作,进行帕金森病深部脑刺激机理,甲醛与老年痴呆症的关系以及脑疾病发生发展过程中环境与基因的相互作用机理等几方面的研究。E-mail: xthu@mail.kiz.ac.cn
Hu XintianPh.D,professor in Neurobiology, is the Principal Investigator of Laboratory of sensory motor integration and non-human primates models of mental disorders, Kunming Institute of Zoology. His research mainly focuses on on the development of CNS diseases models using non-human primates and related studies based on the models. His team has successfully developed PD model, depression model and early adversity model using monkeys. As the principal investigator, he has published more than 40 peer reviewed papers and has been granted five patents. He revieved his Ph.D from the department of psychololgy, Princeton University in 2000. After that, he continued his training as a postdoctoral at Baylor College of Medicine till he took the current position in 2006. E-mail: E-mail: xthu@mail.kiz.ac.cn
仇子龙 男,中科院上海生命科学院神经科学所研究员、博士生导师,1998 年毕业于上海交通大学生物科学与技术系,2003 年在中科院上海生化与细胞所获得博士学位,2003—2009 年在美国加州大学圣迭戈分校神经生物学系从事博士后研究,2009 年 7 月受聘中科院上海神经所。课题组长期获得科技部“973”、基金委及中科院战略先导专项等项目支持,2016 年获中科院上海分院“杰出青年科技创新人才”称号。长期从事自闭症的神经生物学研究,2016 年 1月在 Nature 杂志发表文章报道应用基因工程方法成功获得了携带人类自闭症基因的转基因猴,建立世界上首个自闭症的非人灵长类动物模型,为自闭症的病理研究与临床有效干预作出重要贡献。E-mail: zqiu@ion.ac.cn
Qiu Zilong Male, was born in Beijing and grew up in Anhui, China. From 1994—1998, he attended Shanghai Jiao Tong University and graduated with a BS in Biological Sciences. He was a graduate student with Dr. Kan Liao from 1998—2003 at the Shanghai Institute of Biochemistry and Cell Biology, Chinese Academy of Sciences. He did postdoc in Dr. Anirvan Ghosh's Lab at University of California, San Diego to work on activity dependent transcriptional regulation of genes in the rodent cerebral cortex. He joined ION faculty as Principle Investigator from July, 2009. His work focus on the neurobiological aspects of autism spectrum disorders. E-mail: E-mail: zqiu@ion.ac.cn
Non-Human Primates Brain Model
Hu Xintian1Qiu Zilong2Gu Yong2Gong Neng2Sun Qiang2
(1 Kunming Institute of Zoology, Chinese Academy of Sciences, Kunming 650223, China;2 Institute of Neuroscience, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences,Shanghai 200031, China)
There are around one billion patients suffering from different kind of brain diseases in the world, with a financial costs close to 1000 billion dollars per year, and currently no effective treatments for majority of them. Thus, the need for developing new treatments for the brain diseases is urgent. For ethic reasons,human health related studies relay heavily on animal models and the lack of ideal models is the bottle neck of brain diseases mechanism study and its new treatment's development.Current widely used rodents brain diseases models has server limitations: during evolution, compared to monkeys'separation at 20 million year ago,rodents separated from humans 100 million years ago and as a result,there are huge differences in both structure and function between the human brain a rodents'.When used to develop brain disease model, the complexity of human disease is hard to be duplicated in the rodents.This issue has attracted wide attention and caused reflection in the field. In 2014, Erik C. Hayden published a review titled: Misleading mouse studies waste medical resources,on nature. On the other hand, non-human primates, which are our closest relatives in evolution, share much more similar structures and functions to our brain,and therefore,are excellent experimental animals in solving human problems, especially brain diseases. There are rich non-human primates resources in China: 24 out of 180 species of non-human primates live as native species in China and among them,including the two most widely used ones in brain research, rhesus and cyno monkeys. Recently, as the fast development of neuroscince and translational medicine in China, non-human primates stock increased tremendous as well. There are more then 20 colonies in Yunnan,Guangdong, Guangxi and other provinces, with a total stock over 300 thousands. Among them, 50 thousands are rhesus and the rest 250 thousands are cynos. In addition to our rich non-human primates resources,we also hold the lead in developing brain disease monkey models, especially in transgenic non-human primates models, in the world. In recent years, as new effective gene editing technologies such as TALEN and CRISPR/Cas9 continuously been invented, monkey transgenic technology was on a verge of an significant breakthrough. This important and exciting perspective naturally caught many research group's attention and caused competition, both domestically and internationally. By collaborating closely with other Chinese groups, one Chinese group has successfully applied those two new technology on monkeys first in the world, surpassing strong international competitors,including one MIT group, and put China on a leading position in monkey gene editing technology. Based on this, several Chinese groups has successfully developed four new monkey trans-genetic brain diseases models. Among them, the most influential one is a monkey autism model which was published on Nature as: Autism-like behaviorsand germline transmission in transgenic monkeys over-expressing MeCP2. This series success significantly strengthened our lead position in monkey transgenic models. Because the breakthrough in key technology, the golden age for monkey transgenic model has arrived and it will play an extreme important role in future brain disease study.But on the other hand, since every single life is the result of interaction between gene and environment, the causes for majority brain diseases are also both genetic and environment factors except a small portion of genetic mutation dominant diseases.For example, among the Parkinson's and Alzheimer patients,those with genetic cause only make up less 10 percent of the total.That is, the main causes of the number one and two neuro-degenerative diseases are environmental factors. Therefore, finding out the environmental factors causing those diseases and then,using them to induce related model is another important strategy in brain disease model development. On this aspect, supported by different important national funding channels, Chinese groups have been working on it for long time and made significant breakthroughs on Parkinsons',Alzheimer disease, depression and other mental disorder monkey models.In addition to disease study,another important application of non-human primates is high brain functions. On this aspect, one Chinese group has successfully developed the first rhesus monkey self awareness model in the world, building a solid foundation for future study on the brain mechanisms of high brain functions, such as self awareness. In short, with strong funding support from the government and long persistent hard work of several research groups, the non-human primates model study has made significant advances in China and attracted attentions from the world. Those progresses have been reviewed by Nature (“China takes steps to secure pole position in primate research”. Nature 2004; 432:3; “MONKEY KINGDOM”: China is positioning itself as a world leader in primate research”. Nature 2016; 532: 300: 2) and Cell (“Monkey Research in China: Developing a Natural Resource”. Cell 2007; 129: 1033-1036). In this review, we first analyzed the national strategic needs of non-human primates brain models, and then, summarized both the international and domestic status of non-human primates studies. Based on these, we proposed the next important steps that should be taken to facilitate related studies and ensure our leading position in this important field.
brain disease, non-human primates, animal model
10.16418/j.issn.1000-3045.2016.07.006
*资助项目:中科院战略性先导科技专项项目(B类)(XDB0200000)
** 通讯作者
修改稿收到日期:2016年6 月12日

