盐酸美金刚在中国治疗阿尔茨海默病的药物经济学模型
胡善联于 欣Emilie ClayMondher ToumiDominique Milea
盐酸美金刚在中国治疗阿尔茨海默病的药物经济学模型
胡善联1于 欣2Emilie Clay3Mondher Toumi4Dominique Milea5
目的 探讨从中度阿尔茨海默病(AD)开始盐酸美金刚治疗与仅从重度AD开始盐酸美金刚治疗在中国的临床和经济效益。方法 运用马尔可夫模型,通过定义患者的不同健康状况,模拟了中度AD患者在5年中的疾病进展。研究对两组患者进行了比较:①从中度AD开始接受美金刚治疗(进入模型的时期)并持续至病情发展到重度AD的患者;②仅从重度AD开始接受美金刚治疗的患者。结果 5年后,从中度AD开始美金刚治疗的患者中,较少的患者发展至重度AD(49%),依赖他人(59%)或有激越行为(47%);相比对于从重度AD开始治疗的患者分别为58%、67%和55%。从中度AD开始美金刚治疗的全国总治疗费用(670亿人民币)低于从重度AD开始的费用(730亿人民币)。结论 在中国,从中度AD开始使用美金刚治疗可以节省大量成本。
阿尔茨海默病;疾病负担;美金刚;成本节约;药物经济学;激越行为
在中国,阿尔茨海默病(AD)是导致老年人痴呆最常见的原因,城市地区≥65岁人群患病率为1.9%[1]。由于中国人口迅速老龄化,据估计,AD发病率在未来20年内增长率将超过100.0%,到2040年,AD在中国的患病率将和高收入国家相当[2]。中国缺少适当的专业护理设施,且照顾老人在传统上被认为是家庭的责任,所以大多数中国AD患者均在家中依靠家人照顾[2-3]。而这种护理往往需要相当大的经济、情感和体力付出,随着AD的发病率逐年增高,给中国带来的社会和经济负担预计将大幅度增加[4-5]。
AD的特征在于进行性记忆丧失,认知功能下降,功能性能力逐渐受损,以及一系列随时间变化的行为和心理症状(痴呆的行为和精神症状,Behavioral and Psychological Symptoms of Dementia,BPSD)。BPSD不同症状往往同时存在,可以出现于疾病的任何阶段,包括情绪障碍(如抑郁、焦虑、淡漠)、精神症状(如妄想、幻觉)和行为症状(如激越、攻击性、异常的运动行为)。随着AD进展至中度和(或)重度阶段,BPSD会变得更加频繁和持续,认知和功能性能力明显下降,需要医院护理,病死率显著增加。这将显著影响患者的生命质量,并且带来相当大的经济负担[6-7]。
激越和攻击行为是AD主要的行为症状,往往与疾病的严重程度密切相关,并与不良后果有关,比如住院或安置在养老院,这也往往预示着较高的护理需求[6,8-9]。因此,对激越、攻击性行为的有效管理在缓解一些重度AD患者身体、情感和经济负担中显得尤为重要。药物治疗可以减轻症状和延缓疾病进展,美金刚是NMDA受体拮抗剂,应用于中重度AD患者可促进功能性改善,减少其对护理人员的依赖和延缓疾病进展[10-15],而且对于减少激越、攻击性行为尤其有效[16]。一些分析“需要治疗的人数”(NNT)的研究支持这些效果的临床相关性,这些研究显示美金刚在总体方面(临床医生面询印象变化量表,CIBIC-plus;NNT=6)、认知方面(严重障碍量表,SIB;NNT=7)和日常生活方面(阿尔茨海默氏病协作学习-日常生活能力量表,ADCS-ADL;NNT=8)均有较小的NNT[13,17]。
在中国,美金刚已批准用于治疗中重度AD患者,但目前只建议对重度AD患者提供报销。在一些国家进行的经济学评估已经证明了美金刚的成本-效益,美金刚可通过延长患者在AD中期的时间,使患者在生活上能更长时间地保持独立,从而减轻护理人员的负担和延缓住院需要[18-21]。
本研究将从社会角度呈现一个模型,评估并比较美金刚治疗中度AD和重度AD患者的临床疗效和经济效益。
1 资料与方法
1.1模型 本研究采用了一个经中国临床专家验证的马尔可夫模型,在5年期间以6个月为间隔进行模拟。在模拟开始时,根据功能独立性和是否具有激越/攻击性行为,将中度AD患者划分成4种健康状态:①非依赖,不具激越/攻击性;②非依赖,具激越/攻击性;③依赖,不具激越/攻击性;④依赖,具激越/攻击性(图1A)。当患者进展至重度AD时,再次划分到这4个类别,从而产生了另外4种健康状态,包括“死亡”状态,模型共考虑了9种健康状态(图1A)。所有健康状态的患者都有可能转移到吸收状态“死亡”(图1B)。

图1 模型结构
为了确定患者依赖性和激越/攻击性的状态分布,以及每个健康状态的资源使用和费用,6位独立专家被邀请到2013年11月举行的德尔菲专家会议参与调查[22]**德尔菲专家组包括:陈生弟教授(上海瑞金医院精神内科),于欣教授(北京精神卫生研究所老年精神病学科),贾建军(北京301医院神经内科),陈晓春(福建医科大学附属协和医院),李春厚(北京协和医院医保办),刘聪(北京同仁医院医保办)。由于AD在中国的医疗卫生资源使用数据十分有限,此研究通过德尔菲专家咨询来获取AD在中国城市中临床管理方面的信息。专家们对最终的参数达成一致意见,将这些参数作为输入数据代入模型。临床专家证实,此模型结构准确地估计了中国AD患者管理的主要方面,而且其所基于的假设也是可以接受的。进入模型的中度患者分布如下:“非依赖,不具激越/攻击性”占70%,“非依赖,具激越/攻击性”占15%,“依赖,不具激越/攻击性”占10%,“依赖,具激越/攻击性”占5%。该数据也反映了随机对照临床试验中的患者分布情况。
中度AD患者在进入模拟时被分配到两个治疗组中的1组:第1组中,患者从中度AD阶段开始接受美金刚治疗(也就是进入模型时),并且当进展至重度AD时持续给予美金刚治疗。在第2组中,患者仅在重度AD阶段才开始采用美金刚进行治疗。两组患者均持续接受美金刚治疗直至病死。治疗6个月后,如果有不良事件(AE)发生,患者可以停止治疗;该模型只在前6个月考虑了这个方面,因为6个月后药物不良反应发生率很低[23]。模型中的临床结果是重度、激越/攻击性和(或)依赖性患者的比例和每例患者每天所需要照顾的时间。此外,计算了从中度AD开始美金刚治疗,防止1例重度、依赖性或激越/攻击性AD患者的NNT,并且与重度阶段开始美金刚治疗相比较。该模型的主要经济学结果是总体治疗费用,是由个人使用的卫生资源乘以资源的单位成本而得到的。结果表示为每例患者的费用,并以此推断有可能接受美金刚(36.5940万例)治疗人群的总体费用;治疗人数是基于中国AD患者的总数(570万例)[24],并考虑到有21.3%为在治疗患者[2],以及美金刚30%的销量市场份额(Ebixa®IMS volume market share)。
该模型在每6个月的周期中以及整个研究期间均模拟了所有结果。
1.2转移概率 转移概率的计算是基于从4个评估美金刚单药治疗AD的疗效和耐受性的欧美随机、双盲、安慰剂对照研究中得到的汇总数据[10,11,13,15]。表1和表2是模型中所有接受美金刚治疗和未接受治疗患者的转移概率。为了得到临床试验中的转移概率,将患者划分为不同的健康状态。根据简易精神状态检查(MMSE)得分,将AD患者划分为中度或重度;当MMSE得分无法使用时,患者的状态将根据阿尔茨海默病评估量表-认知部分(ADASCOG)得分划分。患者的依赖性是由日常生活能力量表(ADL)来确定的;而患者“激越/攻击性”程度的分类是基于神经精神状态量表(NPI)中“激越/攻击性”这一项的得分[25-26]。一旦患者被归类到“攻击性”,他们在整个研究中将一直保持在该状态下。
在第一个为期6个月的周期中,终止用药的患者比例被设定为4.7%。这是从一项随机、双盲、安慰剂对照、在中国AD患者中开展的美金刚研究中得到的;该研究显示在前6个月中,128例患者中有6例由于不良事件终止用药(4.7%)[23]。模型中采用的病死率为每个周期5.2%,这是根据AD患者的相对病死风险(1.6)[27]和中国普通70岁人群的年病死率(6.3%)计算得出的[28],因为纳入模型患者的平均年龄被假设为70岁。

表1 接受美金刚治疗患者6个月的转移概率(%)

表2 未接受治疗患者6个月的转移概率(%)
1.3资源的利用和成本 本研究对模型中8个健康状态的资源使用进行了评估,包括住院、护理人员花费的时间和养老院护理(表3)。除了护理人员的薪水外,所有单位成本(表4)均是从德尔菲专家咨询中得到的。家庭护理可以由专业护理人员或家人/朋友提供;最近一项调查显示,在中国约有17.5%的家庭护理是由专业护理人员提供的[29],这个比例也被应用到了模型中。专业护理人员的薪水是根据患者的健康状态进行划分的:对于激越/攻击性患者需要每个月6000元(德尔菲专家咨询获得),非激越/侵略性、不依赖他人的患者需要每个月3202元(基于提供“服务到户”服务的从业人员平均工资[28]),而依赖性患者需要每个月4601元的护理费(工资上限与下限之间的中间值)(表4)。为囊括非专业看护,本研究进行了情境分析,其中非专业护理人员与专业人员的护理成本被假定为相同。对于模型中所考虑到的所有费用和护理人员的时间成本,采用了3%的贴现率,这与之前的中国模型一致[30-32]。

表3 中度和重度患者管理的资源使用

表4 医疗资源使用的单位成本
1.4敏感性分析 确定性敏感性分析测试了模型输入参数的稳定性。分析的参数包括住院的概率、入住养老院的概率、护理人员花费的时间、不良治疗依从性的概率、停药的概率和住院的平均时间(表5)。输入模型的参数都是基于德尔菲专家组咨询的数值范围;唯一的例外中止治疗概率是根据一项中国AD患者美金刚研究中的不良事件比例95%置信区间得到的[23]。根据基本情况,敏感性分析只考虑了专业护理人员的费用。
2 结果
2.1美金刚的临床效益 相比于从重度AD开始美金刚治疗,从中度AD开始使用美金刚在临床结果方面显示出了优越性。在模拟过程中的所有时间点上,与重度AD开始美金刚治疗组相比,从中度AD开始美金刚治疗组有更低比例的重度、依赖性和具有激越/攻击性的患者(图2)。护理人员时间的花费也显示了相似的结果:从中度AD开始美金刚治疗患者每天需要的看护时间与从重度AD开始美金刚治疗的患者相比,平均少了2 h(图2)。
两项临床效益的两组最大差异出现在第3年,包括严重AD患者的比例(从中度和重度AD开始美金刚治疗的两组分别为39%和51%)和依赖性患者的比例(分别为50%和62%)。对于激越/攻击性患者,两组之间的临床效益差异持续增加至第5年(图2)。3年后,对于重度、依赖性和激越/攻击性的患者,NNT分别为11、11和23例,即相比从重度AD开始美金刚治疗,如有11例患者从中度AD开始,即可避免1例患者进展到重度AD或者依赖他人;如有23例患者从中度AD开始美金刚治疗,即可避免1例患者出现激越/攻击性行为。
2.2美金刚治疗的经济效益 5年后,从中度AD开始美金刚治疗的整体医疗费用低于从重度AD开始(从中度AD开始美金刚治疗的总费用为每例患者182 302,而从重度AD开始美金刚治疗的总费用为每例患者199 848元;两者相比减少了近1万例患者,每例患者节约成本17 546元)。若按全国366 000例患者估算时,从中度和重度开始美金刚治疗的总费用分别为670亿元和730亿元,可节省成本将达到60亿元(图3A)。如果考虑到非专业护理,从中度开始美金刚治疗将节省成本31 672元(从中度或重度开始美金刚治疗的总费用分别为每例患者269 487元和301 159元]),相应的,36万人群6000例患者的总成本节省将近110亿元(图3B)。
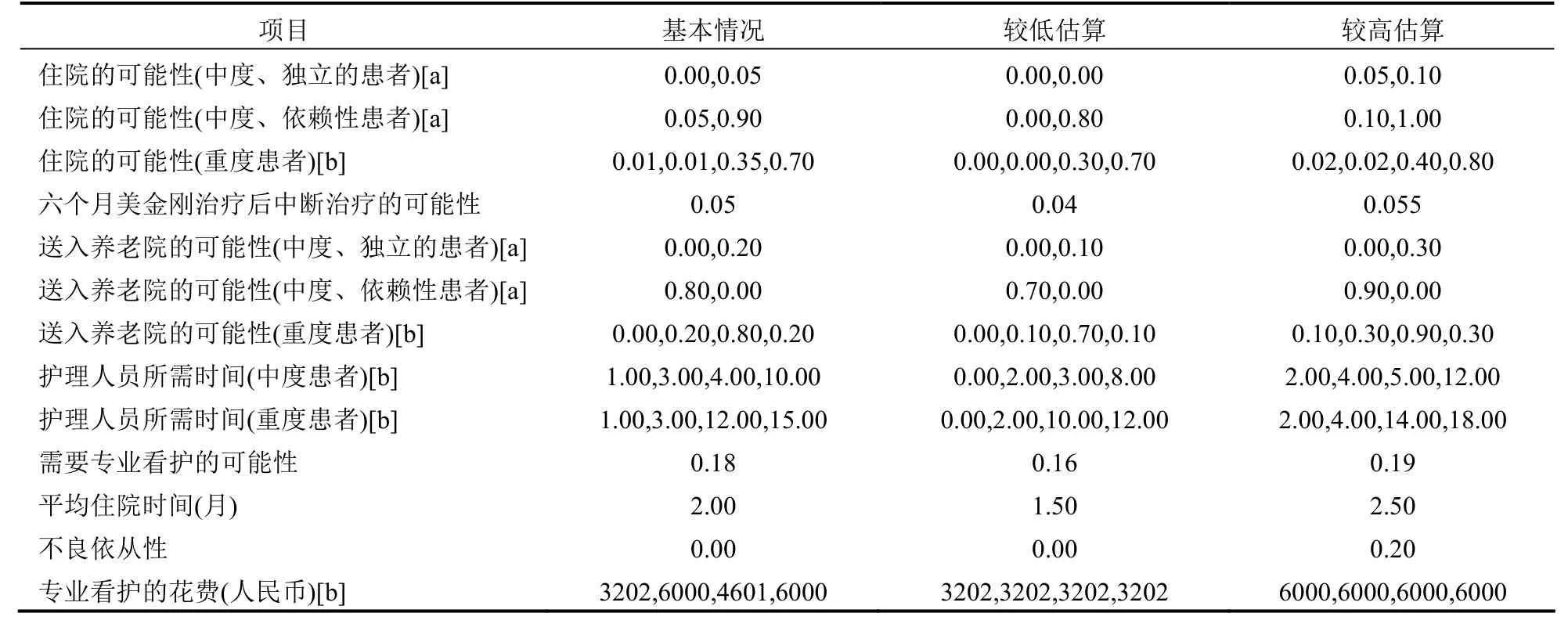
表5 决定敏感性分析的输入数据
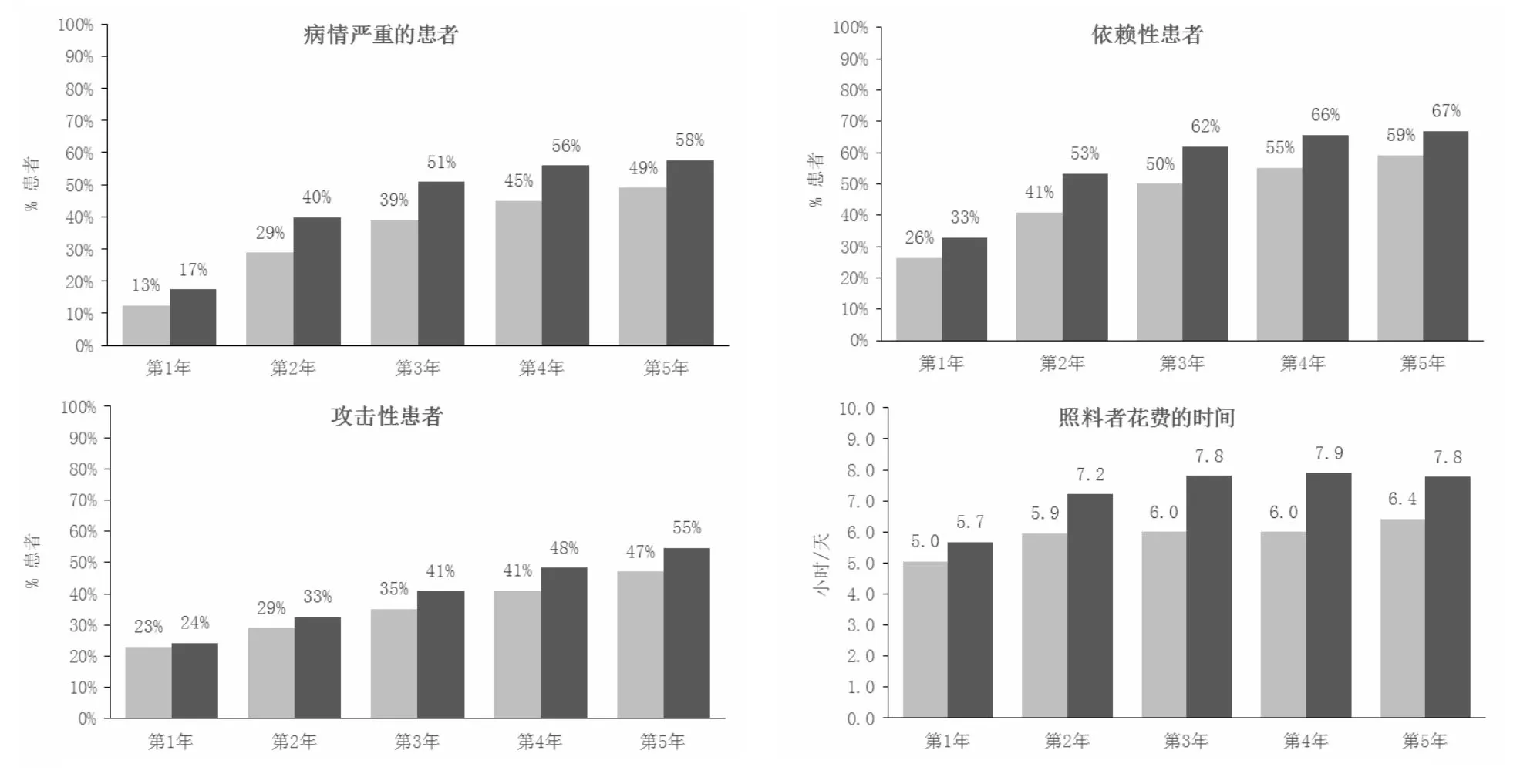
图2 美金刚治疗的临床效益
对单个成本要素分析表明,主要成本花费是住院治疗、养老院看护和护理人员(图3)。到第5年时,这些成本要素对于从重度AD开始的美金刚治疗会产生更高的治疗成本(养老院看护:270亿元;住院治疗:280亿元;专业护理人员:80亿元),相比于从中度AD开始治疗(养老院看护:220亿元;住院治疗:200亿元;专业护理人员:70亿元)(图3A)。由于我国非专业护理十分普遍,若将非专业护理费用纳入模型考虑范围会带来更高的成本节省(图3B)。
如果只考虑专业看护的费用,相比于从重度AD开始美金刚治疗,从中度AD开始在第1~2年的成本较高,但是从第3年开始可以节约成本(图4A)。第3~5年的成本节约可达152亿元,大约是第1~2年总费用的4倍(图4A)。当同时考虑专业和非专业的看护费用时,在中度AD开始美金刚治疗可从第1年后就开始节约成本(在第2~5年节约成本:253亿元)(图4B)。
敏感性分析支持了基础情况分析结果的稳定性。一些参数的不确定性会相应的影响研究结果,影响较大的参数包括严重AD患者的住院时间、需要入院治疗的概率和养老院护理的概率(图5)。敏感性分析并没有改变从基本情况分析中得出的结论,即从中度AD开始美金刚治疗,相比于从重度开始,是一个节省成本的机会。

图3 五年后美金刚的经济效益

图4 从中度开始和从重度开始美金刚治疗的相对花费比较
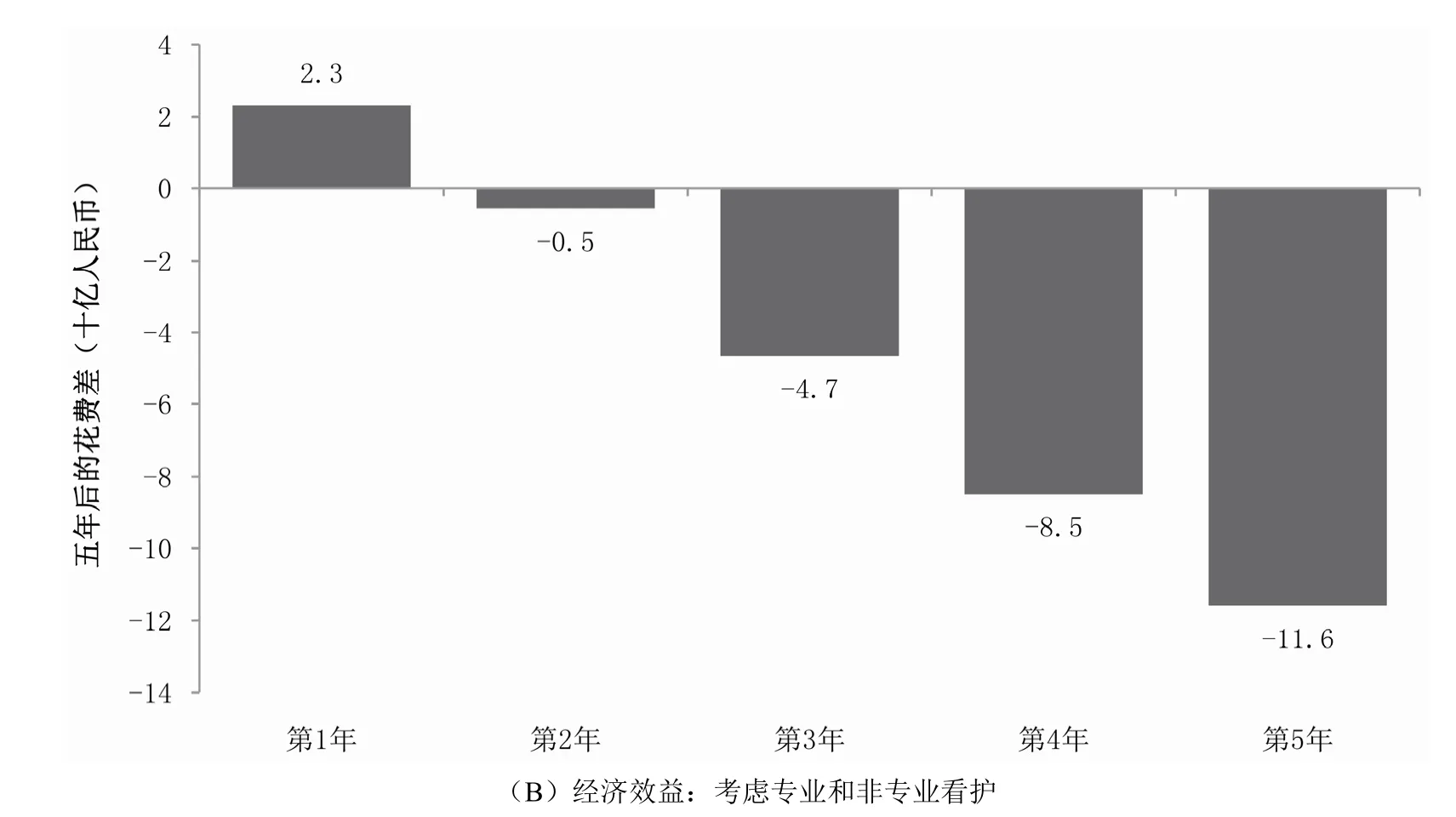
图4 从中度开始和从重度开始美金刚治疗的相对花费比较
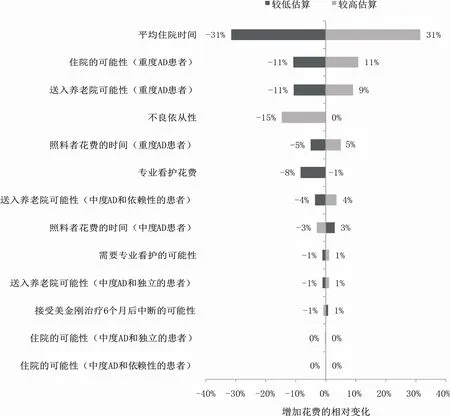
图5 敏感性分析(基本情况)
3 讨论
在中国,AD的相关护理费用已成为巨大的、并不断增长的经济负担,所以延缓疾病进展并降低重度AD所带来的节约费用的治疗方法尤为重要[33]。在本项研究中,从中度AD开始美金刚治疗可以使用较低的成本带来更大的临床效益,改善AD症状,实现可观的成本节约。
该模型在建模过程中具有一定局限性,这些局限性与患者实际管理的复杂性和在设计模型的简单化方面应与作出的假设有关。这是经济建模中公认的局限性[34],本模型也不例外。文献中对中国数据的缺乏和中国城市之间的经济,文化和基础设施的差距增加了建模的复杂性。尽管德尔菲专家咨询中,专家来自不同城市和医院,但是对AD的治疗途径达成共识解决了实践中的异质性。表面效度(Face Validity)确保了AD管理的所有相关方面,无论从临床和资源利用的角度来看都包括在内。
考虑到疾病的进展与缺乏影响病程的急性临床事件,选择6个月的周期长度是出于经验的考虑;这与大多数发表的痴呆症马尔可夫经济模型是一致的[35]。5年的时间范围反映了对长期模型固有的不确定性和反映美金刚治疗中所关心结果之间的适当平衡。该模型将从临床试验中得出6个月的转移概率[10,11,13,15]外推至整个5年时间模型中;这个假设由临床医师验证,并与其他经济模型一致[21,36-37]。就建模而言,建模的作用是评估各种策略超出临床试验结果的外推。此外,美金刚在治疗前6个月之后对激越、攻击性行为的持续效益和从大型保险数据库中得到的分析一致,对大型保险数据库的分析表明,开始美金刚治疗对AD患者抗精神疾病药物的使用有长期稳定作用[38-39]。同样的,仅仅依赖于临床试验数据来驱动模式是另一个限制。众所周知,现实中的临床实践与临床试验大不相同,因此从临床试验中得到的结果不能完全代表临床实践。特别是在临床实践中,患者可能有更复杂的病情(包括较多合并症),较高的停药率和较差的治疗依从性。因此,在诠释这项研究结果时,注意临床试验数据的局限性是很重要的。
另一个限制是假设激越或有攻击性行为的AD患者将保持这种状态。这是一个保守的假设,美金刚已被证明不仅可以减少激越出现的可能,还可以改善伴有激越、攻击性行为患者的症状。因此从整体来看,这个假设可能低估了美金刚的临床效益[16]。然而,尽管激越、攻击性症状在AD的进展过程中会有所不同,但这个假设仍被认为是合理的,并且得到了观察性研究数据的支持[8,40-41]。模拟中每个周期的病死率(5.2%)是基于对中度和重度患者相似的相对危险性,因为这是中国唯一可用的相关数据。严重AD与较高的病死率相关[42],但迄今没有AD治疗可以影响病死率。因此,对中度和重度患者使用,选用相同的病死率也是合理的。
该模型的重点放在城镇人口,也被认为是一个不足之处,因为推测的结果不一定适用于农村居民。不过,中国城市患者更容易获得美金刚治疗,而对于农村患者而言,往往连基本的医疗卫生服务都很难满足[43]。如前所述,临床实践的异质性和中国数据的缺乏使整体地评估卫生资源的使用变成了一项复杂的工作。目前只有一项研究调查了中国AD患者的医疗资源使用情况[5]。这项调查包括了上海一家医院的67例轻度至重度不等的AD患者,并提供了总成本和资源利用的数据。本研究从德尔菲专家取得的结论,不仅填补了文献的空白,弥补了临床实践、临床路径和单位成本数据缺乏的不足,这对建模是至关重要的。
在本研究中,影响成本的主要因素是住院费用、养老院安置费和护理人员的时间成本。研究中观察到的尽早开始美金刚治疗所带来的经济利益与药物的临床效益是一致的。美金刚可以延缓患者对护理人员的依赖性和激越、攻击性症状的发生,而这些又是患者需要住院和医疗护理的主要原因,也是AD治疗中最昂贵的部分[7,44]。同样的,疾病的严重程度、激越、攻击性症状的严重程度和依赖程度均很大地影响着护理所需时间[5,45-46],对于中度AD开始美金刚治疗患者,减缓症状的发展很可能是减少护理人员所用时间的一个主要原因。
非专业看护的成本核算是一个有争议的话题,尽管最近的一些研究已经调查其经济影响[29,46-49],但迄今没有一致的成本核算方法。在这项研究中,非专业看护没有包括在基本经济分析中,而是将其中非专业看护当作是专业的看护。最近一项调查显示,中国痴呆患者的总看护时间只有不到20%是付费的专业看护,而大部分看护均是由家庭成员提供的[29]。即使非专业看护人员没有有偿服务,但社会成本还是存在的。因此,该方案提供了真实的AD经济成本。此外,中国的劳动力成本预计在未来几年会持续攀高,护理费用(专业和非专业)在经济负担中所占的份额可能会越来越大[50]。
这项研究与其他国家的美金刚成本-效益分析结果一致[18-21]。这些研究表明,美金刚治疗的额外费用与其产生的健康效益相比,在整体上达到成本节约,主要是通过延迟医疗看护和降低对看护的需求。从国外文献报告来看,在芬兰和英国每例患者5年以上的成本节约分别为€1700和€2100[19,21],而在西班牙每例患者的2年成本节约为€667[18]。护理费用的节省是一致的。
本研究是中国第一个符合本国药物经济学指南的AD经济模型[30,32,51]。最近,中国针对抑郁症和帕金森病的成本-效益研究表明,大多数发表的研究均是利用临床终点的研究,而且成本考虑往往只局限于药品[52-53]。这是因为记录患者的临床路径、疾病负担和确定资源利用的单位成本有很大难度,而本研究克服了这些困难。
4 结论
药物经济学模型的主要目的是比较从中度和从重度AD开始美金刚治疗的临床疗效和经济效益,目前我国医疗保险药物报销目录中,美金刚只对重度AD患者的治疗给予报销。模型研究对决策的制订提供了有价值的信息。证明从中度AD开始使用美金刚治疗更能显著节省成本,在住院治疗、养老院看护中护理的时间均有所减少,而且还可以显著改善患者的临床症状。该治疗方案确保了治疗1年后有更高的临床效益,在3年内能达到成本节约,提高临床疗效和减少经济负担。
致谢
感谢德尔菲专家调查组成员对模型参数的提供,感谢Costello Medical Singapore在本研究建模编辑和行政上的援助。研究资金由灵北(北京)医药信息咨询有限公司提供。
[1]BW Wang,S Wu,X Cheng,et al.Prevalence of Alzheimer's disease and other dementing disorders in an urban community of Beijing,China[J].Neuroepidemiology,2000,19(4):194-200.
[2]Dementia in China.China Alzheimer's Project.Available at:http://www.memory360.org/en/#1[Last accessed November 2014].
[3]M Prince.Care arrangements for people with dementia in developing countries[J].International Journal of Geriatric Psychiatry,2004,19(2):170-177.
[4]RG Stefanacci.The costs of Alzheimer's disease and the value of effective therapies[J].American Journal of Managed Care,2011,17 Suppl 13:S356-362.
[5]G Wang,Q Cheng,S Zhang,et al.Economic impact of dementia in developing countries:an evaluation of Alzheimer-type dementia in Shanghai,China[J].Journal of Alzheimers Disease Jad,2008,15(1):109-115.
[6]M Benoit,I Dygai,O Migneco,et al.Behavioral and Psychological Symptoms in Alzheimer's Disease[J].Dementia&Geriatric Cognitive Disorders,1999,10(6):511-517.
[7]DL Murman,Q Chen,MC Powell,et al.The incremental direct costs associated with behavioral symptoms in AD[J].Neurology,2002,59(11):1721-1729.
[8]L Bidzan,M Bidzan,M Pachalska.Aggressive and impulsive behavior in Alzheimer's disease and progression of dementia[J]. Medical Science Monitor International Medical Journal of Experimental&Clinical Research,2012,18(3):182-189.
[9]J Cummings,J Mintzer,H Brodaty,et al.Agitation in cognitive disorders:International Psychogeriatric Association provisional consensus clinical and research definition[J].International Psychogeriatrics,2014,27(1):1-11.
[10]S Bakchine,H Loft.Memantine treatment in patients with mild to moderate Alzheimer's disease:results of a randomised,double-blind,placebo-controlled 6-month study[J].Journal of Alzheimers Disease Jad,2007,11(4):97-107.
[11]ER Peskind,SG Potkin,N Pomara,et al.Memantine Treatment in Mild to Moderate Alzheimer disease:a 24-week Randomized,Controlled Trial[J].American Journal of Geriatric Psychiatry,2006 14(8):704-715.
[12]AP Porsteinsson,GT Grossberg,J Mintzer,et al.Memantine treatment in patients with mild to moderate Alzheimer's disease already receiving a cholinesterase inhibitor:a randomized,doubleblind,placebo-controlled trial[J].Current Alzheimer Research,2008 5(1):83-89.
[13]Reisberg B,Doody R,StÖffler A,et al.Memantine in moderateto-severe Alzheimer's disease[J].New England Journal of Medicine 2003,348(14):609-610.
[14]Tariot PN,Farlow MR,Grossberg GT,et al.Memantine treatment in patients with moderate to severe Alzheimer disease already receiving donepezil:a randomized controlled trial[J].JAMA,2004,291(3):317-324.
[15]CH van Dyck,PN Tariot,B Meyers,et al.A 24-week randomized,controlled trial of memantine in patients with moderate-to-severe Alzheimer disease[J].Alzheimer Disease&Associated Disorders,2007 21(2):136-143.
[16]S Gauthier,H Loft,J Cummings.Improvement in behavioural symptoms in patients with moderate to severe Alzheimer's disease by memantine:a pooled data analysis[J].International Journal of Geriatric Psychiatry,2008,23(5):537-545.
[17]G Livingston,C Katona.The place of memantine in the treatment of Alzheimer's disease:a number needed to treat analysis[J]. International Journal of Geriatric Psychiatry,2004,19(10):919-925.
[18]F Antonanzas,B Rive,JM Badenas,et al.Cost-effectiveness of memantine in community-based Alzheimer's disease patients: An adaptation in Spain[J].European Journal of Health Economics,2006 7(2):137-144.
[19]C Francois,H Sintonen,R Sulkava,et al.Cost effectiveness of memantine in moderately severe to severe Alzheimer's disease:a markov model in Finland[J].Clinical Drug Investigation,2004,24(7):373-384.
[20]B Rive,D Aarsland,M Grishchenko,et al.Cost-effectiveness of memantine in moderate and severe Alzheimer's disease in Norway[J]. International Journal of Geriatric Psychiatry,2011,27(6):573-582.
[21]B Rive,M Grishchenko,C Guilhaume-Goulant,et al.Cost effecttiveness of memantine in Alzheimer's disease in the UK[J].Journal of Medical Economics,2010,13(2):371-380.
[22]J Yan,L Ge,E Clay,et al.PMH18 Disease Management,Resource Utilisation and Associated Cost for Moderate and Severe Dementia
Patients in China:Results from a Delphi Panel[J].Value in Health,2014,17(7):768-768.
[23]X Chen,ZX Zhang,JL Yao,et al.Multicenter research on efficacy and tolerance of memantine in Chinese patients with Alzheimer's disease[J].Chinese Journal of Neurology,2007,40(6):364-368.
[24]DA Wimo,B Winblad,A StÖffler,et al.Resource utilisation and cost analysis of memantine in patients with moderate to severe Alzheimer′s disease[J].Pharmacoeconomics,2012,21(5):327-340.
[25]WJ Bossers,LH van,F Boersma,et al.Recommended measures for the assessment of cognitive and physical performance in older patients with dementia:a systematic review[J].Dementia Geriatric Cognitive Disorders Extra,2012,2(1):589-609.
[26]Cummings JL,Mega M,Gray K,et al.The Neuropsychiatric Inventory:comprehensive assessment of psychopathology in dementia[J].Neurology,1994,44(44):2308-2314.
[27]Z Hong,B Zhou,MS Huang,et al.[Predictive factors on mortality and survival of elderly dementia in Shanghai][J].Zhonghua liu xing bing xue za zhi,2005,26(6):404-407.
[28]National Bureau of Statistics of China:National Data.Available at:http://data.stats.gov.cn[Last accessed November 2014].
[29]JF Mouldquevedo,B Tang,E Harary,et al.The burden of caring for dementia patients:caregiver reports from a cross-sectional hospital-based study in China[J].Expert Review Pharmacoeconomics &Outcomes Research,2014,13(5):663-673.
[30]Hu S.Pharmacoeconomic Guidelines in Asia:Focus on China Guidelines for Pharmacoeconomic Evaluations.2011. Available at:http://www.ispor.org/meetings/baltimore0511/presentations/ASIAForum.p df[Last accessed February 2015].
[31]DW Hutton,ML So SKBrandeau.Cost-effectiveness of nationwide hepatitis B catch-up vaccination among children and adolescents in China[J].Hepatology,2010,51(2):405-414.
[32]B Wu,L Lv.Cost effectiveness of different treatment strategies in the treatment of patients with moderate to severe rheumatoid arthritis in China[J].Chinese pharmaceutical Congress and Chinese pharmacist week,2012,7(10):496-499.
[33]MD Mingyuan Zhang,DR Katzman,D Salmon et al.The prevalence of dementia and Alzheimer's disease in Shanghai,China:Impact of age,gender,and education[J].Annals of Neurology,1990,27(4):428-437.[34]MJ Buxton,MF Drummond,BA Van Hout,et al.Modelling in economic evaluation:an unavoidable fact of life[J].Health Economics,1997,6(3):81-94.
[35]FA Sonnenberg,JR Beck.Markov models in medical decision making:a practical guide[J].Med Decis Making,1993,13(4): 322-338.
[36]M Gagnon,B Rive,M Hux,et al.Cost-effectiveness of memantine compared with standard care in moderate-to-severe Alzheimer disease in Canada[J].Canadian Journal of Psychiatry Revue Canadienne De Psychiatrie,2007,52(8):519-526.
[37]RW Jones,P Mccrone,DC Guilhaume.Cost Effectiveness of Memantine in Alzheimer's Disease[J].Biology of Reproduction,2004 67(6):1811-1816.
[38]J Lachaine,C Beauchemin,A Crochard,et al.The impact of memantine and cholinesterase inhibitor initiation for Alzheimer disease on the use of antipsychotic agents:analysis using the Regie de l'Assurance Maladie du Quebec database[J].Canadian Journal of Psychiatry Revue Canadienne De Psychiatrie,2013,58(58):195-200.
[39]JS Vidal,JM Lacombe,JF Dartigues,et al.Evaluation of the impact of memantine treatment initiation on psychotropics use:a study from the French national health care database[J].Neuroepidemiology,2008,31(31):193-200.
[40]LB Zahodne,K Ornstein,S Cosentino,et al.Longitudinal Relationships Between Alzheimer Disease Progression and Psychosis,Depressed Mood, and Agitation/Aggression[J].American Journal of Geriatric Psychiatry,2013,23(2):130-140.
[41]SH Ryu,C Katona,B Rive,et al.Persistence of and Changes in Neuropsychiatric Symptoms in Alzheimer Disease Over 6 Months The LASER-AD Study[J].American Journal of Geriatric Psychiatry,2005,13(11):976-983.
[42]J Vilalta-Franch,S Lopez-Pousa,L Calvó-Perxas,et al.Psychosis of Alzheimer disease:prevalence,incidence,persistence,risk factors,and mortality[J].American Journal of Geriatric Psychiatry,2012,21(11):1135-1143.
[43]R Chen,Z Hu,RL Chen,et al.Determinants for undetected dementia and late-life depression[J].British Journal of Psychiatry the Journal of Mental Science,2013,203(3):203-208.
[44]J Darbà,L Kaskens,L Lacey.Relationship between global severity of patients with Alzheimer's disease and costs of care in Spain;results from the co-dependence study in Spain[J].European Journal of Health Economics,2014,16(8):1-11.
[45]A Association.2014 Alzheimer's disease facts and figures[J]. Alzheimers&Dementia,2014,10(2):47-92.
[46]P Gillespie,E O'Shea,J Cullinan,et al.Longitudinal costs of caring for people with Alzheimer's disease[J].International Psychogeriatrics 2014,27(5):1-10.
[47]LM Peña-Longobardo,Oliva-Moreno J.Economic valuation and determinants of informal care to people with Alzheimer's disease[J]. European Journal of Health Economics,2015,16(5):507-515.
[48]GB Rattinger,S Schwartz,CD Mullins,et al.Dementia severity and the longitudinal costs of informal care in the Cache County population[J].Alzheimers&Dementia the Journal of the Alzheimers Association,2015,11(8):946-954.
[49]S Schaller,J Mauskopf,C Kriza,et al.The main cost drivers in dementia: a systematic review[J].International Journal of Geriatric Psychiatry,2015,30(2):111-129.
[50]R Bhula-Or,P Kripornsak.Trends of labour demand for high-skilled workers and their wages in Thailand[J].Thedreamcatchersgroup Llc,2008,7(1).
[51]NC Edwards,JC Locklear,MFT Rupnow,et al.Cost-effectiveness of long-acting risperidone injection versus alternative atypical antipsychotic agents in patients with schizophrenia in the USA[J]. Parmacoeconomics,2005,23 Suppl 1(Suppl 1):75-89.
[52]W Low,S Azmi,SL Yee,et al.PMH20.Comparative Pharmacoeconomics Studies of Treatment for Major Depressive Disorder in China[J].Value in Health,2014,17(7):A769.
[53]W Low,S Azmi,SL Yee,et al.PRM-Health Economics Methodologies Involving Parkinson's Disease Treatment in China[J].Value in Health,2014,17(7):727-728.
R95
A 【DOI】10.12010/j.issn.1673-5846.2016.09.001
1复旦大学公共卫生学院、上海卫生发展研究中心,上海 200032
2北京精神卫生研究所、北京大学第六医院,北京 100083
3 Creativ-Ceutical, Paris, France
4 University of Marseille, France
5 Lundbeck Singapore Ltd., Singapore, Singapore
胡善联,教授。邮箱:Hushanlian@hotmail.com

