多孔介质含水率变化对洛克沙胂的希瓦氏菌生物转化影响
柯正辰 辛梓 肖雅玲
摘要 作为一种广泛使用的饲料添加剂,洛克沙胂经由畜禽粪便进入环境,产生潜在的砷污染。自然环境中,降雨变化具有时空分布不均匀性,导致土壤含水率时刻发生变化,从而对洛克沙胂的生物转化产生影响。本研究选取自然界中常见的奥奈达湖希瓦氏菌(Shewanella oneidensis MR-1)为模型微生物,利用多孔介质石英砂作为模拟土壤的介质,研究洛克沙胂在不同含水率情形下的生物转化情况。研究结果表明,含水率的变化对于洛克沙胂的生物转化过程影响明显。在低含水率的条件下(12.50%),洛克沙胂难以被希瓦氏菌转化;而当含水率提升后,洛克沙胂才能够被S.oneidensis MR-1转化。通过砷平衡分析可以看出3-氨基-4-羟基苯胂酸为洛克沙胂生物转化的唯一产物,未检测出无机形态砷。
关键词 洛克沙胂;希瓦氏菌;含水率;多孔介质;生物转化
中图分类号 X53 文献标识码 A 文章编号 1007-5739(2016)05-0209-03
Abstract Roxarsone,one of wildly used animal additives,will enter in environment via the manure of poultry or livestocks,resulting in potential arsenic pollution risks.Due to the space-time heterogeneity of rainfall,soil moisture content fluctuated constantly,consequently influencing roxarsone biotransformation process.In this study,Shewanella oneidensis MR-1 and quartz sand were selected to represent as model bacteria and simulated medium,respectively,and the biotransformation process of roxarsoneat various moisture content were investigated.Results showed that moisture content remarkably affected roxarsone biotransformation.At low moisture content(12.50%),roxarsone was hardly transformed.While moisture content elevated,the majority of roxarsone could be reduced to HAPA as the sole product.Meanwile,no inorganic arsenic could be dectected.
Key words roxarsone;Shewanella oneidensis MR-1;moisture content;porous media;biotransformation
洛克沙胂(Roxarsone,3-硝基-4-羟基苯胂酸),因可促生长、抑制寄生虫、使皮毛光滑以及提高喂食效率和产蛋率,近几十年来作为畜禽饲料添加剂被广泛应用[1-8],我国肉鸡饲养业每年排放到环境中的洛克沙胂及其代谢物约1 000 t,加上养猪业,排放量更高[9]。洛克沙胂本身是一种低毒性的有机胂制剂,会被畜禽以原形排到自然环境中,但暴露在自然环境或者堆肥过程中的洛克沙胂则有可能转化成高毒性形态的砷化物,产生砷污染危害[10-13]。洛克沙胂在自然环境中主要转化为三价砷化物、五价砷化物、一甲基胂酸(DMA)、二甲基胂酸(MMA)以及3-氨基-4-羥基苯胂酸(HAPA),其中三价砷化物毒性最高,对环境危害巨大[5,11-14]。
希瓦氏菌(S.oneidensis MR-1)是一种兼性厌氧菌,在土壤、海洋和其他水体中广泛存在,最适生长温度一般在25~40 ℃之间[15],能在厌氧条件下利用多种电子受体,包括铁(Ⅲ)、硝酸盐、亚硝酸盐和重金属离子等,进行产能代谢和电子传递[16]。在自然土壤中,由于降雨的时空不均匀性,其含水率时刻发生变化,对生存其中的土壤微生物产生巨大影响。因此,研究含水率的变化对于深刻理解洛克沙胂的生物转化过程至关重要。本文利用多孔介质石英砂作为模拟土壤的介质,选取了奥奈达湖希瓦氏菌(Shewanella oneidensis MR-1)作为模型微生物,研究其在不同含水率情形下的转化过程,明确洛克沙胂在土壤中的生物转化机理。
1 材料与方法
1.1 试验菌种培养
S.oneidensis MR-1(MCCC 1A01706)细菌由中国海洋微生物菌种保藏管理中心提供,冻干管中的菌种经活化后使用。将菌种置于LB培养基中,在30 ℃下避光静置培养至对数生长期,菌体在高速离心机(Eppendorf,5810R)中以90 000×g离心10 min后收集,用经灭菌的基础试验培养基重复洗涤3次、重悬。整个试验中所用的基础培养基为50 mmol/L碳酸氢钠缓冲培养基[17]。基础培养基使用之前置于121 ℃高压灭菌锅中灭菌20 min,冷却后加入30 mmol/L乳酸盐,并调pH值为7.0。
1.2 多孔介质的制备
在整个试验中,石英砂(270 μm)作为多孔介质,用去离子水洗涤3次,105 ℃烘干备用。石英砂使用之前用121 ℃高压灭菌锅中灭菌20 min。
1.3 试验方法
本试验在灭菌过的50 mL离心管中进行,每个离心管中分装4 g石英砂。通过称重法,测得这4 g石英砂的饱和含水率为40.25%。为了研究从干燥到饱和含水率之间不同情况,本试验设置含水率梯度为12.50%、25.00%、35.00%、40.25%、100.00%。将重悬的细菌液与培养基以及洛克沙胂(纯度>99%,Sigma-Aldrich)混合均匀,保证细菌浓度、乳酸盐浓度和洛克沙胂浓度分别为8.0×106 cells/mL,50 mmol/L和1 mmol/L。分别向离心管中加入不同份量以上混合液,控制含水率水平。分别在0、20、35、85 h进行采样分析。该试验在厌氧条件下避光完成,控制温度为(30.0±0.5)℃。所有试验均设置3个平行样,样品使用同样的方法进行测试分析。
1.4 样品提取
取每个时间点的离心管,加入磷酸盐缓冲溶液(0.1 mol/L的H3PO4溶液和0.1 mol/L的NaH2PO4·2H2O溶液以1∶9的体积比混合)20 mL,放入超声震荡器中超声震荡4 min,取上清液3 mL,用分光光度计测定其吸光度计算生物量。剩余样品经55 ℃水浴加热10 h,然后在10 000×g下离心5 min取上清液过0.22 μm水系微孔滤膜,放入4 ℃冰箱待测[8,12]。
1.5 生物量的测定
本试验的细菌生物量由紫外分光光度计(UV-2600,Unico Instrument Co.,Ltd.)以及吖啶橙荧光染色计数法确定[18]。吖啶橙荧光染色之后的菌液滤过0.2 μm的黑色聚碳酸酯滤膜(Whatman,25 mm diameter),将滤膜固定在载玻片上,在激光共聚焦显微镜(FV1000,Olympus Co.,Japan)下镜检计数,整个试验过程在暗室中进行,尽量避光以防荧光淬灭[19]。并与菌液在600 nm下测得的吸光度呈对应关系,做成标准曲线。试验中的样品测得吸光度后可参照标准曲线得到细菌的生物量。
1.6 分析方法
洛克沙胂和HAPA的浓度由高效液相色谱仪(HPLC 1260,Agilent Technology)测定,使用的色谱柱为Elite Hyper-silODS2 column(4.6 mm× 150 mm,5 μm),用纯净水配置10 mmol/L磷酸二氢钾溶液pH值调至7.2作为流动相,流速为1.0 mL/min,进样量为10.0 μL,洛克沙胂和HAPA的检测波长分别为450 nm和300 nm,柱温设置为(30.0±0.5)℃[8]。
包括三价砷化物、无价砷化物在内的无机砷检测由高效液相色谱-氢化物发生-原子荧光联用技术(HPLC-HG-AFS)得到,试验方法参考Huang等[12]的方法。
乳酸盐浓度的测定由高效液相色谱仪(HPLC 1260,Agilent Technology)测定,使用的色谱柱为CNW Sep H-M column(4.6 mm×250 mm,5 μm),流动相为用纯净水和优级纯硫酸配置的2.5 mmol/L硫酸溶液,流速为0.25 mL/min,进样量为2.0 μL,检测波长为210 nm,柱温保持在为(55.0±0.5)℃[20]。
2 结果与分析
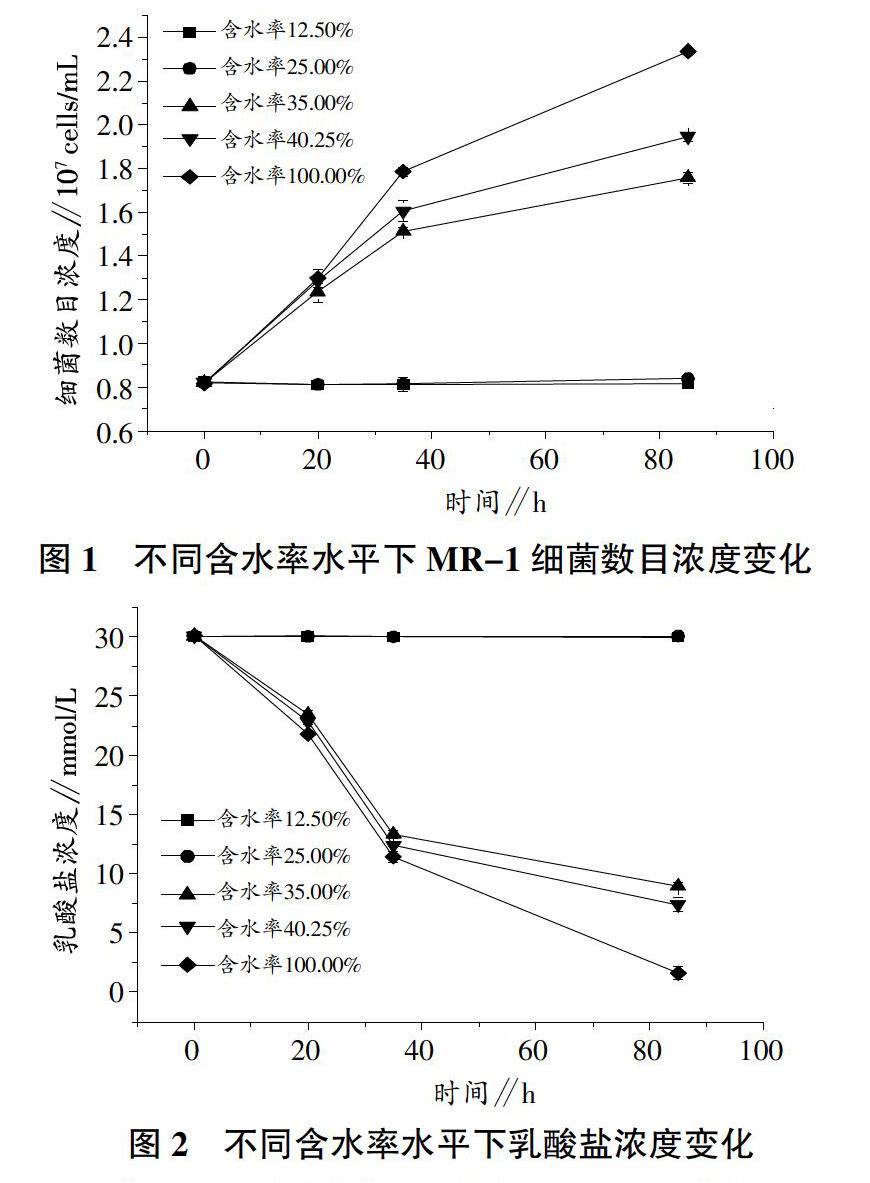
2.1 含水率变化对希瓦氏菌生物量的影响
从图1中可以看出,整个试验过程中,含水率水平在12.50%和25.00%的试验组细菌数目几乎没有变化,维持在初始浓度水平,说明该含水率水平不足以提供希瓦氏菌生长繁殖所必须的水环境。而当试验含水率提高到35.00%以上时,细菌数量则优明显增长。在试验进行到20 h时,含水率为35.00%的试验组细菌数目达到1.23×107 cells/mL;饱和含水率40.25%以及100%含水率水平组中细菌数目浓度接近,达到1.29×107 cells/mL左右。
随着试验时间延长,不同含水率水平试验组中细菌数目差距变大,含水率水平高的细菌生物量大,含水率水平低的细菌生物量小。在饱和含水率40.25%以及含水率100.00%的2组,由于后者能给试验菌种提供更好的水环境,导致了细菌数目上的差距增大。
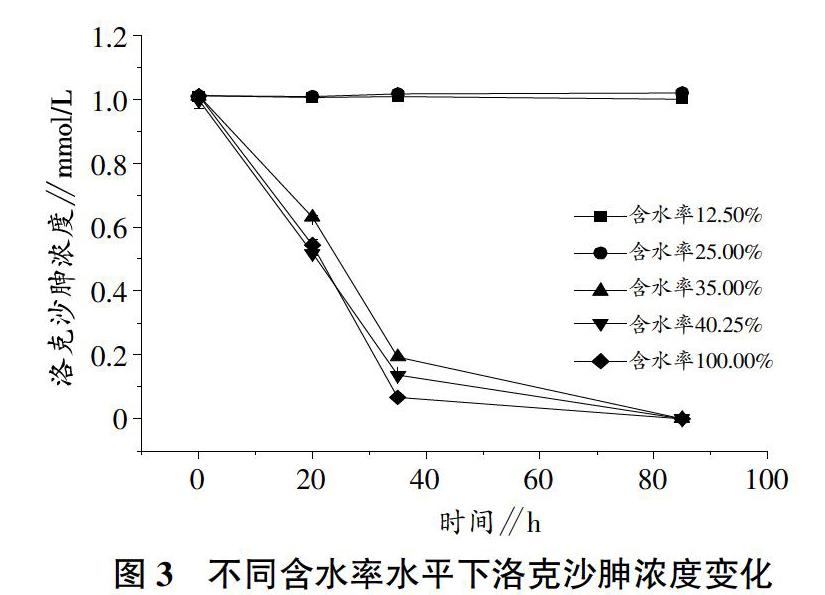
2.2 含水率变化对底物乳酸盐的影响
乳酸盐在试验中为细菌生长繁殖提供碳源,同时提供希瓦氏菌还原洛克沙胂所需要的电子,从图2中可以看出,试验中乳酸盐的变化情况。与细菌生物量变化规律类似,在含水率水平为12.50%和25.00%的试验组中乳酸盐几乎没有被利用,一直保持在30 mmol/L左右,这与2组试验中细菌数量没有增长相互印证。
在含水率较高的试验组中,乳酸盐被作为碳源以及电子供体消耗,其消耗量变化趋势与细菌数目增长的量呈相对应的关系。试验终止时,含水率35.00%的试验组中,乳酸盐的含量为8.95 mmol/L;含水率上升到40.25%时,乳酸盐含量下降到7.39 mmol/L。当含水率增大到100.00%时,乳酸盐含量最低,为1.60 mmol/L。乳酸盐被消耗多的试验组试验终止时对应的细菌数目含量也是最多的。
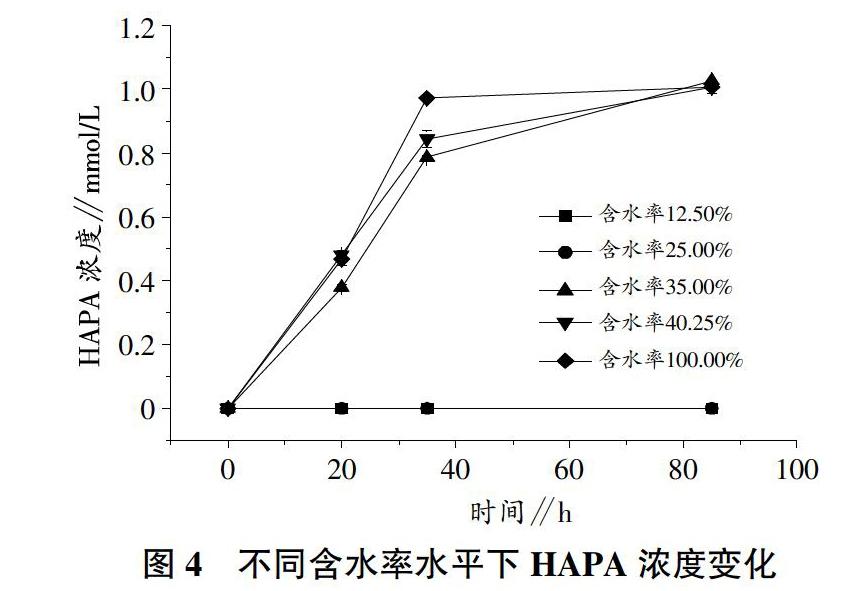
2.3 含水率水平对洛克沙胂生物转化的影响
含水率水平明显会影响到多孔介质中希瓦氏菌转化洛克沙胂,从图3中可以看出,含水率在12.50%和25.00%時,洛克沙胂基本维持在初始添加的浓度(1.0±0.1)mmol/L,没有被希瓦氏菌所转化。当含水率逐步提高后,洛克沙胂转化效率逐步提高。在试验开始后的20 h,含水率水平35.00%、40.25%和100.00%试验组的洛克沙胂浓度分别下降为0.63、0.52、0.54 mmol/L。相对而言,含水率水平为35%的试验组中洛克沙胂转化率较低,而饱和含水率40.25%以及100.00%含水率水平组中洛克沙胂转化程度相近。这是由于在饱和含水率40.25%和100.00%含水率2组中细菌增长数目相近(图1),而且有足够的水环境供希瓦氏菌转移电子。在试验进行到35 h,含水率35.00%、40.25%和100.00%水平组的洛克沙胂含量进一步降低到0.19、0.13、0.06 mmol/L。结果表明,含水率水平能够显著影响洛克沙胂的转化过程,并且其转化率随着含水率的增高而增高。洛克沙胂的生物转化过程与因为在该时刻不同含水率水平下希瓦氏菌的细菌量是不一样的(图1),因此能有效转移给洛克沙胂的电子量不一样,从而洛克沙胂被还原的量有所差别。在试验终止时,除了含水率水平在12.50%和25.00%的试验组,洛克沙胂均已完全转化。
2.4 不同含水率条件下HAPA的生成情况
在整个试验过程中,HAPA浓度如图4所示,样品在高效液相色谱-氢化物发生-原子荧光联用技术(HPLC-HG-AFS)检测中并没有发现除了洛克沙胂和HAPA以外其他形态的砷存在。
從图4中可以发现,含水率为12.50%和25.00%的试验组中没有检测到HAPA的存在。随着试验进行,在第20 h,35.00%、40.25%、100.00%含水率水平的试验组中HAPA浓度分别为0.37、0.48、0.46 mmol/L,含水率水平为35.00%的试验组中HAPA浓度较低,而饱和含水率40.25%以及100.00%含水率水平组中HAPA浓度相近。在试验进行到35 h,含水率35.00%、40.25%和100.00%水平组的HAPA浓度进一步增加到0.78、0.87、0.94 mmol/L,结果表明含水率越高,洛克沙胂还原率越高。在试验终止时,除了含水率水平在12.50%和25.00%的试验组,HAPA浓度均在(1.0±0.1)mmol/L。对比2.3中洛克沙胂的试验数据,洛克沙胂和HAPA的浓度符合砷的平衡,即在试验条件下,洛克沙胂完全转化为HAPA。
3 结论
针对不同含水率情形下希瓦氏菌对洛克沙胂的生物转化研究整个试验中得到的数据分析研究,得出以下结论:①多孔介质中含水率能明显影响希瓦氏菌转化洛克沙胂,只有到达一定含水率水平,足够提供希瓦氏菌生长繁殖以及转移电子的水环境,洛克沙胂才能够被希瓦氏菌所转化,该临界值可以通过试验来确定。②在洛克沙胂能够被希瓦氏菌所转化的含水率条件下,含水率越高,洛克沙胂被转化的效率越高。③在试验条件下,洛克沙胂被转化后的产物全为HAPA,没有检测到其他形态的砷化物。
4 参考文献
[1] ARAI Y,LANZIROTTI A,SUTTON S,et al.Arsenic speciation and reac-tivity in poultry litter[J].Environmental Science and Technology,2003,37:4083-4090.
[2] CHAPMAN H D,JOHNSON Z B.Use of antibiotics and roxarsone in broiler chickens in theUSA:analysis for the years 1995 to 2000[J].Poultry Science,2002,81:356-364.
[3] BEDNAR A J,GARBARINO J R,FERRER I,et al.Photodegradation of roxarsone in poultry litter leachates[J].Science of the Total Environment.Page 14 of 27ACS Paragon Plus Environment Environmental Science & Technology,2003,302:237-245.
[4] CORTINAS I,FIELD J A,KOPPLIN M,et al.Anaerobic biotransformation of roxarsone and related N-substituted phenylarsonic acids-environmental science and technology[J].American Chemical Society,2006,40:2951-2957.
[5] STOLZ J F,PERERA E,KILONZO B,et al.Biotransformation of 3-nitro-4-hydroxybenzenearsonic acid(roxarsone)and release of inorganic arsenic by Clostridium species[J].Environmental Science and Technology,2007, 41:818-823.
[6] MESTROT A,XIE W Y,XUE X,et al.Arsenic volatilization in model anaerobic biogas digesters[J].Applied Geochemistry,2013,33:294-297.
[7] LIU H,WANG G,GE J,et al.Fate of roxarsone during biological nitrogen removal process in wastewater treatment systems[J].Chemical Engineering Journal,2014,255:500-505.
[8] LIANG T,KE Z,CHEN Q,et al.Degradation of roxarsone in a silt loam soil and its toxicity assessment[J].Chemosphere,2014,112:128-133.
[9] YAO L X,HUANG L X,HE Z H,et al.Occurrence of arsenic impurities in organoarsenics and animal feeds[J].Journal of Agricultural & Food Chemistry,2013,61:320-324.
[10] GARBARINO J R,BEDNAR A J,RUTHERFORD D W,et al.Environ-mental fate of roxarsone in poultry litter.I.Degradation of oxarsone during composting[J].Environmental Science and Technology,2003,37:1509-1514.
[11] YAO L X,LI G L,DANG Z,et al.Arsenic speciation in turnip as affected by application of chicken manure bearing roxarsone and its metabolites[J].Page 15 of 27ACS Paragon Plus Environment Environme-ntal Science & Technology Plant Soil,2009,316:117-124.
[12] HUANG L X,YAO L X,HE Z H,et al.Uptake of arsenic species by turnip(Brassica rapa L.)and lettuce(Lactuca sativa L.)treated with roxarsone and its metabolites in chicken manure[J].Food Additives & Contaminants Part A Chemistry Analysis Control Exposure & Risk Assessment,2013,30:1546-1555.
[13] HUANG L,YAO L,HE Z,et al.roxarsone and its metabolites in chicken manure significantly enhance the uptake of As species by vegetables[J].Chemosphere,2014,100:57-62.
[14] GUO Q,LIU L,HU Z,et al.Biological phosphorus removal inhibition by roxarsone in batch culture systems[J].Chemosphere,2013,92:138-142.
[15] HAU H H,GRALNICK J A.Ecology and biotechnology of the genus Shewanella[J].Annual Review of Microbiology,2007,61:237-258.
[16] FREDRICKSON J K,ROMINE M F,BELIAEV A S,et al.Towards environmental systems biology of Shewanella[J].Nature Reviews Microb-iology,2008,6:592-603.
[17] CAMPBELL K M,DAVIN M,SALTIKOV C W,et al.Simultaneous microbial reduction of iron(III)and arsenic(V)in suspensions of hydrous ferric oxide[J].Environmental Science & Technology,2006,40(19):5950-5955.
[18] GRAHAM A G,ROBIN M S.An efficient biofilm removal method for bacterial cells exposed to drinking water[J].Journal of Microbiological Methods,1999,34(98):203-214.
[19] BOULOS L,PREVOST M,BARBEAU B,et al.Desjardins R.LIVE/DEAD(R)BacLightTM:application of a new rapid staining method for direct enumeration of viable and total bacteria in drinking water[J].Journal of Microbiological Methods,1999,37(1):77-86.
[20] COATES J D,PHILLIPS E J,LONERGAN D J,et al.Isolation of Geoba-cter species from diverse sedimentary environments[J].Applied & Envir-onmental Microbiology,1996,62(5):1531-1536.

