高温处理对披碱草种子内生真菌的杀灭效果及发芽活力的影响
张蕊思,安沙舟,卡斯达尔·努尔旦别克,施 宠
(新疆农业大学草业与环境科学学院 新疆草地资源与生态重点实验室,新疆 乌鲁木齐 830052)
高温处理对披碱草种子内生真菌的杀灭效果及发芽活力的影响
张蕊思,安沙舟,卡斯达尔·努尔旦别克,施 宠
(新疆农业大学草业与环境科学学院 新疆草地资源与生态重点实验室,新疆 乌鲁木齐 830052)
为了寻求去除禾草内生真菌的方法,选用披碱草(Elymusdahuricus)为研究材料,以60、70和75 ℃高温分别处理披碱草种子5、10、15、20、25和30 d,研究不同强度高温对内生真菌和宿主活力的影响。结果表明,75 ℃处理20 d能快速有效杀灭披碱草种子的内生真菌,使种子带菌率从93.17%显著降到0(P<0.05),所有检测幼苗均不感染内生真菌;同时,发芽率、发芽势、发芽指数、活力指数和幼苗鲜重分别显著提高36.37%、73.94%、50.38%、63.38%和7.79%,且在幼苗生长初期对芽和根的生长有促进作用,芽长、根长分别增加0.54%和14.43%。故高温处理是一种理想的去除披碱草种子内生真菌的方法,同时这一方法也为探索获取不感染内生真菌其它禾草提供了理论依据。
内生真菌;高温处理;披碱草
禾草-内生真菌是指在禾草中度过全部或大部分生命周期,而禾草不显示外部症状的一大类真菌[1]。自然界中感染内生真菌的植物普遍存在,真菌和禾草共同形成互惠互利的共生体。目前,国际学术界公认内生真菌可以对宿主植物的生长产生正面影响[2]。禾草内生真菌能提高宿主植物对营养物质的利用效率,从而促进植物生长[3]。研究发现内生真菌(Epichloё)可以促进多年生黑麦草(Loliumperenne)[4]、布顿大麦(Hordeumbogdanii)[5]、圆柱披碱草(Elymuscylindricus)[6]和醉马草(Achnatheruminebrians)[7]的生长。另外,内生真菌在禾草体内产生的生物碱,致使采食带菌禾草的马、牛、羊、鹿等家畜产生中毒症状[8]。
披碱草(E.dahuricus)是禾本科披碱草属多年生、疏丛型、旱中生禾草[9]。披碱草耐旱、耐寒、耐碱、耐风沙,先后在河北、新疆、内蒙古、青海等省(区)的牧场、草原试验站进行过栽培驯化工作,被认定为优质高产的饲草。国外对披碱草内生真菌的研究主要是对加拿大披碱草(E.canadensis)和佛吉尼亚披碱草(E.virgincus)的带菌情况进行了调查[7],在我国最早关于内生真菌侵染披碱草的报道见于Nan和Li[6],在检测的3份披碱草样品中发现1份带菌,带菌率为100%。对披碱草所带Epichloё属内生真菌的生理生物学特性以及共生体的生长、光合速率、生理特性[10]和对水分胁迫的响应亦作了较系统的研究[11]。
为了阐明内生真菌对宿主植物的作用,首先必须获得内生真菌感染和非感染的试验植物种群。目前去除种子内生真菌的方法主要有杀真菌剂法[12]、湿热法[13]两种方法,然而,杀真菌剂的使用存在着农药残留、危害其它物种等一系列生态问题,且不能达到完全去除内生真菌的效果;湿热法虽能有效降低宿主内生真菌带菌率但也不能达到完全去除的效果,同时对宿主植物活力也产生了影响[13]。高温处理法[14]被证实是一种可以去除羽茅(Achnatherumsibiricum)种子内的内生真菌且对宿主植物无影响的方法,李夏等[14]研究发现,60 ℃高温处理能有效杀灭羽茅种子中的内生真菌,当处理时间达到30 d时,所有检测幼苗均不感染内生真菌。同时高温处理对种子发芽率、发芽势和发芽指数均无显著影响,且在幼苗生长初期对根的生长有促进作用。本研究在前人研究基础上采用60、70和75 ℃ 3个高温处理强度,通过比较不同处理时间条件下宿主植物内生真菌带菌率及其种子萌发率和活力指数,寻求既能完全有效去除宿主植物种子中内生真菌的活力,同时又对种子本身活力无影响且对环境友好的杀菌方法。
1 材料与方法
1.1试验材料
试验材料为披碱草,于2014年8月在新疆沙湾县鹿角湾(43°59′13″ N、85°10′22″ E)野外采集,经过镜检以及室内培养后检测带菌率均在93%以上,采集后存放于冰箱中4 ℃保存。每次从中选取大小一致、籽粒饱满、无破损的披碱草种子为研究对象。
1.2试验设计
在实验室进行预实验时发现80 ℃高温处理5 d后披碱草种子已经完全不能发芽,故试验所采用的最高处理温度为75 ℃。试验共设置3个温度梯度(60、70、75 ℃)和6个时间梯度(5、10、15、20、25、30 d),共18个处理,每个处理重复3次。将存放于冰箱中4 ℃保存的未经高温处理的种子作为对照(CK)。
1.3研究方法
1.3.1种子处理方法种子萌发和幼苗培养试验高温源为DHG-9240A电热恒温鼓风干燥箱(共计3台),额定电压220V-50Hz,输出功率2 470 W。研究采取高温和时间结合的方式,将试验种子从冰箱取出后均匀摆放在玻璃培养皿(直径为9 cm)正中央,后置于干燥箱中,温度过高可能影响种子的质量,可在进行高温处理前将种子的含水量降低到4%以下[15]。参照宋顺华和郑晓鹰[15]安全有效的阶梯式方法逐步将处理温度从35 ℃提高至目标温度,然后再进行阶梯式降温,即:首先将温度调节至35 ℃处理24 h,再调节温度至45 ℃处理24 h,后将温度调节至所需温度处理相应天数,最后降低温度至55 ℃处理24 h后,将种子从干燥箱中取出后置于4 ℃冰箱中保存,所有处理结束后进行萌发试验。
1.3.2种子发芽和幼苗培养试验采用SP X-300I-G型光照培养箱进行种子萌发。高温处理后及对照种子均用 50%硫酸软化颖壳30 min和次氯酸钠(有效氯浓度2%)表面消毒10~15 min,且浸泡过夜后整齐摆放于内置滤纸(提前用去离子水湿润)、直径9 cm的培养皿中,于25 ℃培养箱中黑暗萌发,7 d后设置光照/黑暗8 h/16 h,进行培养。每天对试验种子的发芽情况进行观察,并分别统计开始发芽时间和每天发芽数,以胚根长度超过2 mm视为发芽,连续4 d没有新的发芽种子后计算最终发芽率[16]。第12天时对萌发生长指标统计后,将培养皿中的萌发种子转移到180 mm×125 mm×150 mm的塑料花盆中进行培养,每天观察耗水状况并及时补加水、除杂草等。
1.3.3种子带菌率的检测达到预设温度处理后,对种子先进行预处理[17],后进行消毒处理[15],之后每个处理随机选取20粒种子等距离置于含有100 mg·L-1链霉素和100 mg·L-1氯霉素的马铃薯葡萄糖琼脂培养基(ABPDA培养基)上,每3个培养皿为一个重复,每个处理3次重复,30 d后统计菌落数并计算带菌率。过程中用到漂洗对照、印记(迹)对照、环境对照3种对照参照[17]。
1.3.4种子和幼苗带菌率的检测与验证在种子发芽结束后的第50天之后所有的幼苗均长出新的分蘖,对新生的分蘖逐株进行了镜检检测,镜检过程中若镜检出一个分蘖带菌则认为此植株带菌;同理,镜检过程中若未镜检出一个分蘖带菌则认为此植株不带菌。另外,为验证种子带菌率为0的处理组植株确实不带菌,我们还就对照组的幼苗和高温处理组幼苗的叶片和叶鞘进行了内生真菌的分离培养,以确保验证检测结果的准确性。叶片内生真菌的分离培养:取待检验新鲜叶片自来水冲洗4次后放入2%的次氯酸钠溶液中震荡5 min,然后至于超净工作中无菌水冲洗5次并切成约1 cm长的片段后进行内生真菌的分离工作,分离方法同种子内生真菌分离方法。镜检使用赵晓静等的光学显微镜法[18]。
1.4数据处理及计算方法
每天对试验种子的发芽情况进行观察,分别统计开始发芽时间和每天发芽数,并计算发芽率、发芽势、发芽指数和平均发芽天数等指标,披碱草种子的发芽率(germination rate,GR)、发芽势(germination potential,GP)、发芽指数(germination index,GI)、活力指数(vital index,VI),按照以下公式[19]计算:
发芽率=最终正常发芽的种子粒数/供试种子粒数×100%;
发芽势=在7 d内正常发芽的种子粒数/供试种子粒数×100%;
发芽指数(GI)=∑(Gt/Dt)。式中:Gt为在不同时间的发芽数;Dt为相应的发芽日数。
活力指数(VI)=GI×S。
式中:S为12 d内幼苗长度(mm),GI为发芽指数。
试验结束时,每重复随机选取10株,用精度0.01 mm的数显游标卡尺(日本Mitutoyo,型号500-173)测量胚芽长、胚根长,用精度为万分之一分析天平称取幼苗鲜重。
第30天时记录每皿带菌种子数并拍照,根据如下公式[20]计算种子内生真菌带菌率:
带菌率=(带菌种子数/检测种子总数)×100%。
1.5数据处理与统计分析
对所有数据利用 Excel 2007统计和整理,单因素方差分析和多重比较利用 SPSS 20.0软件,并将结果以平均值±标准误形式表示,最终结果采用 Excel 2007制图。
2 结果与分析
2.1高温处理对带菌率的影响
随着温度的升高和处理时间的延长,与对照相比,内生真菌带菌率显著下降(P<0.05)(图1),高温处理对内生真菌的抑制作用逐渐增强(图2)。带菌率随着温度升高而显著下降的速度由快到慢为75>70>60 ℃;随着处理天数的延长,带菌率也明显降低,其中,60 ℃处理30 d带菌率降低为12.5%;70 ℃处理20 d和75 ℃处理15 d后内生真菌带菌率分别降低到3.51%和2.78%;之后分别在25和20 d时内生真菌带菌率为0。
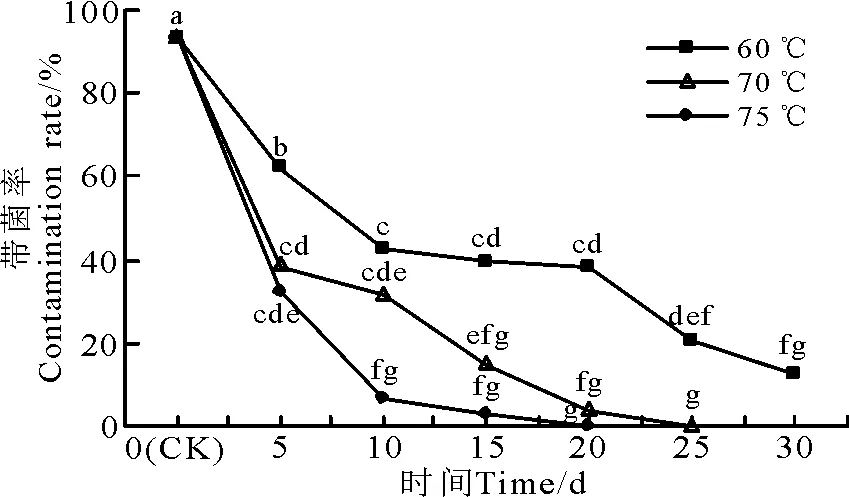
图1 不同处理温度下披碱草种子带菌率的变化Fig.1 Effects of high temperature pretreatment on theEpichloё contamination rate of E. dahuricus seeds
注:不同小写字母表示处理间差异显著(P<0.05)。图3同。
Note: Different lower case letter indicate significant difference at 0.05 level. The same in Fig.3.
2.2高温处理对种子萌发的影响
与对照相比,高温处理显著降低了种子含水量(P<0.05),60 ℃时种子含水量为3.82%~5.25%,各处理之间种子含水量无显著差异(P>0.05),但是均显著低于对照(表1);70 ℃时种子含水量为2.94%~3.31%,75 ℃时种子含水量为2.28%~3.58%。但70和75 ℃各处理时间之间无显著差异。

图2 75 ℃高温处理20 d下披碱草叶片中内生真菌带菌的变化Fig.2 The leaf of Epichloёof E. dahuricus treated by high temperature at 75 ℃ for 20 d表1 高温处理对种子萌发的影响Table 1 The effects of high temperature pretreatment on the germination of E. dahuricus seeds
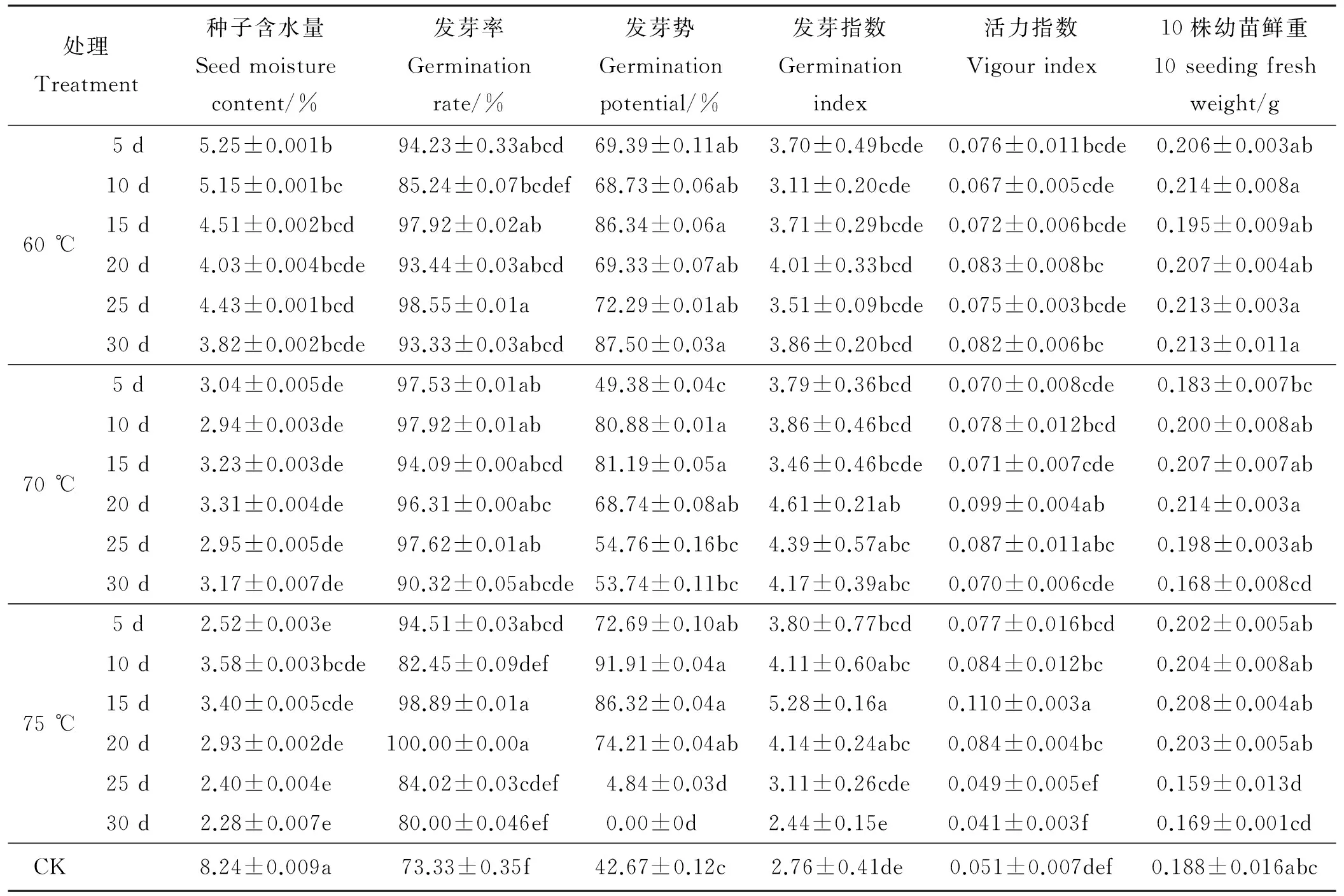
处理Treatment种子含水量Seedmoisturecontent/%发芽率Germinationrate/%发芽势Germinationpotential/%发芽指数Germinationindex活力指数Vigourindex10株幼苗鲜重10seedingfreshweight/g60℃5d5.25±0.001b94.23±0.33abcd69.39±0.11ab3.70±0.49bcde0.076±0.011bcde0.206±0.003ab10d5.15±0.001bc85.24±0.07bcdef68.73±0.06ab3.11±0.20cde0.067±0.005cde0.214±0.008a15d4.51±0.002bcd97.92±0.02ab86.34±0.06a3.71±0.29bcde0.072±0.006bcde0.195±0.009ab20d4.03±0.004bcde93.44±0.03abcd69.33±0.07ab4.01±0.33bcd0.083±0.008bc0.207±0.004ab25d4.43±0.001bcd98.55±0.01a72.29±0.01ab3.51±0.09bcde0.075±0.003bcde0.213±0.003a30d3.82±0.002bcde93.33±0.03abcd87.50±0.03a3.86±0.20bcd0.082±0.006bc0.213±0.011a70℃5d3.04±0.005de97.53±0.01ab49.38±0.04c3.79±0.36bcd0.070±0.008cde0.183±0.007bc10d2.94±0.003de97.92±0.01ab80.88±0.01a3.86±0.46bcd0.078±0.012bcd0.200±0.008ab15d3.23±0.003de94.09±0.00abcd81.19±0.05a3.46±0.46bcde0.071±0.007cde0.207±0.007ab20d3.31±0.004de96.31±0.00abc68.74±0.08ab4.61±0.21ab0.099±0.004ab0.214±0.003a25d2.95±0.005de97.62±0.01ab54.76±0.16bc4.39±0.57abc0.087±0.011abc0.198±0.003ab30d3.17±0.007de90.32±0.05abcde53.74±0.11bc4.17±0.39abc0.070±0.006cde0.168±0.008cd75℃5d2.52±0.003e94.51±0.03abcd72.69±0.10ab3.80±0.77bcd0.077±0.016bcd0.202±0.005ab10d3.58±0.003bcde82.45±0.09def91.91±0.04a4.11±0.60abc0.084±0.012bc0.204±0.008ab15d3.40±0.005cde98.89±0.01a86.32±0.04a5.28±0.16a0.110±0.003a0.208±0.004ab20d2.93±0.002de100.00±0.00a74.21±0.04ab4.14±0.24abc0.084±0.004bc0.203±0.005ab25d2.40±0.004e84.02±0.03cdef4.84±0.03d3.11±0.26cde0.049±0.005ef0.159±0.013d30d2.28±0.007e80.00±0.046ef0.00±0d2.44±0.15e0.041±0.003f0.169±0.001cdCK8.24±0.009a73.33±0.35f42.67±0.12c2.76±0.41de0.051±0.007def0.188±0.016abc
注:不同小写字母表示差异显著(P<0.05)。
Note:Different lower case letters indicate significant difference at 0.05 level.
高温处理提高了披碱草种子发芽率,促进了种子萌发。60 ℃时,随着处理天数的增加发芽率升高幅度高低不齐,但与对照相比整体呈现显著上升趋势(P<0.05)。70和75 ℃时,随着处理天数的增加发芽率呈现先降低后升高再降低的有规律的变化趋势,分别在处理10和20 d时发芽率达到最大值。20 d时的发芽率大小为75>70>60 ℃,但3个温度之间无显著差异(P>0.05);当处理天数超过25 d时,各温度的发芽率会出现不同程度的下降趋势,下降幅度大小为:75>70>60 ℃,但处理时间为30 d时,发芽率仍高于对照(表2)。这表明,在一定的高温处理强度范围内,低温长时或短时高温对发芽率有促进作用,随着处理强度的加大这种促进作用逐渐减弱。
60 ℃高温处理较对照显著(P<0.05)提高了种子发芽势,60 ℃各时间处理之间无显著差异(P>0.05),随着处理天数的延长,发芽势整体呈现上升变化趋势;70和75 ℃时,随着处理天数的增加发芽势呈现先升高后降低的变化趋势:70 ℃处理15 d发芽势最高;75 ℃处理10 d发芽势上升且达到最大值,但随着处理时间的延长,发芽势下降。幼苗鲜重也呈现类似的变化。
60 ℃时各处理发芽指数与对照无显著差异(P>0.05)。70 ℃时处理时间短于20 d时与对照无显著差异,超过20 d时则显著高于对照(P<0.05),此后,发芽指数随着处理时间的延长逐渐降低。75 ℃时,随着处理天数的增加发芽指数呈现先升高后降低的变化趋势:处理15 d时发芽指数显著增加且达到最大值(P<0.05)。活力指数也呈现类似的变化。
2.3高温处理对幼苗生长的影响
高温处理后芽长的变化(图3):60 ℃时芽长随处理天数的延长逐渐增长;70和75 ℃时,芽长随着处理时间的延长均出现先升高后降低的变化,处理15 d时芽长达到最大值。高温可以促进芽生长,这种促进作用的程度大小随温度的变化为60>70>75 ℃。
高温处理后根长的变化(图3):60 ℃时各处理的根长与对照相比都有所增加,无明显规律。70 ℃时根长随着处理时间的延长呈现先增加后降低的变化趋势,处理15 d时根长达到最大值。75 ℃时根长随着处理天数的延长也呈现先增加后降低的变化趋势,70 ℃处理5 d时根长达到最大值。
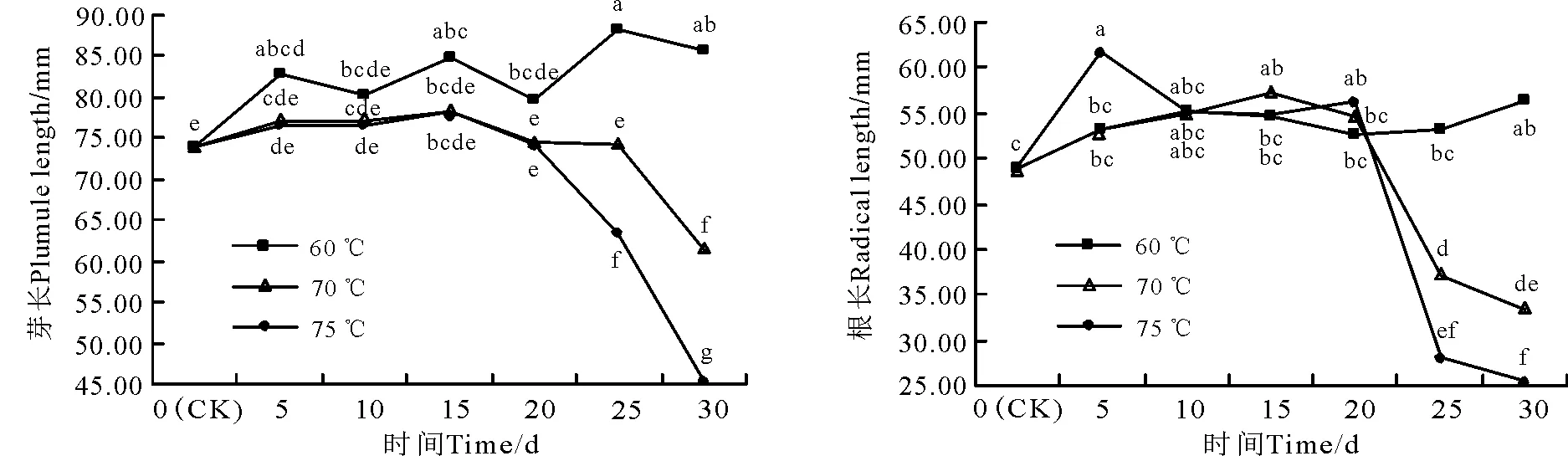
图3 不同高温处理强度下的幼苗芽长和根长Fig.3 The hypocotyls length and radical length of E. dahuricus seedlings treated by high temperature at different time
3 讨论
60 ℃时种子含水量为3.82%~5.25%,发芽率均高于对照,表明此区间种子含水量促进种子萌发。70 ℃时种子含水量为2.94%~3.31%,75 ℃时种子含水量为2.28%~3.58%。70 ℃处理10 d发芽率显著高于对照(P<0.05),20 d发芽率达到最大值,25和30 d时发芽率相比最大值有所下降但仍显著高于对照;75 ℃处理10 d发芽率显著高于对照(P<0.05),20 d发芽率达到最大值,30 d时发芽率有所下降但仍略高于对照(P>0.05),表明此区间种子含水量对发芽率无抑制作用。
本研究中60 ℃高温处理在所有处理时间内和70 ℃在处理时间≤25 d和75℃在处理时间≤20 d对披碱草种子的发芽率、发芽势、发芽指数和活力指数以及生物量均无影响且能提高发芽参数,说明适当的高温处理可以促进种子萌发,这与Dayamba等[21]发现热激对禾本科物种的发芽参数无负影响的结论是一致的。本研究发现,60 ℃处理时间≤30 d、70和75 ℃处理时间≤20 d对披碱草种子根长和芽长无影响且能促进芽长和根长,说明适当高温处理可以起到促进生长的作用,这与张百俊等[22]对西葫芦(Cucurbitapepo)种子进行不同温度和时间的干热处理时发现的高温处理能提高种子的发芽势并促进幼苗生长的结论是一致的。综合高温处理对披碱草种子活力影响来看,适当高温处理可以促进披碱草种子的萌发和幼苗的生长,这与李夏等[14]发现60 ℃高温处理羽茅种子对种子发芽率、发芽势和发芽指数均无显著影响且在幼苗生长初期对根的生长有促进作用的结论是一致的。
大量研究逐渐表明,环境条件对内生真菌的影响要大于对宿主的影响。不同储藏条件下,温度和种子含水量的控制对保持黑麦草(Loliumperenne)内生真菌的活力都是十分重要的,内生真菌比种子对高温更敏感[23]。在较低温度条件下内生真菌和种子的活力都较高,而在高温高湿条件下内生真菌和植物种子活力下降都很快,但对内生真菌的影响更大[24]。本研究中内生真菌的带菌率随着处理天数的延长或处理温度的增加而不断显著降低(P<0.05),75 ℃处理20 d时带菌率也已显著下降到0,所有检测幼苗以及分蘖均为无菌,而且对种子的发芽活力及生长均无影响,这说明适当高温处理是可以实现完全去除种子内的内生真菌而又不影响种子活力的目的。这与李夏等[14]研究发现60 ℃高温处理羽茅种子30 d能有效杀灭种子内的内生真菌的结论是相似的,本研究中60 ℃处理30 d能有效降低但并不能完全去除披碱草种子内的内生真菌,这可能与种子自身特性有关。董晓飞等[25]的研究也表明,干热处理既可在一定程度上杀灭表面菌又不影响种子的生活力。目前,国内去除禾草内生真菌的方法总结起来有杀菌剂法、水浴湿热法和高温干热法,姚祥等[26]研究甲基托布津和苯醚甲环唑两种内吸性杀菌剂对中华羊茅(Festucasinensis)种传内生真菌的影响时发现,甲基托布津稀释300~500倍浸泡种子8 h为剔除中华羊茅种传内生真菌的最佳方法;张金锋[13]研究结果表明,垂穗披碱草(E.nutans)种子60 ℃水浴20 min处理杀灭内生真菌效果较好,但由于其对发芽率的影响及种子活力的影响,该方法适用于种子量丰富的情况下。虽然前人也曾用高温干热法对种子内生真菌进行过去除试验,但试验中所采用温度过于单一,为了弥补这一缺点,本研究采用60、70和75 ℃3个温度进行5、10、15、20、25、30 d的持续高温时间,结果表明,75 ℃处理20 d能有效完全杀灭披碱草种子内生真菌而又不影响种子活力。
4 结论
本研究发现,75 ℃处理20 d能快速有效杀灭披碱草种子内的内生真菌,使带菌率降为0,所有75 ℃处理20 d的幼苗检测均为无菌,适当高温处理适当时间可以促进种子的萌发活力。所以,高温处理是一种有效杀灭披碱草种子内生真菌的方法,同时这一方法也为探索获取不感染内生真菌禾草提供了理论依据。
References:
[1]Siegel M R,Latch G C M,Bush L P,Fannin F F,Rowan D D.Fungal endophyte-infected grasses:Alkaloid accumulation and aphid response.Journal of Chemical Ecology,1990,16(12):3301-3315.
[2]张玉平.披碱草-内生真菌共生体生物学与生理学特性的研究.兰州:兰州大学博士学位论文,2007.
Zhang Y P.Biological and physiological characteristics ofElymusdahuricus-Heotyphodiumendophyte symbiont.PhD Thesis.Lanzhou:Lanzhou University,2007.(in Chinese)
[3]Malinowski D P,Alloush G A,Belesky D P.Leaf endophyteNeotyphodiumcoenophialummodifies mineral up take in tall fescue.Plant and Soil,2000,227:115-126.
[4]Latch G C M,Hunt W F,Musgrave D R.Endophytic fungi affect growth of perennial ryegrass.New Zealand Journal of Agriculture Research,1985,28:165-168.
[5]南志标.内生真菌对布顿大麦草生长的影响.草业科学,1996,13(1):16-18.
Nan Z B.Effects of acremonium endophyte on the growth ofHordeumbodganii.Pratacultural Science,1996,13(1):16-18.(in Chinese)
[6]Nan Z B,Li C J.Neotyphodiumin native grasses in China and observations on endophyte/host interactions.In:Paul V H,Dapprich P D.(eds).Proceedings of the 4th InternationalNeotyphodium/Grass Interactions Symposium.Germany Soest,2000:41-50.
[7]Vinton M A,Hopkins A A.Endophytic fungi in Canada wild rye in natural grasslands.Journal of Range Management,2001,54(4):390-395.
[8]南志标,李春杰.禾草-内生真菌共生体在草地农业系统中的作用.生态学报,2004,24(3):605-616.
Nan Z B,Li C J.Rose of the grass-Neotyhodiumassociation in pastoral agriculture systems.Acta Ecologica Sinica,2004,24(3):605-616.(in Chinese)
[9]徐瑞,南志标,周雁飞,李春杰.披碱草内生真菌共生体中麦角生物碱的组织分布与季节动态.草业学报,2012,21(3):84-92.
Xu R,Nan Z B,Zhou Y F,Li C J.Distribution and seasonal dynamics of ergot alkaloids inElymusdahuricus-endophytic fungus symbiont.Acta Prataculturae Sinica,2012,21(3):84-92.(in Chinese)
[10]Zhang Y P,Nan Z B.Germination and seedling anti-oxidative enzymes of endophyte-infected populations ofElymusduhuricusunderosmotic stress.Seed Science and Technology,2010,38:522-527.
[11]Zhang Y P,Nan Z B.Growth and anti-oxidative systems changes inElymusdahuriusis affected byNeotyphodiumendophyte under contrasting water availability.Journal of Agronomy Crop Science,2007,193:377-386.
[12]朱敏杰,张丽红,任安芝.用丙环唑杀除羽茅内生真菌.南开大学学报,2013,46(2):88-93.
Zhu M J,Zhang L H,Ren A Z.Eliminating the endophytic fungi inAchnatherumsibiricumby propiconazole.Acta ScientiarumNaturalium Universitatis Nankaiensis,2013,46(2):88-93.(in Chinese)
[13]张金锋. 水分胁迫下内生真菌对垂穗披碱草种内竞争的影响.兰州:兰州大学硕士学位论文,2013.
Zhang J F.Effects of fungal endophyte on intraspecific competition ofElymusnutansunder water stress.Master Thesis.Lanzhou:Lanzhou University,2013.(in Chinese)
[14]李夏,韩荣,任安芝,高玉葆.高温处理构建不感染内生真菌羽茅种群的方法探讨.微生物学通报,2010,37(9):1395-1400.
Li X,Han R,Ren A Z,Gao Y B.Using high-temperature treatment to construct endophyte-freeAchnatherumsibiricum.Microbiology China,2010,37(9):1395-1400.(in Chinese)
[15]宋顺华,郑晓鹰.干热灭菌处理技术——一种防治种传病害的有效方法.蔬菜,2008(10):41.
Song S H,Zheng X Y.Dry heat sterilization processing technology——An effective way of prevention and control of a kind of spread diseases.Vegetables,2008(10):41.(in Chinese)
[16]曾霞,王彦荣,胡小文.垂穗披碱草种子的萌发适宜温度及温度阈值.草业科学,2011,28(6):89-92.
Zeng X,Wang Y R,Hu X W.Research on seed germination optimum temperature and temperature threshold ofElymusnutans.Pratacultural Science,2011,28(6):89-92.(in Chinese)
[17]王志勇,刘秀娟.植物内生菌分离方法的研究现状.贵州农业科学,2014,42(1):152-155.
Wang Z Y,Liu X J.Research status on separation methods of plant endophytes.Guizhou Agricultural Sciences,2014,42(1):152-155.(in Chinese)
[18]赵晓静,王萍,李秀璋,古丽君,李春杰.内生真菌在禾草体内的分布特征.草业科学,2015,32(8):1206-1215.
Zhao X J,Wang P,Li X Z,Gu L J,Li C J.Distribution characteristics ofEpichloё endophyte in Gramineous grasses.Pratacultural Science,2015,32(8):1206-1215.(in Chinese)
[19]葛庆征,张卫国,张灵菲,卫万荣.温度对垂穗披碱草种子萌发的影响.草业科学,2012,29(5):759-767.
Ge Q Z,Zhang W G,Zhang L F,Wei W R.Effects of temperature on the germination ofElymusnutansseeds.Pratacultural Science,2012,29(5):759-767.(in Chinese)
[20]孔瑞芳.苏丹草(Sorghumsudanense)种带真菌及其防治.兰州:兰州大学硕士学位论文,2009.
Kong R F.Seedborne fungi of sudangrass (Sorghumsudanense) and their control.Master Thesis.Lanzhou:Lanzhou University,2009.(in Chinese)
[21]Dayamba S D,Tigabu M,Sawadogo L,Oden P C.Seed germination of herbaceous and woody species of the Sudanian savanna-woodland in response to heat shock and smoke.Forest Ecology & Management,2008,256(3):462-470.
[22]张百俊,杨和连,陈碧华,陈英照.干热处理对西葫芦种子发芽及幼苗生长的影响.甘肃农业大学学报,2006,41(3):132-134.
Zhang B J,Yang L H,Chen B H,Chen Y Z.Effects of dry heat treatment on seed germination and seedling growth of summer squash.Journal of Gansu Agricultural University,2006,41(3):132-134.(in Chinese)
[23]Rolston M P,Hare M D,Moore K K,Christensen M J.Viability ofLoliumendophyte fungus in seed stored at different moisture contents and temperatures.New Zealand Journal of Experimental Agriculture,1986,14(3):297-300.
[24]Gundel P E,Martínez-Ghersa M A,Garibaldi L A,Ghersa C M.Viability ofNeotyphodiumendophytic fungus and endophyte-infected and noninfectedLoliummultiflorumseeds.Botany,2009,87(1):88-96.
[25]董晓飞,李明,姜英,郭春莲,姚勇.干热处理对番茄种带病菌的防治效果.山西农业科学,1998,26(1):49-51.
Dong X F,Li M,Jiang Y,Guo C L,Yao Y.The study of control effect of dry-heat treatment on the seed carried fungi and bacteria in tomato.Journal of Shanxi Agricultural Sciences,1998,26(1):49-51.(in Chinese)
[26]姚祥,李秀璋,朱小晓,李春杰.两种杀菌剂对中华羊茅种传内生真菌的影响.草业科学,2013,30(10):1517-1522.
Yao X,Li X Z,Zhu X X,Li C J.Effects of two fungicides onNeotyphodiumseed-borne fungal endophyte ofFestucasinensis.Pratacultural Science,2013,30(10):1517-1522.(in Chinese)
(责任编辑苟燕妮)
Effects of high temperature treatments on viability ofEpichloё seeds ofElymusdahuricus
Zhang Rui-si, An Sha-zhou, Kasidaer·Nuerdanbieke, Shi Chong
(College of Pratacultural and Environmental Science, Xinjiang Agricultural University, Key Laboratory of Grassland Resources and Ecology of Xinjiang, Urumqi, Urumqi 830052, China)
In the present study,high temperature treatments (60, 70 and 75 ℃) was employed to constructEpichloё-free populations ofElymusdahuricus. The results indicated that high temperature treatments can killEpichloё endophyte in the seeds. After 75 ℃ for 20 days treatment,theEpichloё endophyte infected rates significantly dropped from 93.17% to 0% (P<0.01), and the germination rate,germinating potential, germination index, vital index and seeding fresh weight ofE.dahuricusincreased by 36.37%, 73.94%, 50.38%, 63.38% and 7.79%, respectively(P<0.05). Meanwhile, high temperature improved hypocotyls and radical growth and the hypocotyls and radical length of the treated seedlings increased by 0.54% and 14.43%. Therefore, high temperature of 75 ℃ treatment was an effective way to constructEpichloё-free populations ofE.dahuricuswhich provided some academic bases and references for establishingEpichloё-free populations of grass.
Epichloё; high temperature treatment;Elymusdahuricus
An Sha-zhouE-mail:xjasz@126.com
10.11829/j.issn.1001-0629.2015-0588
前植物生产层
2015-10-26接受日期:2016-06-13
新疆农业大学草业科学国家重点学科博士研究生创新基金(XJCYB-2011-01);高等学校博士学科点专项科研基金(20126504110001);新疆自治区研究生教育创新计划科研创新项目(XJGRI2015092)
张蕊思(1989-),女,河南商丘人,在读硕士生,研究方向为草地资源与生态。E-mail:787055914@qq.com
安沙舟(1956-),陕西富平人,教授,博导,博士,研究方向为草地资源与生态。E-mail:xjasz@126.com
S330.3;S432.4+3;Q945.35
A
1001-0629(2016)9-1651-07*
张蕊思,安沙舟,卡斯达尔·努尔旦别克,施宠.高温处理对披碱草种子内生真菌的杀灭效果及发芽活力的影响.草业科学,2016,33(9):1651-1657.
Zhang R S,An S Z,Kasidaer·Nuerdanbieke,Shi C.Effects of high temperature treatments on viability ofEpichloё seeds ofElymusdahuricus.Pratacultural Science,2016,33(9):1651-1657.

