百合鳞茎休眠解除过程中差异蛋白表达分析
刘 芳,田忠平,于明斌,张 雨,蔡英杰,周蕴薇
(1.东北林业大学园林学院,黑龙江 哈尔滨 150040; 2.黑龙江八一农垦大学农学院,黑龙江 大庆 163319;3.大连森林动物园,辽宁 大连 116013)
百合鳞茎休眠解除过程中差异蛋白表达分析
刘 芳1,2,田忠平1,于明斌3,张 雨1,蔡英杰1,周蕴薇1
(1.东北林业大学园林学院,黑龙江 哈尔滨 150040; 2.黑龙江八一农垦大学农学院,黑龙江 大庆 163319;3.大连森林动物园,辽宁 大连 116013)
通过低温处理打破细叶百合(Liliumpumilum)鳞茎休眠,利用荧光差异凝胶电泳和质谱技术,借助生物信息学分析手段,分析百合鳞茎休眠解除过程中蛋白质组的变化,以期进一步理解百合鳞茎休眠机制奠定基础。结果表明,分离得到31个差异表达蛋白点;相对于休眠鳞茎,休眠解除鳞茎中上调表达的蛋白点有15个,下调表达的蛋白点有16个;应用MS质谱成功鉴定12个差异蛋白点,按功能划分为6类,主要为胁迫类蛋白,可能涉及鳞茎内物质的代谢过程,进而调控鳞茎的休眠解除;根据细叶百合鳞茎休眠解除过程中差异蛋白表达谱比较,获得了几种与鳞茎休眠相关的蛋白质,鳞茎休眠时胁迫类蛋白高表达,休眠解除时蛋白水解酶类高表达。
细叶百合;鳞茎;休眠;蛋白质组
百合(Lilium)是世界上重要的切花,在抗性育种及园林应用方面都是宝贵的资源。由于其鳞茎具有生理休眠的特性,收获后必须在冷库中贮藏2~3个月才能打破休眠。未解除休眠的鳞茎种植后会严重影响种球和切花的质量,从而影响百合切花的周年生产和供应,因此,百合鳞茎休眠机理的研究获得了人们广泛的关注。目前,国内外关于百合鳞茎休眠的研究主要集中在休眠解除过程中生理生化变化和形态解剖的研究上,而分子水平的研究只见马春莲[1]关于低温解除麝香百合(L.longiflorum)鳞茎休眠过程中差异表达基因的报道。植物休眠的诱导、维持及解除是一个复杂的生物学过程,涉及众多代谢相关、激素调控、信号转导等基因的活化和互作[2-3]。大量研究表明,植物在休眠期和休眠解除时期存在差异表达基因,相同基因在植物的不同发育阶段的表达量也存在差异[4-5]。笔者从细叶百合鳞茎外部形态和生物量的变化及鳞茎内部细胞组织超微结构方面[6]进行了系统的研究,在确定鳞茎休眠进程的基础上,构建了百合鳞茎休眠解除过程的抑制差减cDNA文库,获得了大量与休眠调控相关的基因[7]。蛋白质在植物休眠解除及球根萌发成苗的过程中起着重要的作用,调控着植物的各种生理生化反应和新陈代谢过程,百合鳞茎休眠既受外界环境因素如鳞茎的生长条件、贮藏温度、湿度及光周期等的影响,也受内在遗传因子如休眠过程中碳化物的转变、激素水平、自由基的积累及细胞结构的损伤等的影响[8]。前人已成功鉴别并克隆出许多休眠诱导及破除休眠的特异基因[9-12]。然而,基因表达的中间产物mRNA水平的研究并不能取代蛋白质水平的研究,mRNA表达水平与蛋白质表达丰度并不具有绝对的相关性,比较蛋白质组学是在蛋白层面上研究生物的生理活动,对蛋白质结构和功能的研究将直接阐明生物的生理变化以及揭示基因表达调控机制[13]。本研究在前期研究百合鳞茎休眠解除过程及其机理的基础上,利用现代的蛋白质组学研究技术,直接比较鳞茎休眠解除及萌发过程中蛋白质组的变化差异,旨在为进一步寻找编码百合鳞茎休眠调控特异蛋白的基因提供依据,为全面了解百合鳞茎休眠的调控机制提供参考信息。
1 材料与方法
1.1供试材料及取样
于2013年10月中旬采收东北林业大学花圃中引种的细叶百合(L.pumilum)休眠鳞茎,5 ℃冰箱中冷藏处理,冷藏介质为珍珠岩。取贮藏0 d休眠鳞茎和低温贮藏60 d解除休眠鳞茎经液氮速冻后,置于-80 ℃超低温冰箱保存备用。
1.2试验方法
1.2.1蛋白的提取及定量取休眠鳞茎、解除休眠鳞茎分别在液氮中充分研磨后,加入样本体积3倍的丙酮溶液,混匀后在-20 ℃的温度下沉淀,过夜,4 ℃高速离心1 h,预冷丙酮清洗沉淀,然后沉淀进行真空冷冻干燥。室温裂解蛋白干样,每100 μg干样加500 μL裂解液(7 mol·L-1Urea,2 mol·L-1Thiourea,4%CHAPS,40 mmol·L-1Tris-Base),超声离心1 h,保留上清。纯化后定量。
1.2.2双向电泳每样品各取50 μg蛋白质,按照试剂盒(CyDye DIGE Fluor minimal labeling kit)使用说明进行荧光标记,标记后的蛋白用于后续的双向电泳试验。
将Cy2、Cy3和Cy5标记的样品混合,加同等体积2×sample buffer。加一向电泳水化液。混合溶液置入Holder,放入胶条(pH 4~7)。设置等电聚焦参数:30 V,12 h;100 V,1 h;1 000 V,1 h;梯度升压,电流控制在50 μA/胶条。等电聚焦后在平衡液1和平衡液2中各平衡15 min。润洗胶条后移到第二向12.5% SDS-PAGE胶上,琼脂糖封顶,进行第二向电泳,设定参数。
1.2.3DIGE凝胶的扫描选择波长488、530和633 nm。扫描荧光图像,所得图像用DecyderTMDifferentialin-gel Analysis Version 7.0凝胶分析软件分析差异蛋白。
1.2.4胶内酶解及质谱分析制作一块制备胶,考马斯亮蓝染色后挖取差异蛋白质点,置于离心管中,用超纯水冲洗后加入100 μL脱色液(100 mmol·L-1NH4HCO3/30%ACN)脱色去上清,加入100% ACN 100 μL,温和震荡5 min,吸弃,净置待乙腈完全挥发。加入胰酶2 μL,4 ℃保存1 h,加30 μL NH4HCO3,37 ℃过夜,离心后取胰酶液,剩余加入0.1% TFA100 μL,超声10 min后取管内溶液,合并所吸取液体,冷冻干燥至10 μL,纯化后点靶。进行二级质谱分析并鉴定蛋白质。
1.2.5差异蛋白调控功能分析利用NCBI数据库和UniProt数据库提供的蛋白功能注释和相关文献信息,将质谱鉴定得到的差异表达蛋白进行功能比对。结合KEGG数据库与KOBAS系统,对这些差异表达蛋白涉及的调控通路进行分析。
2 结果与分析
2.1百合鳞茎休眠解除过程中蛋白质的2D-DIGE分析
采用三氯乙酸丙酮沉淀法对百合鳞茎蛋白质进行提取。利用2-D Clean up Kit纯化蛋白,采用2-DQuant试剂盒进行蛋白质定量。将各种样品等量混和作为内标(Cy2标记),然后将各样品分别与CyDye DIGE最小标记法染料(Cy3、Cy5)混和上样。将样品加入IPG胶条槽内进行第一向等电聚焦电泳,使用Ettan DALT SIX电泳系统进行蛋白样品的二向分离。用DeCyder图像分析软件对DIGE电泳图谱进行强度校正及点检测等处理分析。以Area>200,Volume>30 000,Peak Height>150为蛋白过滤标准进行软件自动找点,3块重复胶的蛋白质点在位置上都有较好的重复性。由于百合鳞茎内大分子蛋白含量比较丰富,得到的电泳图谱上的点差异很大(图1A)。
提取休眠鳞茎与解除休眠鳞茎的组织样品,经过纯化、浓度测定,通过软件比较和分析了两个时期匹配较好且3次重复都稳定出现的蛋白质点,进行差异蛋白点的标记(如图1B)和2-D样品分离。在2D-DIGE图谱中,选择清晰可辨,丰度变化1.5倍以上的蛋白点作为差异点(P<0.05)。经过定量分析获得了百合鳞茎休眠解除过程中差异表达的蛋白点31个,其中休眠解除鳞茎中上调点为15个,下调点为16个,表达丰度变化两倍以上的蛋白点17个(表1)。
2.2差异蛋白质谱鉴定分析
根据双向电泳图像软件的分析结果,将差异表达的蛋白点进行编号,从制备胶中挖取31个差异蛋白点(fold chang>1.5,P<0.05),胶内酶解后用MALDI-TOF-TOF质谱仪进行质谱分析,得到31套肽质量指纹图谱。获得的肽指纹图谱具有良好的谱峰信噪比,所有的谱峰信噪比都大于20,肽段质量数主要集中在1 000~2 000 Da。对所获得的31个肽质量指纹图谱,用Mascot搜索引擎在NCBI数据库进行搜索比对,匹配有意义的蛋白质(P<0.05),并至少有一个肽段匹配,进行综合分析,成功鉴定了高可信度蛋白质12个,共涉及6种功能已知的蛋白(表2)。

图1 细叶百合休眠鳞茎与解除休眠鳞茎的2D-DIGE图谱Fig.1 The 2D-DIGE spectrums of dormant and dormancy breaking bulbs in Lilium pumilu
注:A,休眠与休眠解除鳞茎的2D-DIGE叠加图谱;B,百合鳞茎差异表达蛋白位点;1-31,蛋白编号。Note:A, stacking graph of 2D-DIGE of dormant and dormancy breaking bulbs; B, the difference express protein spots of lily bulbs; 1-31, protein number.

表1 休眠鳞茎与解除休眠鳞茎差异蛋白质的相对丰度Table 1 Relative abundance of different protein of dormant and dormancy breaking bulb in L. pumilu
2.3差异蛋白调控功能分类及代谢通路分析
对得到的6种高可信度蛋白利用blast2GO功能分析软件在生物学过程、分子功能及细胞定位三方面进行蛋白功能的注释。表3列出了得到的部分结果。这些蛋白在生物学过程方面主要涉及蛋白质参与的生理过程以及对外界胁迫刺激产生的应答反应等。分子功能主要涉及蛋白质代谢过程中各自的生物学功能,所涉及的蛋白质多在细胞质及细胞核中分布,多数蛋白质都具有结合作用。应用KEGG pathway数据库搜索得到的6种蛋白质,得到与两种蛋白质相关的代谢途径4条(P<0.05)(表4)。
3 讨论与结论
目前,对鳞茎类植物休眠的差异蛋白质组学的研究很少见。百合鳞茎在低温冷藏期间,休眠的解除是个渐进的过程,鳞茎在诱导休眠破除过程中发生的复杂的生理生化代谢反应中,低温可以作为一个外界环境信号刺激,必然导致鳞茎休眠解除时不同于深休眠时的发育途径,这一过程与鳞茎中蛋白质的变化有密切的相关性。本研究最终得到 6 种具有统计学意义的表达差异蛋白,其中检测到了核酮糖-1,5-二磷酸羧化酶,Rubisco是光合作用中决定碳同化速率、调节光合和光呼吸的关键酶。它在光合作用中卡尔文循环里催化第1个主要的碳固定反应,将大气中游离的CO2转化为生物体内储能分子[13],例如蔗糖分子。而蔗糖是植物光合作用碳同化的主要产物,也是百合鳞茎低温贮藏过程中代谢的重要的能量来源,鳞茎在休眠时已经贮存了大量的糖类,在休眠解除过程中糖类的合成方向的代谢不活跃,而核酮糖-1,5-二磷酸羧化酶在休眠解除过程中表达量下降与该酶的生物功能是相符合的。此外,核酮糖-1,5-二磷酸羧化酶(RuBisCo)是植物可溶性蛋白中含量最高的蛋白质,占50%左右,它是植物体内一种重要的贮藏蛋白。也有研究表明,植物体内RuBisCo活性及含量与环境因子有很大关系,如温度。植物为适应低温、低光照、水分胁迫的环境,致使RuBisCo活性及含量下降[14]。但是RuBisCo与鳞茎休眠解除的关系还没有明确报道,需要更多的研究证明。
植物在生长发育过程中会遭遇各种不利环境因子如高温、低温、干旱和高盐等。植物感受这些逆境信号后通过信号转导过程调节细胞内抗逆相关蛋白的表达,进而调整自身的生理状态或形态的改变来适应不利环境[15],植物的休眠过程也是对环境的胁迫过程。本研究中检测到一种胰蛋白酶抑制剂。胰蛋白酶抑制剂可以通过与蛋白质的活性位点直接作用,以此抑制蛋白酶的催化活性,参与多种功能,如环境的刺激、贮藏物质的动员、细胞程序性死亡、蛋白的加工和降解或者代谢途径的调控等[16-18]。板栗(Castaneamollissima)在冷、盐和热等非生物胁迫中,蛋白酶抑制剂在翻译水平被诱导而发生变化,来应对非生物胁迫过程[19]。冷激胰蛋白酶抑制剂高表达的冬小麦(Triticumaestivum)具有抗雪霉病的作用[20]。本研究结果中,胰蛋白酶抑制剂在休眠鳞茎中表达量较高,推测其在休眠状态下对增强防御能力过程中有重要作用。本研究还检测到另一种与植物逆境生理相关的差异蛋白,Pathogenesis-related protein(病原相关蛋白,PR)。在前期研究SSH文库中发现,休眠鳞茎和休眠解除鳞茎中调控这种蛋白的基因都有所表达[7],而在休眠解除鳞茎中它为下调蛋白。Pathogenesis-related protein在苣荬菜(Sonchusbrachyotus)芽根休眠期间为特异表达蛋白,在整个休眠过程的不同时期内,它的变化趋势为先上升后下降[15],表明休眠植物体面临着严重的低温胁迫与水分胁迫。
PR蛋白是植物产生的自我保护物质,病原菌的侵染、植物激素、交替氧化酶的活性都能够诱导PR蛋白的表达[21-22],而PR蛋白的产生一定程度上增强了植物抵御病害的能力。Dilip[23]研究认为PR蛋白可作为蛋白酶抑制剂抑制病原物的蛋白合成过程,进而抑制病原物生长。病原物侵染植物体后糖类的积累也可以诱导产生某些PR蛋白的转录物[24]。可见,PR蛋白在增加植物抵御胁迫过程中具有重要作用。

表3 部分差异蛋白点GO功能分析结果Table 3 GO function analysis of identified proteins
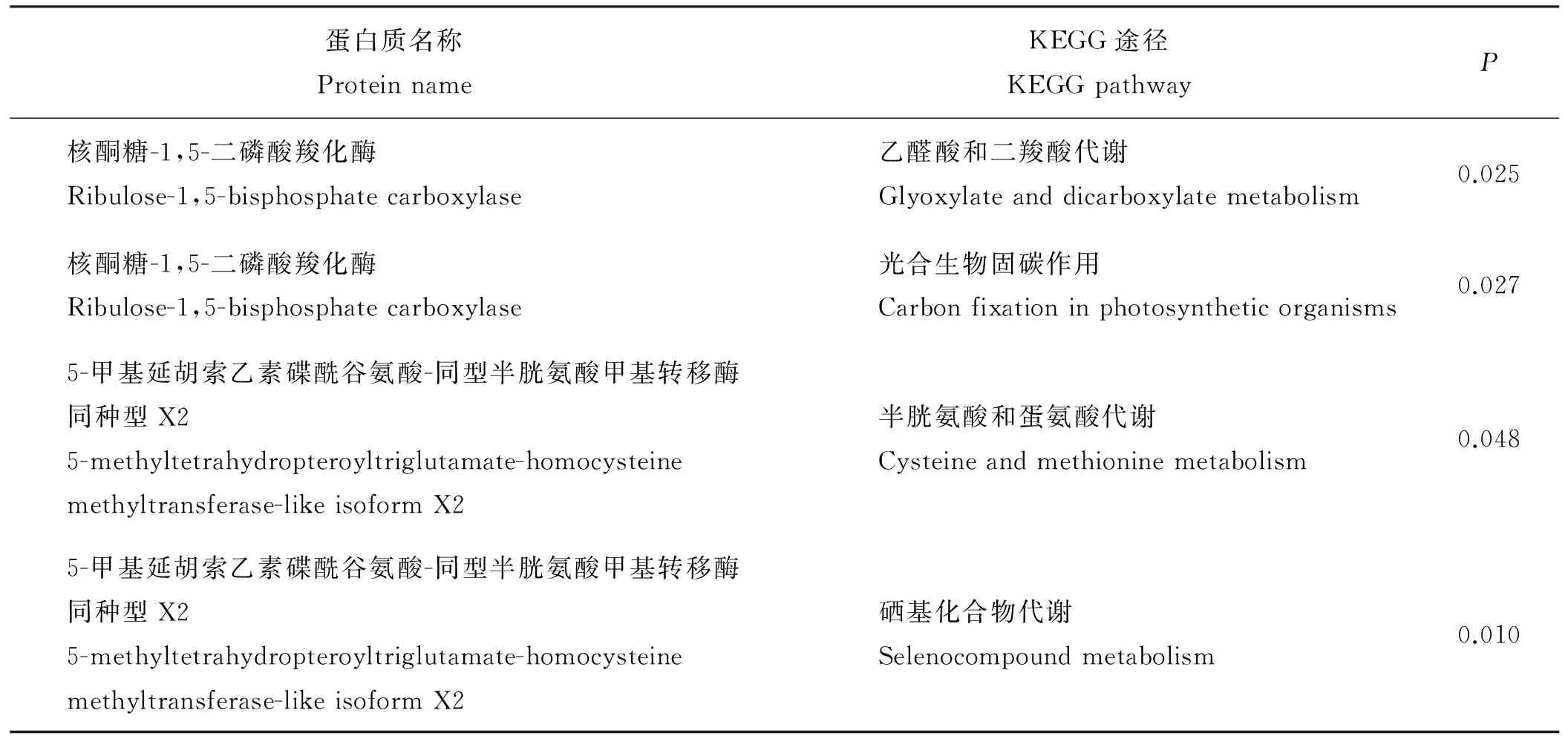
表4 部分差异蛋白KEGG代谢途径Table 4 Part of KEGG metabolic pathways
蛋白质在酸碱条件及酶的作用下发生水解,蛋白质的水解中间过程,可以生成多肽,但水解的最终产物都是氨基酸。蛋白质是与生命及各种形式的生命活动紧密联系在一起的物质。本研究鉴定了一种与蛋白质代谢相关的差异蛋白,同型半胱氨酸甲基转移酶是一种催化酶,该酶属于转移酶家族,特别是转移含一碳基团的甲基,参与甘氨酸、丝氨酸、苏氨酸和蛋氨酸的代谢。有研究证明,该酶能够和微管蛋白相结合。此外,该酶能够调节载脂蛋白的表达,导致相关脂蛋白水平的增加,刺激和提高生物膜的活性[25-27]。本研究发现,可溶性蛋白的含量在休眠解除后期的变化呈现逐渐下降的趋势,表明鳞茎休眠解除时蛋白质被水解成为游离氨基酸来增强鳞茎的抗冷性,也为休眠的彻底破除奠定物质基础。同型半胱氨酸甲基转移酶在百合鳞茎休眠解除时上调表达,蛋白水解酶类在休眠解除过程中的活跃表达,使游离氨基酸的含量保持较高的水平,更有利于提高细胞的浓度和渗透压,以此降低冰点,提高植物的越冬抗寒力,以及促进植物休眠的打破。
References:
[1]马春莲.低温解除百合鳞茎休眠过程中抑制性差减cDNA文库构建及EST分析.武汉:华中农业大学硕士学位论文,2012.
Ma C L.Construction of SSH cDNA libraries for lily bulbs dormancy breaking by cold storage analysis of EST.Master Thesis.Wuhan:Huazhong Agricultural University,2012.(in Chinese)
[2]Gévaudant F,Petel Q,Guilliot A.Differential expression of four members of the gene family during dormancy of vegetative buds of peach trees.Planta,2001,212:619-626.
[3]Frewen B E,Chen T H H,Howe G T.Quantitative trait loci and candidate gene mapping of bud set and bud flush in populus.Genetics,2000,154:837-845.
[4]Huang X,Zhu W,Dai S L.The involvement of mitochondrial phosphate transporter in accelerating bud dormancy release during chilling treatment of tree peony (Paeoniasuffruticosa).Planta,2008,228:545-552.
[5]Welling A,Rinne P,Viherä-Aarnio A,Kontunen-Soppela S,Heino P,Palva E T.Photoperiod and temperature differentially regulate the expression of two dehydrin genes during overwintering of birch (BetulapubescensEhrh.).Journal of Experimental Botany,2004,55:507-516.
[6]刘芳,王家艳,王晓丽,周蕴薇.细叶百合鳞茎在低温解除休眠过程中茎尖细胞超微结构的变化.园艺学报,2013,40(6):1110-1118.
Liu F,Wang J Y,Wang X L,Zhou Y W.The apical bud cell ultra-structure changes ofLiliumpumilumbulbs during breaking dormancy under refrigerated condition.Horticulturae Sinica,2013,40(6):1110-1118.(in Chinese)
[7]刘芳,王家艳,周蕴薇.细叶百合休眠与解除SSH 文库构建及其调控基因的初步筛选.园艺学报,2014,41(7):1476-1484.
Liu F,Wang J Y,Zhou Y W.Preliminary screening of dormancy regulation related genes from SSH library constructed using dormant and dormancy breaking bulbs ofLiliumpumilum.Acta Horticulturae Sinica,2014,41(7):1476-1484.(in Chinese)
[8]Langens-Gerrits M M,Miller W B M,Croes A F,Klerk G J D.Effect of low temperature on dormancy breaking and growth after planting in lily bulblets regenerated in vitro.Plant Growth Regulation,2003,40:267-275.
[9]周志钦.马铃薯从休眠到发芽过程差异表达基因的分析.西南农业大学学报,2001,23(3):213-215.
Zhou Z Q.Analysis of differentially expressed genes from dormancy to sprouting of potato tubers.Journal of Southwest Agricultural University,2001,23(3):213-215.(in Chinese)
[10]Steven F,Isabel D S,Heather C.Dormancy cycling in arabidopsis seeds is controlled by seasonally distinct hormone signaling pathways.Proceedings of the National Academy of Sciences,2011,108:20236-20241.
[11]Luis D B,Donna K,Linda H.Effects of postharvest storage and dormancy status on ABA content,metabolism,and expression of genes involved in ABA biosynthesis and metabolism in potato tuber tissues.Plant Molecular Biology,2006,61:687-697.
[12]Faivre R O,Cardle L,Marshall D.Changes in gene expression during meristem activation processes inSolanumtuberosumwith a focus on the regulation of an auxin response factor gene.Journal of Experimental Botany,2004,55:613-622.
[13]张荻.百子莲花芽分化及开花机理研究.哈尔滨:东北林业大学博士学位论文,2011.
Zhang D.Flower bud development and flowering mechanism inAgapanthuspraecoxssp.orientalis.PhD Thesis.Harbin:Northeast Forestry University,2007.(in Chinese)
[14]韩鹰,陈刚,王忠.活化酶的研究进展.植物学通报,2000,17(4):306-311.
Han Y,Chen G,Wang Z.The progresses of studies on rubisco activase.Chinese Bulletin of Botany,2000,17(4):306-311.(in Chinese)
[15]陈晶瑜.休眠期间苣荬菜芽根蛋白质组的双向电泳分析及质谱鉴定.哈尔滨:东北农业大学硕士学位论文,2011.
Chen J Y.The analysis and identification of proteins from rhizome ofSonchusbrachyotusDC.in the course of dormancy by two-dimensional electrophoresis and peptide mass fingerprinting.Master Thesis.Harbin:Northeast Agricultural University,2011.(in Chinese)
[16]牟永潮,崔红,于晶,苍晶,曾俨,孟健男.低温胁迫下东农冬麦1号分蘖节SSH文库的构建及文库中3个基因的表达模式.作物学报,2011,37(5):918-923.
Mu Y C,Cui H,Yu J,Cang J,Zeng Y,Meng J N.Expression analysis of three genes from SSH library constructed using tillering nodes of Dongnongdongmai 1 under low temperature.Acta Agronomica Sinica,2011,37(5):918-923.(in Chinese).
[17]Callis J.Regulation of protein-degradation.Plant Cell,1995,7:845-857.
[18]Abe K,Emori Y,Kondo H,Suzuki K,Arai S.Molecular cloning of a cysteine proteinase inhibitor of rice (Oryzacystatin):Homology with animal cystatins and transient expression in the ripening process of rice seeds.Journal of Biological Chemistry,1987,262:16793-16797.
[19]Pernas M,Sánchez-Monge R,Salcedo G.Biotic and abiotic stress can induce cystatin expression in chestnut.FEBS Letters,2000,467:206-210.
[20]Christova P K,Christov N K,Imai R.A cold inducible multidomain cystatin from winter wheat inhibits growth of the snow mold fungusMicrodochiumnivale.Planta,2006,223:1207-1218.
[21]Takashi H,Joseph J K,Noriko H,Mikhail K,Plinio G,Saeid N,Jose M A,William P D,Andrew D,Joseph R E.RESPONSIVE-TO-ANTAGONIST1,a Menkes/Wilson disease-related copper transporter,is required for ethylene signaling inArabidopsis.Cell,1999,97:383-393.
[22]Simons B H,Millenaar F F,Mulder L,van Loon L C,Lambers H.Enhanced expression and activation of the alternative oxidase during infection ofArabidopsiswithPseudomonassyringaepv tomato.Plant Physiology,1999,120(2):529-538.
[23]Dilip M S.Genetic engineering for fungal and bacterial diseases.Current Opinion in Biotechnology,1997,8:208-214.
[24]Cao H,Glazebrook J,Clark J D,Volko S,Dong X N.TheArabidopsisNPR1 gene that controls systemic acquired resistance encodes a novel protein containing ankyrin repeats.Cell,1997,88:57-64.
[25]Pajares M A,Pérez-Sala D.Betaine homocysteine S-methyltransferase:Just a regulator of homocysteine metabolism.Cellular and Molecular Life Sciences,2006,63(23):2792-803.
[26]张怡然,张占路,唐益雄,吴燕民.植物表达抗原蛋白及其免疫原性的研究进展.草业科学,2015,32(6):967-977.
Zhang Y R,Zhang Z L,Tang Y X,Wu Y M.The research progress of plants express antigen protein and immunogenicity.Pratacultural Science,2015,32(6):967-977.(in Chinese)
[27]陈天龙,王彦荣,王宇,张吉宇,刘志鹏.蒺藜苜蓿EMS诱变突变体库的构建及突变体表型的分析.草业科学,2015,32(1):71-77.
Chen T L,Wang Y R,Wang Y,Zhang J Y,Liu Z P.Construction of mutant populations by EMS and phenotypic analysis ofMedicagotruncatula.Pratacultural Science,2015,32(1):71-77.(in Chinese)
(责任编辑苟燕妮)
DOI:10.11829/j.issn.1001-0629.2016-0304
The analysis of differential proteins in lily bulbs during dormancy breaking
Liu Fang1,2, Tian Zhong-ping1, Yu Ming-bin3, Zhang Yu1, Cai Ying-jie1, Zhou Yun-wei1
(1.College of Landscape Architecture, Northeast Forestry University, Harbin 150040, China;2.College of Agriculture, Heilongjiang Bayi Agricultural University, Daqing 163319, China;3.Dalian Forest Zoo, Dalian 116013, China)
Lily bulb dormancy was broken during low temperature storage, Fluorescent difference gel electrophoresis, MALDI-TOF/TOF and bioinformatic technology were used in the experiment. A total of 31 differentially expressed proteins were separated by using fluorescent difference gel electrophoresis. Among these proteins, there were 15 proteins up-regulated and 16 proteins down-regulated in the dormancy breaking bulbs. These proteins were classified into 6 categories by function. Comprehensive analysis showed that these proteins were mainly stress protein,they may involved in metabolic process of the bulbs, and regulate the bulb dormancy breaking. According to the expression differences of the proteins in dormant and dormancy breaking bulbs, several proteins identified might be related to the process of bulb dormanc.Stress proteins had high expression in dormant bulbs, and proteolytic enzymes had high expression in dormancy breaking bulbs. This research had set the stage for further understanding of the bulb dormancy mechanisms in lily.
Liliumpumilum; bulb; dormancy; proteome
Zhou Yun-weiE-mail:dlzhyw@126.com
10.11829/j.issn.1001-0629.2015-0633
2015-11-13接受日期:2016-04-05
国家自然科学基金(31470698)
刘芳(1980-),女,黑龙江双城人,实验师,博士,研究方向为园林植物种质资源。E-mail:byndliufang@163.com
周蕴薇(1970-),女,吉林九台人,教授,博士,研究方向为园林植物种质资源。E-mail:dlzhyw@126.com
Q945.35;S644.1
A
1001-0629(2016)9-1665-08*
刘芳,田忠平,于明斌,张雨,蔡英杰,周蕴薇.百合鳞茎休眠解除过程中差异蛋白表达分析.草业科学,2016,33(9):1665-1672.
Liu F,Tian Z P,Yu M B,Zhang Y,Cai Y J,Zhou Y W.The analysis of differential proteins in lily bulbs during dormancy breaking.Pratacultural Science,2016,33(9):1665-1672.

