羊梅迪-维斯那病毒实时荧光定量PCR检测方法的建立
李 佳,侯 芳,段真真,巴音查汗,何宗霖*
(1.阿克苏地区动物疫病控制诊断中心,新疆阿克苏 843000;2.阿克苏地区卡拉库尔羊基地畜牧兽医站,新疆库车 842000;3.新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
羊梅迪-维斯那病毒实时荧光定量PCR检测方法的建立
李佳1,2,侯芳1,3,段真真1,巴音查汗3*,何宗霖1*
(1.阿克苏地区动物疫病控制诊断中心,新疆阿克苏 843000;2.阿克苏地区卡拉库尔羊基地畜牧兽医站,新疆库车 842000;3.新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
为了建立一种能快速检羊梅迪-维斯那病毒(MVV) 的实时荧光定量PCR,根据GenBank中MVV gag基因的序列,设计了1对特异性引物及TaqMan探针,经过反应体系及条件优化,以定量的10倍系列稀释的阳性质粒为标准品进行实时荧光定量PCR扩增,建立了MVV实时荧光定量PCR。结果显示,该方法对MVV DNA最小检出量为10 copies/μL,比普通PCR具有较高的检出率;组内及组间变异系数均低于2%,具有较好的重复性;该方法可以特异地检测到MVV,与其他病毒性样品无交叉反应。被检的92份临床样品中,实时荧光定量PCR和常规PCR的阳性检出率分别为4.3%和3.3%。为羊MVV快速检测和分子流行病学调查提供了一种有效的方法。
梅迪-维斯那病毒;实时荧光定量PCR;检测
羊梅迪-维斯那病是由梅迪-维斯那病毒(Maedi-Visna virus,MVV)引起的一种慢性接触性传染病,MVV属于RNA反转录病毒属[1],临床上主要引起羊关节炎、脑炎和呼吸困难等症状,会造成感染羊进行性消瘦、产羔数减少以及早期死亡等繁殖性能障碍,由于该病潜伏期长、病程发展缓慢,不容易被发现[2],该病的传播容易给养羊业造成较大的经济损失。
梅迪-维斯那病最早发现于南非,随后在荷兰、美国以及冰岛等国相继发现了该病。1966年,我国首次发现并证实该病是从和田的引进边区莱斯特羊所致[3]。目前,该病几乎遍布全世界所有的养羊国家,是全球养羊业的重要预防疫病之一。现阶段防控梅迪-维斯那病的主要方法是检疫淘汰阳性羊,虽然淘汰阳性羊的方法可以降低发病率和死亡率,但是这种方法成本过高,不利于养羊业的发展。
目前,检测MVV的方法主要有病毒分离鉴定、ELISA、PCR等,但是这些方法在临床应用中存在灵敏度低、特异性差等不足[4-5]。因此,本研究针对MVV gag基因序列设计特异性引物和探针,建立了TaqMan实时荧光定量PCR,为MVV的早期快速检测及分子流行病学研究提供了一种新的检测手段。
1 材料与方法
1.1材料
1.1.1毒株与疫苗MVV毒株,阿克苏地区动物疫病控制诊断中心实验室从发病绵羊脏器中分离保存;羊痘活疫苗,中牧实业股份有限公司产品;口蹄疫疫苗、小反刍兽疫弱毒活疫苗,天康生物技术有限责任公司产品。
1.1.2主要试剂与仪器 病毒核酸纯化试剂盒、ExTaq聚合酶、Marker DL 2000、pXT19-T 载体、大肠埃希菌DH5α 感受态细胞、质粒小量提取试剂盒,宝生物工程(大连)有限公司产品;Nano Drop 2000 超微量分光光度计,Thermo公司产品;7 500荧光 PCR 仪,美国ABI公司产品。
1.1.3引物与探针设计 应用Primer Premier 6.0软件,根据GenBank中登录的MVV gag 基因序列(登录号:AY101611),设计1对特异性实时荧光PCR引物和TaqMan探针,F-gag: 5′ -CATCTCAAGCCAATATGGATCAG-3′,R-gag: 5′-GTCACTGGTTCCGCATCAATAG-3′;P-gag:5′-FAM-CAAGACAGATATGCCTGCAGTGGGTAAT-TAMAR-3′;引物由上海生工生物工程技术服务有限公司合成。
1.2方法
1.2.1标准品的制备用病毒核酸纯化试剂盒提取MVV DNA,用引物对提取的DNA进行扩增,将扩增的阳性产物链接至pXT19-T克隆载体,转化大肠埃希菌 DH5α 感受态细胞,经含氨苄西林的LB培养基增菌后,将PCR鉴定为阳性的菌液提取质粒,送至上海生工生物工程技术服务有限公司进行测序。将鉴定正确的阳性菌液提取质粒,经超微量分光光度计测定浓度,以10倍递增稀释成 1.0×108copies/μL ~ 1.0×100copies/μL。
1.2.2反应条件与体系优化 采用矩阵方法对影响实时荧光定量PCR反应条件中变性、退火、延伸温度(54℃~60℃)、时间和反应体系中的引物浓度(4 pmol/μL~15 pmol/μL)、探针浓度(5 pmol/μL~15 pmol/μL)进行优化。
1.2.3标准曲线及灵敏度试验 以10倍递增稀释好的阳性标准品为模板,按照优化完成的反应体系及反应条件进行实时荧光定量PCR扩增,以双蒸水为阴性对照,以便于区别最低检测浓度。根据实时荧光定量PCR的灵敏度扩增曲线,利用ABI 7500软件分析自动生成标准曲线。
1.2.4特异性试验分别提取羊痘病毒、口蹄疫病毒、小反刍兽疫病毒样品RNA/DNA,按照优化完成的反应体系和条件进行实时荧光定量PCR检测,以验证该方法的特异性。
1.2.5重复性试验选取5个不同浓度的标准品为模板,每个浓度设4个平行,进行4次组内和组间重复性试验,每次试验间隔1周,分别计算组内及组间的变异系数。
1.2.6临床样品检测应用建立的梅迪-维斯那病毒TaqMan实时荧光定量PCR检测和常规PCR,对从阿克苏地区库车县(成年卡拉库尔羊50份)和阿克苏市(成年刀郎羊42份)采集的92份抗凝血提取核酸后进行检测,以验证建立的方法的临床实用性。
2 结果
2.1重组阳性质粒的制备
以提取的MVV DNA通过PCR扩增,得到长度约145 bp的阳性扩增产物(图1),将阳性产物连接至pXT19-T克隆载体,将重组质粒经PCR和测
序鉴定正确的质粒作为标准品,提取质粒后测定浓度,换算成初始浓度为 1.87×1010copies/ μL。
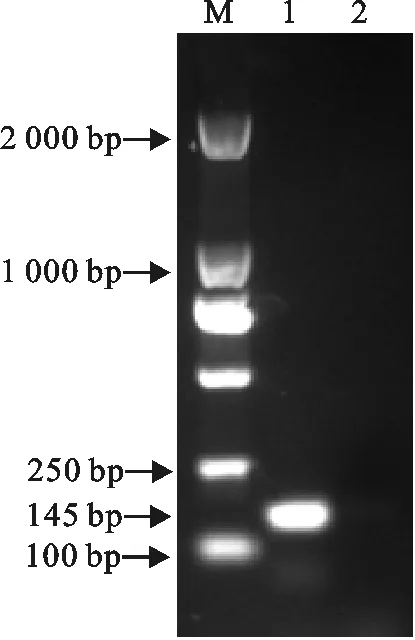
M.DNA 标准DL 2 000;1.梅迪-维斯那病毒;2.阴性对照
M.DNA Marker DL 2 000;1.Maedi-Visna virus;2.Negative control
图1目的基因的PCR扩增
Fig.1PCR amplification of the target gene
2.2反应体系及反应条件优化
以质粒为模板,采用矩阵法优选引物和探针的最佳反应浓度配比,最终确定最佳反应体系为(25 μL):2 × Premix ExTaq(Probe qPCR)12.5 μL,上、下游引物(10 pmol/μL)0.5 μL,探针为(10 pmol/μL)0.8 μL,模板1 μL,双蒸水补至25 μL。反应条件确定为:94 ℃ 2 min;94 ℃ 15 s,55 ℃ 40 s,40 个循环;每个循环结束时收集荧光信号,能够获得较小的Ct值及较大的荧光信号值,扩增效果达到最好。
2.3标准曲线及灵敏度试验
将质粒按照10倍递增稀释好后,按照优化好的反应条件和体系,进行实时荧光定量PCR扩增,结果实时荧光定量PCR方法最低检测稀释度为1.87×101copies/μL,其灵敏度是常规PCR 的100倍(图2)。以循环数为横坐标,荧光信号强度为纵坐标绘制标准曲线,得出标准曲线回归方程式:y=-3.207x+38.86,相关系数R2=0.996,标准品与Ct值呈良好的线性关系(图3)。
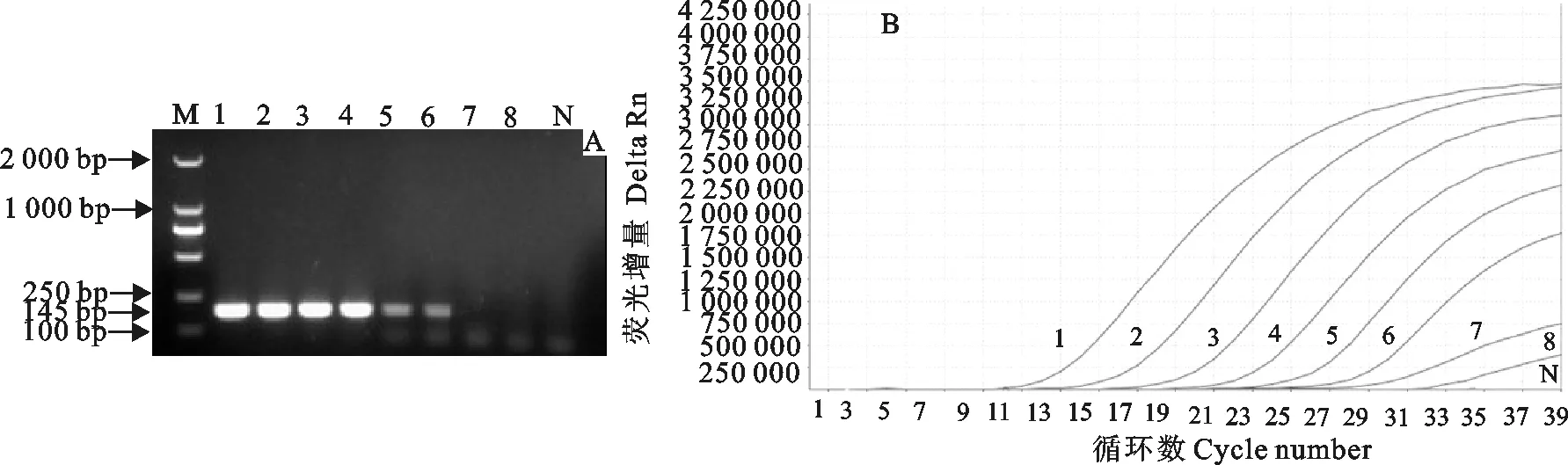
A.常规PCR;B.实时荧光定量PCR;M.DNA 标准DL 2 000;1~8.1.87×108copies/μL~1.87×100copies/μL;N.阴性对照
A.PCR;B.Real-time PCR;M.DNA Marker DL 2 000;1-8.1.87×108copies/μL-1.87×100copies/μL;N.Negative control
图2常规PCR和实时荧光定量PCR灵敏度试验
Fig.2Sensitivity tests of conventional PCR and real-time PCR
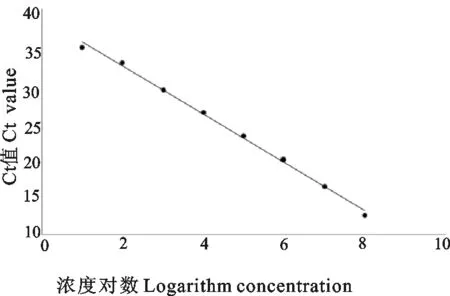
图3 实时荧光定量PCR 标准曲线
2.4特异性试验
应用建立的实时荧光定量PCR进行特异性试验,结果只有MVV样品有扩增曲线,羊痘病毒、口蹄疫病毒、小反刍兽疫病毒样品均无扩增曲线(图4)。
2.5重复性试验
选取1.87×107copies/μL ~ 1.87×103copies/μL 5个浓度的阳性标准品进行组内和组间重复性试验,结果组内重复性试验变异系数小于2%;组间重复性试验变异系数小于1.41%(表1),说明建立的方法具有较好的重复性。
2.6临床样品检测结果
在临床样品检测中,对92份羊的临床样品进行检测结果显示, 实时荧光定量PCR检出4份阳性,常规PCR检出3份阳性,其中常规PCR检出的阳性样品经实时荧光定量PCR均显示为阳性,表明实时荧光定量PCR更为灵敏。
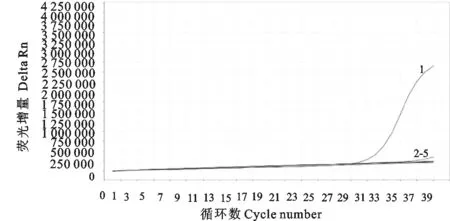
1.梅迪-维斯那病毒;2.口蹄疫病毒;3.羊痘病毒;4.小反刍兽疫病毒;5.空白对照
1.MVV;2.FMDV;3.SPV;4.PPRV;5.Blank control

图4 实时荧光定量PCR特异性试验扩增曲线 Fig.4 Specificity test curve of real-time PCR 表1 实时荧光定量PCR重复性试验Table 1 The reproducibility test of real-time PCR
3 讨论
梅迪-维斯纳病是一种慢性、增生性传染病,其病原MVV主要侵染单核细胞、巨噬细胞和树突状细胞,乳腺是最容易繁殖的靶器官,被MVV侵染多引起细胞融合形成多核细胞,数周后可在血液中检测到该病毒[6-7]。MVV主要通过带病羊的排泄物和健康羊直接接触传染,胎盘和乳汁可垂直传播,一年四季均可发生,绵羊是MVV的易感宿主,其中边区莱斯特羊最易感,感染率最高可达60%以上,中国美利奴羊和卡拉库尔羊则易感性较低,而5岁以上羊易感性偏高[8]。
目前尚无有效疫苗和的治疗方法,临床上多呈散发,病死率较高,该病传入感染羊群后很难根除,因此防控本病关键在于防止健康羊接触传染源和病羊,及时发现隔离淘汰带病羊,做好饲养羊群和新进羊的检疫工作[9]。
实时荧光定量PCR因其特异、敏感、高通量等特点已广泛应用于多个领域[10],本研究根据MVV gag基因保守区设计的引物和探针,通过优化引物与探针的浓度配比,建立了梅迪-维斯那病毒TaqMan实时荧光定量PCR检测方法,该方法具有良好的敏感性,最低检测浓度为1.87×101copies/μL的阳性质粒,其敏感性比普通PCR提高了100倍,组内和组间变异系数均小于2%。该方法对口蹄疫病毒(Foot and mouth disease virus,FMDV)、绵羊痘病毒(Sheep pox virus,SPV)、小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)疫苗株的检测结果均为阴性,无交叉反应,可用于羊出现相似临床症状的病原鉴别检测。本研究建立的方法敏感性好,无交叉反应,重复性好,可应用于高通量检测,为MVV的分子生物学诊断和大规模的流行病学调查提供了有效的检测手段。
[1]张念章,储岳峰,赵萍,等.梅迪维斯纳病毒研究进展[J].动物医学进展,2011,32(3):104-107.
[2]易海清,阿合买提·买买提,邓普辉,等.新疆卡拉库尔羊梅迪/维斯那病毒感染的病理学观察[J].动物医学进展,2006,27(2):75-78.
[3]易海清.绵羊慢病毒自然感染卡拉库尔羊的初步研究[D].新疆乌鲁木齐:新疆农业大学,2006.
[4]Extramiana A B,Gonzalez L,Cortabarria N,et al.Evaluation of a PCR technique for the detection of Maedi-Visna proviral DNA in blood milk and tissue samples of naturally infected sheep[J]. Small Ruminant Res,2002,44:109-118.
[5]邱家祥,阿合买提·买买提,邓普辉,等.新疆卡拉库尔羊感染绵羊慢病毒的血清学调查[J].中国兽医杂志,2005,41(7):20-21.
[6]管峰,石国庆,赵进,等.羊慢病毒及其抗性基因研究进展[J].遗传,2014,36(12):1204-1210.
[7]Angelopoulou K,Brellou G D,Vlemmas I.Detection of Maedi-Visna virus in the kidneys of naturally infected sheep[J].J Comp Path,2006,134:329-335.
[8]邓普辉,阿合买提·买买提,简子健,等.新疆绵羊群体对绵羊慢病毒的品种敏感性研究[J].中国兽医杂志,2004,40(12):26-27.
[9]Blanco R V,Dolz G,Morales A S,et al.Presence of Maedi-Visna in Costa Rican sheep flocks[J].Small Ruminant Res,2015,124:132-136.
[10]李佳,张杨,王振宝,等.马泰勒虫实时荧光PCR检测方法的建立[J].中国预防兽医学报,2014,36(9):720-722.
Establishment of Real-time PCR for Detection of Mehdi-Visna Virus
LI Jia1,2,HOU Fang1,3,DUAN Zhen-zhen1,Bayinchahan3,HE Zong-lin1
(1.AksuCenterforAnimalDiseaseControlandDiagnosis,Aksu,Xinjiang,843000,China;2.KarakulSheepHusbandryandVeterinaryStation,Kuqa,Xinjiang,842000,China;3.CollegeofVeterinaryMedicine,XinjiangAgriculturaUniversity,Urumqi,Xinjiang,830052,China)
In order to establish aTaqMan real-time PCR method to quickly check the sheep Maedi-Visna virus (MVV) ,according to the MVV gag gene sequences in GenBank,a pair of specific primers and aTaqMan probe were designed after optimizing the reaction system and conditions.The standards which are positive plasmids of quantitative 10-fold serial dilutions to real-time PCR amplification were used,and the real-time PCR detection method of MVV was established.The test results showed that the minimum detectable amount of this method is 10 copies,compared with ordinary PCR,the method has a higher detection rate;the coefficient of variation is less than 2% in intergroup and intragroup assays,with good repeatability; the method can be specific for detecting MVV,and do not have cross-reaction with other viral samples.Among 50 clinical samples,the positive rate was 4.3% detected by real-time PCR and 3.3% by conventional PCR.It indicated that the real-time PCR assay could be used for the rapid detection of MVV and molecular epidemiology investigation in sheep.
Mehdi-Visna virus;real-time PCR;detection
2016-03-25
新疆阿克苏地区人才专项资金项目(20150037)
李佳(1989-),男,新疆阿克苏人,兽医师,硕士,主要从事动物疫病分子诊断研究。*通讯作者
S852.43;S852.659.3
A
1007-5038(2016)10-0026-04

