淫羊藿次苷Ⅱ对大鼠坐骨神经损伤后功能恢复和神经再生的影响
彭晴 刘涛 余昌胤

淫羊藿次苷Ⅱ對大鼠坐骨神经损伤后功能恢复
和神经再生的影响
彭 晴1 刘 涛1 余昌胤1 李国艳1 龚其海2
1.遵义医学院附属医院神经内科,贵州遵义 563000;
2.遵义医学院基础药理省部共建教育部重点实验室,贵州遵义 563099
[摘要] 目的 观察淫羊藿次苷Ⅱ(IcsⅡ)对大鼠坐骨神经钳夹损伤后功能恢复和神经再生的影响。 方法 将64只雄性SD大鼠随机分为正常组、假手术组、模型组和IcsⅡ治疗组,每组16只,观察时间点为4、8周,每个时间点8只。取右侧臀部斜切口、距梨状肌5 mm处钳夹5 min损伤坐骨神经,损伤宽度为3 mm。IcsⅡ治疗组在建模后即日起予以IcsⅡ 4 mg/(kg·d)连续灌胃。采用坐骨神经指数(SFI)观察坐骨神经功能恢复情况,苏木精-伊红(HE)染色观察腓肠肌形态学变化,Masson染色观察坐骨神经组织学变化,免疫组织化学法检测坐骨神经生长相关蛋白(GAP-43)表达。 结果 在4周和8周时:①神经功能:IcsⅡ治疗组大鼠神经功能恢复更快,SFI指数(分)均高于模型组[(-56.77±3.42)比(-79.07±14.44),(-19.52±17.85)比(-75.37±7.23)](P < 0.05);②腓肠肌形态学:IcsⅡ治疗组腓肠肌肌纤维截面积(μm2)明显高于模型组[(5201.11±453.44)比(2618.81±514.26),(10 784.99±978.20)比(3222.21±400.01)](P < 0.05),腓肠肌湿质量残存率(%)高于模型组[(53.86±7.76)比(39.88±9.07),(71.67±15.18)比(48.86±6.71)](P < 0.05);③坐骨神经组织学:IcsⅡ治疗组坐骨神经轴突数目(个)高于模型组[(394.50±12.02)比(160.50±9.19),(474.50±33.24)比(289.50±6.36)](P < 0.05),平均光密度高于模型组[(0.462±0.036)比(0.455±0.004),(0.484±0.011)比(0.462±0.016)](P < 0.05);④免疫组织化学法:IcsⅡ治疗组坐骨神经GAP-43蛋白平均光密度值比模型组高[(0.175±0.012)比(0.166±0.006),(0.196±0.010)比(0.169±0.006)](P < 0.05)。以上各项指标,模型组和治疗组均低于正常组和假手术组(P < 0.05),正常组和假手术组比较差异无统计学意义(P > 0.05)。 结论 IcsⅡ能促进坐骨神经钳夹损伤后的功能恢复,促进神经再生。
[关键词] 淫羊藿次苷Ⅱ;坐骨神经;神经再生
[中图分类号] R745.4 [文献标识码] A [文章编号] 1673-7210(2016)02(b)-0012-05
Effects of Icarisid Ⅱ on functional recovery and nerve regeneration after sciatic nerve injury in rats
PENG Qing1 LIU Tao1 YU Changyin1 LI Guoyan1 GONG Qihai2
1.Department of Neurology Medicine, Affiliated Hospital of Zunyi Medical University, Guizhou Province, Zunyi 563000, China; 2.Key Laboratory of Basic Pharmacology of Ministry of Education, Zunyi Medical University, Guizhou Province, Zunyi 563099, China
[Abstract] Objective To explore the effects of Icarisid Ⅱ (IcsⅡ) on functional recovery and nerve regeneration after sciatic nerve crush injury in rats. Methods A total of 64 male SD rats were randomly divided into four groups: normal group, sham operation group, model group and IcsⅡ group, with 16 rats in each group. There were 2 observation time points in every group: 4 and 8 weeks with 8 rats in each time point. The injuries of sciatic nerve were created through an oblique incision (3 mm in width) in right buttock at the inferior boarder 5 mm below the piriformis for 5 min. IcsⅡ group was administered by IcsⅡ at a dose of 4 mg/(kg·d) by gavage on 1st day after modeling. The functional recovery was evaluated by sciatic functional index (SFI). Morphological change in gastrocnemius was observed by hematoxylin-eosin (HE) staining after the rats were sacrificed. Histological change in sciatic nerve was observed by Masson staining. Immunohistostaining was used to detect the expression of growth associated protein-43 (GAP-43). Results At 4 weeks and 8 weeks, ①nerve function: the functional recovery after the use of IcsⅡ was faster than that of model group, the scores of SFI (points) in IcsⅡ group were higher than those of model group [(-56.77±3.42) vs (-79.07±14.44), (-19.52±17.85) vs (-75.37±7.23)] (P < 0.05); ②morphological change in gastrocnemius: the transverse areas of muscle fiber (μm2) were significantly higher than those of model group [(5201.11±453.44) vs (2618.81±514.26), (10 784.99±978.20) vs (3222.21±400.01)] (P < 0.05), so as the recovery rate of gastrocnemius muscle's wet weight (%) [(53.86±7.76) vs (39.88±9.07), (71.67±15.18) vs (48.86±6.71)] (P < 0.05); ③histological change in sciatic nerve: the number of sciatic axons in IcsⅡ group was higher than that of model group [(394.50±12.02) vs (160.50±9.19), (474.50±33.24) vs (289.50±6.36)] (P < 0.05), the same as its average optical density [(0.462±0.036) vs (0.455±0.004), (0.484±0.011) vs (0.462±0.016)] (P < 0.05); ④immunohistostaining: the average optical density of GAP-43 protein in IcsⅡ group was higher than that of model group [(0.175±0.012) vs (0.166±0.006), (0.196±0.010) vs (0.169±0.006)] (P < 0.05). The indexes above of model group and IcsⅡ group were lower than those of normal group and sham operation group(P < 0.05). There was no statistically significant difference between the normal group and the sham operation group (P > 0.05). Conclusion IcsⅡ can effectively improve the functional recovery, promote nerve regeneration after sciatic nerve crush injury in rats.
[Key words] Icarisid Ⅱ; Sciatic nerve; Nerve regeneration
周围神经病变恢复时间长、治疗难度大,临床常用有效的药物主要是神经生长因子,但由于副作用及价格因素导致其使用受限。我国传统中药淫羊藿提取液、淫羊藿苷、牛膝和银杏叶提取物具有促进周围神经再生作用,丹参可以促进坐骨神经组织神经生长因子的表达[1-2]。从传统中药中寻找价廉、副作用小、能长期应用的药物促进周围神经损伤后功能恢复和神经再生具有重要的临床意义。淫羊藿次苷Ⅱ(icarisid Ⅱ,IcsⅡ)是从淫羊藿中提取的一种多羟基黄酮类单体成分,是淫羊藿的有效成分之一,具有治疗勃起功能障碍、抗缺血性脑损伤、抗肿瘤等作用[3-5],但其是否能促进周围神经损伤的恢复鲜见相关报道。本研究通过钳夹大鼠坐骨神经复制坐骨神经损伤模型,采用IcsⅡ干预观察神经功能恢复和坐骨神经改变,探讨IcsⅡ对坐骨神经损伤后功能恢复和神经再生的影响。
1 材料与方法
1.1 实验动物及分组
健康清洁级SD雄性大鼠64只,2~3月龄,体重(236.47±13.84)g,购于第三军医大学医学实验动物中心,合格证号:SCXK(渝)2012-0005。动物处理方法符合我国科学技术部颁发的《关于善待实验动物的指导性意见》。将大鼠按体重递增顺序编号,采用随机数字法分为正常组、假手术组、模型组和IcsⅡ治疗组。所有大鼠均在温度20~25℃、湿度40%~60%的动物饲养室中统一标准喂养。
1.2 主要试剂和仪器
IcsⅡ,纯度99.1%,购于南京泽朗医药有限公司;FA2004N电子天平购于上海菁海仪器有限公司;TH4-200倒置相差显微镜购于Olympus公司;GAP-43抗体购于proteintech公司;PV6001山羊抗兔IgG/HRP聚合物、山羊血清(ZLI-9022)、浓缩型DAB试剂盒(ZLI-9032)和Harris苏木精染液(ZLI-9609)均购于北京中杉金桥公司。
1.3 模型制作及给药方法
参照王维等[6]报道的方法改进并建立大鼠坐骨神经钳夹损伤模型:麻醉大鼠,俯卧固定,脱毛、消毒,沿股后部切开、分离、游离右侧坐骨神经主干。在距梨状肌下缘5 mm处用新17 cm长止血钳尖端(第二扣)钳夹5 min,宽度为3 mm,钳夹后见坐骨神经菲薄,于神经损伤点处用10-0号显微缝线标记,逐层缝合。假手术组只暴露右侧坐骨神经,不钳夹;正常组不做任何处理;IcsⅡ治疗组在模型组的基础上予以IcsⅡ 4 mg/(kg·d)连续灌胃,其余各组予以等体积的双蒸水连续灌胃。自实验开始每只大鼠连续3 d肌注青霉素钠80 000 U。
1.4 大鼠一般情况与行为学观察
实验开始后每日观察各组大鼠右下肢瘫痪及失神经性皮肤营养不良表现,如足外翻、足趾并拢、展爪反射消失、拖曳行走、足趾红肿、自噬及皮肤溃疡形成等。
1.5 坐骨神經指数(SFI)测定
参照文献[7]的方法,分别于第4、8周采用自制宽8.5 cm、长50 cm、高10 cm的大鼠足印行走箱,一端做一暗箱以便大鼠进入。将白纸裁成行走箱等长等宽,每次测量前垫于箱底。握住大鼠将双后足置于吸有炭黑墨水的海绵垫上蘸取墨水后放入行走箱一端,让其自行走入暗室端,每侧3或4个足印留于纸上,各组收集完毕后测量。选右足(E)和左足(N)足印测定以下3个变量:①足印长度(podogram length,PL):从足跟到足尖的距离;②足趾宽度(width between the first and fifth toes,TW):第1趾到第5趾连线距离;③中间足趾距离(inter-toes distance,IT):第2趾到第4趾连线距离。精确到mm,使用最大一组数据。将上述三个变量带入Bain公式计算SFI。SFI=-38.3(EPL-NPL/NPL+109.5(ETW-NTW)/NTW +13.3(EIT-NIT)/NIT-8.8(SFI值在0±11之间为正常,-100为神经完全损伤,在-11~-100之间表示坐骨神经部分损伤或功能恢复)。
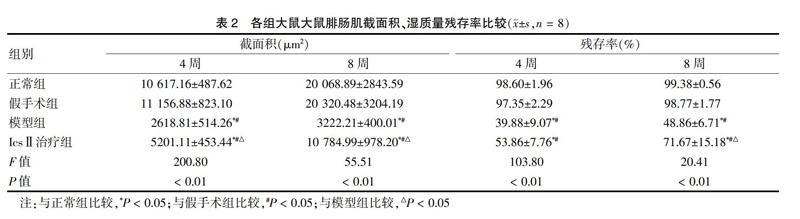
1.6 腓肠肌湿质量残存率、肌细胞截面积测定
第4、8周,麻醉后完整切取双侧小腿腓肠肌,吸去附着血液后测量湿体重质量,计算腓肠肌湿质量残存率。然后右侧腓肠肌立即用10%甲醛溶液固定、包埋,行横向石蜡切片,厚度为3 μm行HE染色,在40倍显微镜下拍照,通过Image-Pro Plus 6.0分析软件,计算每张图片的肌细胞平均截面积。腓肠肌湿质量残存率=右侧手术侧腓肠肌湿质量/左侧健侧腓肠肌湿质量×100%。
1.7 坐骨神经Masson染色
第4、8周,麻醉各组大鼠暴露手术侧坐骨神经,取钳夹损伤后10-0号线标记处坐骨神经标本,放入10%甲醛溶液固定、包埋,横向石蜡切片,厚度为3 μm行Masson染色;使用倒置显微镜,放大40倍光镜,定标值为20 μm条件下,通过Image-Pro Plus 6.0分析软件,计数损伤处横断面上所有的神经轴突数目及平均光密度。
1.8 GAP-43免疫组织化学染色
第4周和8周时,大鼠麻醉后取出钳夹处坐骨神经,常规石蜡包埋,连续横切片,切片厚度3 μm,每组选取坐骨神经组织切片各4张,行GAP-43免疫组化染色,操作按说明书进行,DAB显色,苏木精复染,1%盐酸酒精分化后中性树脂封片保存。GAP-43阳性表达呈棕黄色。染色玻片在40倍显微镜下观察拍照,通过Image-Pro Plus 6.0分析软件,计算每张图片的平均光密度值。
1.9 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,采用方差分析,组间两两比较采用q检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 大鼠行为学及SFI值变化
模型组和IcsⅡ治疗组大鼠均出现足下垂、足趾并拢、展爪反射消失、拖曳行走等右下肢瘫痪症状,SFI值近-100。模型组第2天开始,大部分大鼠右下肢趾间关节出现足趾红肿、溃疡、肌肉萎缩甚至断趾等失神经性营养不良;而IcsⅡ治疗组仅个别大鼠出现。第4周时两组大鼠跛行改善,足趾肿胀溃疡大部分恢复,出现展爪反射和后瞪动作;第8周时鼠爪明显张开,模型组和IcsⅡ治疗组均有不同程度改善。各组SFI值结果显示,第4、8周模型组和IcsⅡ治疗组均较正常组和假手术组明显降低(P < 0.05);与模型组比较,IcsⅡ治疗组SFI值明显增高(P < 0.05)。见表1。
表1 各组大鼠坐骨神经指数比较(x±s,n = 8)
注:与正常组比较,*P < 0.05;与假手术组比较,#P < 0.05;与模型组比较,△P < 0.05
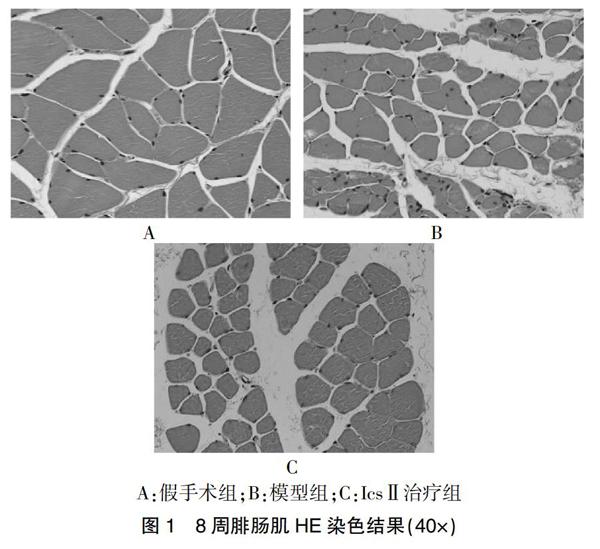
2.2 腓肠肌形态学及湿质量残存率
正常组和假手术组各时间点腓肠肌饱满,有弹性与光泽。模型组和IcsⅡ治疗组右侧腓肠肌较健侧萎缩,第8周时部分恢复,以IcsⅡ治疗组恢复最为明显。各组大鼠腓肠肌肌细胞截面积和残存率结果显示,在第4周和第8周时,与正常组和假手术组比较,模型组和IcsⅡ治疗组肌细胞截面积减小,残存率降低(P < 0.05);与模型组比较,IcsⅡ治疗组肌细胞截面积增加,残存率增高(P < 0.05)。见表2、图1。
2.3 坐骨神经Masson染色
髓鞘呈淡红色,施万细胞核呈深红褐色,神经膜呈蓝色,清晰可靠。正常组、假手术组神经纤维排列规则、致密;模型组神经纤维排列紊乱,缺失、不规则;IcsⅡ组可见神经排列基本规则,较致密。各组大鼠坐骨神经轴突数目、平均光密度值变化结果显示:第4周和第8周时,模型组和IcsⅡ治疗组与正常组和假手术组比较,坐骨神经轴突数目减少,平均光密度值降低(P < 0.05);与模型组比较,IcsⅡ治療组坐骨神经轴突数目增多,平均光密度增高(P < 0.05)。见表3、图2(封三)。
2.4 GAP-43免疫组织化学染色
第4周和8周时,GAP-43在各组坐骨神经均有表达。各时间点坐骨神经GAP-43蛋白平均光密度值结果显示,模型组和IcsⅡ治疗组表达较正常组和假手术组高(P < 0.05),而IcsⅡ治疗组表达较模型组高(P < 0.05)。见表4、图3(封三)。
3 讨论
大鼠坐骨神经损伤模型广泛用于周围神经再生的实验研究,钳夹是一种非离断性损伤,具有损伤程度较离断性损伤轻、恢复较快、观测周期短等特点。通过免疫组织化学染色结果显示,本研究坐骨神经钳夹损伤后神经束断裂,轴突、神经内膜、神经束膜破坏,仅靠完整的神经外膜维持神经干的连续性,相当于Sunderland Ⅳ度损伤。钳夹伤后坐骨神经再生不受修复方式的影响,因此消除了修复方法对周围神经损伤后功能恢复结果观察的干扰,保证了实验结果的可靠性。
周围神经损伤后神经功能的恢复取决于轴突再生的数目和质量[8-9]。本研究通过观察失神经表现、测定SFI值、腓肠肌湿质量残存率及截面积变化,发现模型组坐骨神经钳夹损伤后神经缺失症状严重,在第4周和第8周时,有不同程度恢复,表明坐骨神经钳夹损伤后其功能能自发缓慢部分恢复;而IcsⅡ治疗组较模型组恢复快,表明IcsⅡ能促进大鼠坐骨神经钳夹损伤后功能恢复。这与国内外用淫羊藿苷及淫羊藿提取物促进周围神经损伤后功能恢复一致[1-2]。在第8周时IcsⅡ治疗组仍未完全恢复,尚需更长时间观察其能否使钳夹损伤的坐骨神经完全恢复。
神经轴突数目及结构是功能的基础,本研究发现坐骨神经钳夹损伤后神经纤维排列紊乱、缺失、不规则,IcsⅡ治疗组神经排列基本规则,较致密,而正常组、假手术组神经纤维排列规则、致密。GAP-43与神经发育、轴突再生、突触可塑性密切相关,主要分布于神经元、再生的施万细胞和神经胶质细胞,参与神经元损伤后轴突再生和突触重构过程,当神经再生完成后,GAP-43又恢复到正常水平[9],被认为是神经发育和再生的重要因子和神经损伤后再生的标志性蛋白[10-11]。同时GAP-43具有促进神经纤维再生作用[12]。本研究发现GAP-43蛋白在模型组有一定的表达,进一步表明坐骨神经钳夹损伤后具有自我修复能力;IcsⅡ治疗组GAP-43表达较模型组高,说明神经损伤修复活跃,也提示GAP-43可能是IcsⅡ促进钳夹损伤后坐骨神经恢复的作用靶点之一。
关于淫羊藿提取物促进神经损伤的机制方面,Tohda等[13]在对脊髓损伤的研究中发现,淫羊藿苷促进脊髓损伤后运动功能恢复可能与其抑制促分裂原活化蛋白激酶(p38-mitogen activated protein kinase,p38MAPK)有关。Zeng等[14]发现淫羊藿苷通过激活磷脂酰肌醇-3-激酶(phosphatidylinositol-3-knase,PI3K)/Akt通路从而抑制葡萄糖合成激酶-3(glycogen synthase kinase-3,GSK-3)的激活,抑制Tau蛋白过度磷酸化,触发细胞骨架结合蛋白调节细胞骨架的延伸。Li等[15]和Gu等[16]发现IcsⅡ能提高ERK1/2、Akt和JNK1/2磷酸化水平,保护高血糖诱导的人海绵窦内皮细胞损伤。Bai等[17]发现IcsⅡ能改善勃起功能,增加盆腔神经节神经生长因子(NGF)和神经型一氧化氮合酶(nNOS)的表达;NGF具有明确的促进周围神经再生的作用,也可以通过抑制p38MAPK活性促进神经再生[18-19]。此外,轴突再生抑制因子以及与之有关的ROCK信号通路、排斥导向分子等多种机制均参与抑制或促进轴突再生[20]。因此,IcsⅡ促进周围神经修复的分子机制有待进一步研究。
[参考文献]
[1] 周岚,梅晓云.中药促周围神经再生的研究进展[J].中国中药杂志,2011,36(1):77-80.
[2] Kou Y,Wang Z,Wu Z,et al. Epimedium extract promotes peripheral nerve regeneration in rats [J]. Evid Based Complement Alternat Med,2013,2013(6):954798.
[3] Zhang J,Li AM,Liu BX,et al. Effect of Icarisid Ⅱ on diabetic rats with erectile dysfunction and its potential mechanism vis assessment of AGEs,autophagy,mTOR and NO-cGMP pathway [J]. Asian J Androl,2013,15(1):143-148.
[4] Yan BY,Pan CS,Mao XW,et al. Icariside Ⅱ improves cerebral microcirculatory disturbance and alleviates hippocampal injury in gerbils after ischemia-reperfusion [J]. Brain Res,2014,1573:63-73.
[5] Wu J,Song T,Liu S,et al. Icariside Ⅱ inhibits cell proliferation and induces cell cycle arrest through the ROS-p38-p53 signaling pathway in A375 human melanoma cells [J]. Mol Med Rep,2015,11(1):410-416.
[6] 王维,苑秀华,王中莉,等.坐骨神经损伤模型大鼠神经传导速度及损伤运动神经元内生长相关蛋白43表达与磁刺激干预[J].中国组织工程研究与临床康复,2011, 15(46):8617-8620.
[7] Bain JR,Mackinnon SE,Hunter DA. Functional evaluation of complete sciatic,peroneal,and posterior tibial nerve lesions in the rat [J]. Plast Reconstr Surg,1989,83(1):129-138.
[8] 朱盛修.周围神经显微修复学[M].北京:科学出版社,1991:40-46.
[9] Moradzadeh A,Brenner MJ,Whitloch EL,et al. Bipolar electrocautery:a rodent model of sunderland third-degree nerve injury [J]. Archives of Facial Plastic Surgery,2010, 12(1):40-47.
[10] Kaneda M,Nagashima M,Mawatari K,et al. Growth-associated protein43(GAP43)is a biochemical marker for the whole period of fish opticnerve regeneration [J]. Adv Exp Med Biol,2010,664:97-104.
[11] Denny JB. Molecular mechanisms,biological actions,and neuropharmacology of the growth-associated protein GAP-43 [J]. Curr Neuropharmacol,2006,4(4):293-304.
[12] Zhang Y,Bo X,Schoepfer R,et al. Growth-associated protein GAP-43 and L1 act synergistically to promote regenerative growth of Purkinje cell axons in vivo [J]. Proc Natl Acad Sci U S A,2005,102(41):14883-14888.
[13] Tohda C,Nagata A. Epimedium koreanum extract and its constituent Icariin improve motor dysfunction in spinal cord injury [J]. Evid Based Complemen Alternat Med,2012,2012:731208.
[14] Zeng KW,Ko H,Yang HO,et al. Icariin attenuates β-amyloid-indueed neurotoxieity by inhibition of tau protein hyperphosphorylation in PC12 cells [J]. Neuropharmacology,2010,59(6):542-550.
[15] Li H,Xu Y,Guan R,et al. Icariside Ⅱ prevents high-glucose-induced injury on human cavernous endothelial cells through Akt-eNOS signaling pathway [J]. Andrology,2015,3(2):408-416.
[16] Gu J,Sun X,Wang G,et al. Icariside Ⅱ enhances Nrf2 nuclear translocation to upregulate phase Ⅱ detoxifying enzyme expression coupled with the ERK,Akt and JNK signaling pathways [J]. Molecules,2011,16(11):9234-9244.
[17] Bai GY,Zhou F,Hui Y,et al. Effects of Icariside on corpus cavernosum and major pelvic ganglion nuropathy in streptozotocin-induced diabetic rats [J]. International Journal of Molecular Sciences,2014,15(12):23294-23306.
[18] Wang Z,Han N,Wang J,et al. Improved peripheral nerve regeneration with sustained release nerve growth factor microspheres in small gap tubulization [J]. Am J Transl Res,2014,6(4):413-421.
[19] 范麗苑,涂玲.大鼠舌下神经压榨后p38MAPK的活化及外源性神经生长因子促进神经再生作用的研究[J].华西口腔医学杂志,2010,28(5):479-483.
[20] Joshi AR,Bobylev I,Zhang G,et al. Inhaition of Rho-kinase differentially affects axon regeneration of peripheral motor and sensory nerves [J]. Exp Neurol,2015,263:28-38.
(收稿日期:2015-11-04 本文编辑:张瑜杰)

